前
言
病例介绍
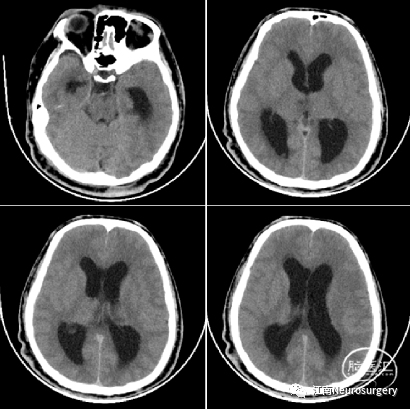
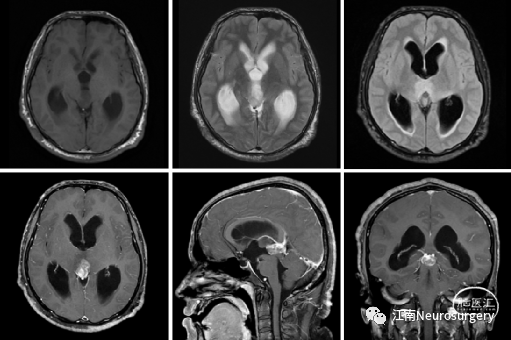
图2. 头颅MRI见松果体区占位,不均匀强化,伴有梗阻性脑积水。

图3. 实验室检查,血清(A)和脑脊液(B)中的甲胎蛋白及β-HCG水平均位于正常范围内。
诊治经过
 图图4. A:经右侧额角穿刺,脑室镜下可见三脑室底、乳头体等;B-D:电凝烧灼三脑室底进行造瘘;E:扩张钳扩大瘘口,打开Liliequist膜;F:造瘘完成,三脑室与蛛网膜下腔相通。
图图4. A:经右侧额角穿刺,脑室镜下可见三脑室底、乳头体等;B-D:电凝烧灼三脑室底进行造瘘;E:扩张钳扩大瘘口,打开Liliequist膜;F:造瘘完成,三脑室与蛛网膜下腔相通。
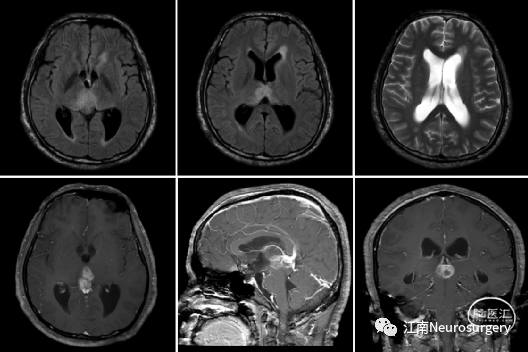
图5. 三脑室底造瘘术后复查头颅MRI,脑积水缓解。
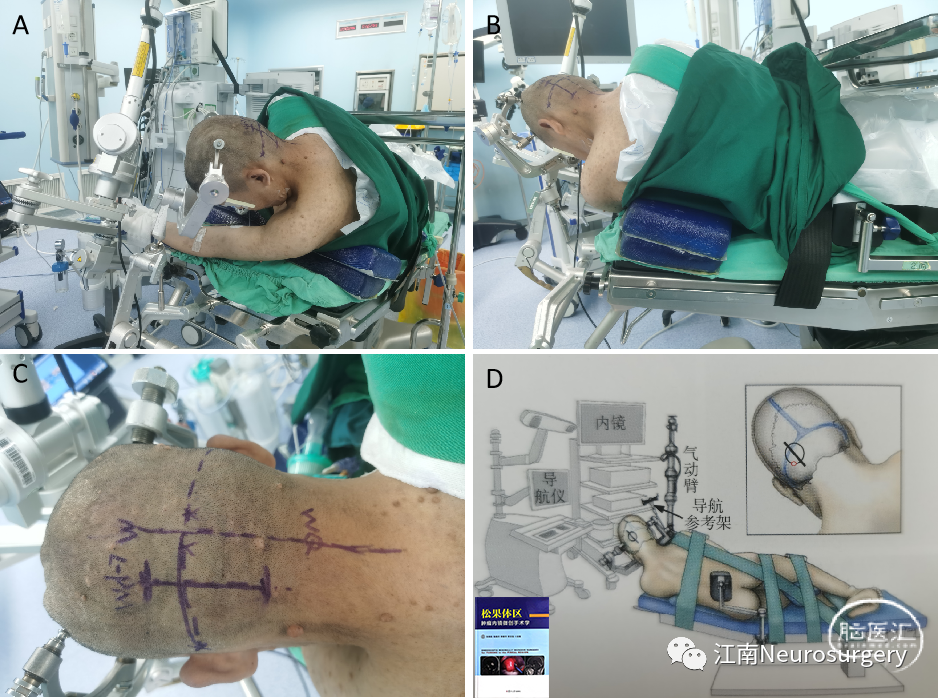
图6. A-B:左侧俯卧位,Mayfield三钉头架固定,安装连接4K内镜、气动臂等;C:标记手术切口;D:体位及设备摆放模式图。
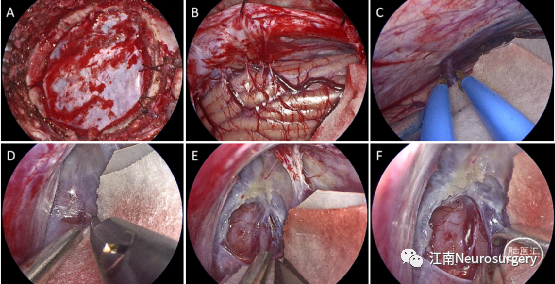
图7. A:常规开颅,骨瓣大小约3×3cm;B:打开硬脑膜后可见天幕和小脑间的系带;C:幕下小脑上间隙有1根桥静脉,将其电凝切断;D-F:先打开四叠体池外层蛛网膜,进一步释放脑脊液,然后再逐步打开内层蛛网膜,暴露、分离肿瘤。
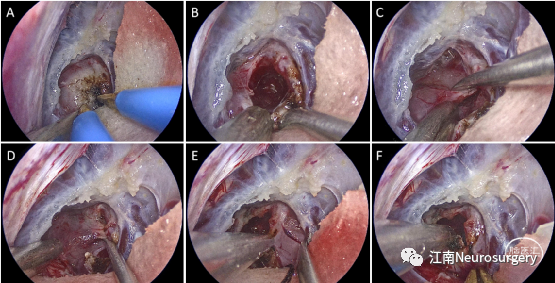
图8. A:电凝烧灼肿瘤表面血管;B:充分瘤内减压;C:分离肿瘤顶部边界;D:分离肿瘤左侧边界;E:分离肿瘤右侧边界;F:分离肿瘤底部边界。
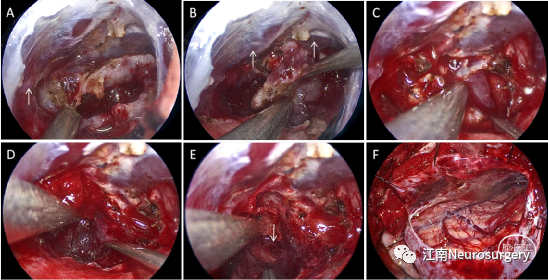
图9. A:瘤内充分减压后继续分离肿瘤左侧边界,可见脉络膜后内侧动脉(白色箭头);B:分离右下方边界,肿瘤表面有静脉血管,术野内可见肿瘤上方的双侧大脑内静脉(白色箭头);C:向前方继续切除肿瘤,可见肿瘤与右侧丘脑枕的边界;D:肿瘤前下极与与丘脑及中脑顶盖粘连较紧密,界限不清;E:用吸引器吸出下方的肿瘤后可见中脑导水管上口,有脑脊液流出;F:全切肿瘤后退出内镜的全局术野,小脑表面无明显牵拉损伤。
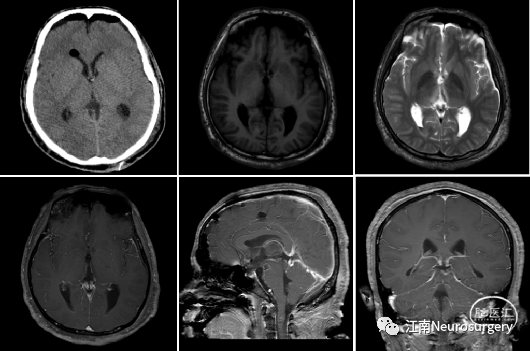
图10. 松果体肿瘤切除术后复查头颅CT及MRI。
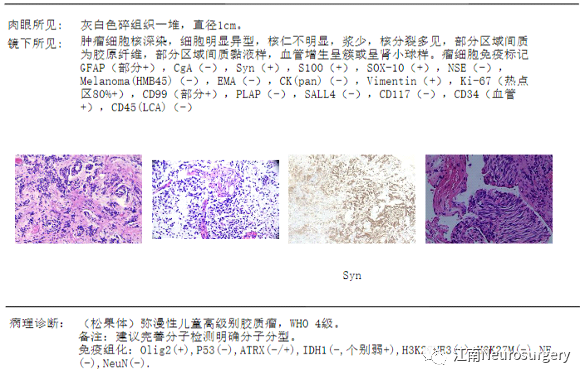
图11. 病理诊断报告:(松果体)弥漫性儿童高级别胶质瘤,WHO IV级。
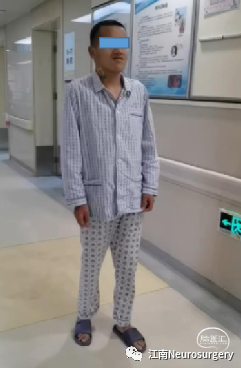
图12. 出院时状态,无神经系统后遗症,无头痛、呕吐,四肢肌力正常,行走稳健。
讨论
对于松果体区肿瘤的诊断要分4个层面进行[7]。首先,依据临床症状和体征,对出现头痛、呕吐等颅高压表现、同时出现Parinaud综合征等特征性体征或性发育异常等异常表现的病例,要考虑该部位病变的可能,应及时进行CT及MRI检查,一般可以明确这个区域肿瘤的诊断。其次,一旦松果体区肿瘤诊断成立,应进一步行脑脊液、血清的肿瘤标志物如β-HCG、AFP和胎盘碱性磷酸酶水平检测及脑脊液脱落细胞检查,并结合患者的临床特点、影像学检查的特点,对肿瘤的病理性质做出初步的判断,这对进一步治疗策略的决定非常重要。要特别注意患者的年龄、性别及脑脊液和血清中肿瘤标志物的高低对肿瘤性质判断的参考意义,如生殖细胞肿瘤好发于儿童和青少年男性,β-HCG和/或AFP异常增高要考虑生殖细胞源性肿瘤的诊断等。另外,肿瘤在影像学上的生长方式也对判断肿瘤性质有帮助,如生殖细胞瘤容易向第三脑室内生长,多发性的生殖细胞源性肿瘤可同时累及松果体区和鞍区,成熟畸胎瘤在MRI上的信号为非常明显的混合性信号等。再次,对于松果体区肿瘤必须判断是否有梗阻性脑积水发生。由于这个区域肿瘤易堵塞中脑导水管,因而松果体区肿瘤患者发生梗阻性脑积水为大概率事件。对于梗阻性脑积水及其严重程度的判断对进一步治疗方案的决定甚至对于挽救生命至关重要。最后是病理诊断,这是决定治疗和预后的最主要和根本因素。
松果体区胶质瘤通常发生于年轻人,占所有松果体区肿瘤的14%~22%[8]。常见的胶质瘤病理学类型包括弥漫性星形细胞瘤(24.6%)、胶质母细胞瘤(18.6%)、室管膜瘤(15.5%)、毛细胞星形细胞瘤(14%)、间变性星形细胞瘤(9.2%)、间变性室管膜瘤(8.3%)和少突胶质瘤细胞(5.7%)。罕见的病理学类型包括室管膜下巨细胞星形细胞瘤、毛状黏液样星形细胞瘤、多形性黄色星形细胞瘤、节细胞胶质瘤和节细胞胶质母细胞瘤等也有文献报道[7]。松果体区胶质瘤主要起源于松果体周围脑实质,如顶盖、丘脑、胼胝体压部等,极少起源于松果体。肿瘤常呈浸润性生长,占位效应较明显。CT平扫呈等或低密度,亦可呈混杂密度。MRI图像T1WI多呈稍低信号,T2WI呈稍高或高信号。强化程度取决于肿瘤的分级,通常低级别可不强化或轻度强化,高级别则显著强化。松果体区胶质瘤需进行多角度观察,确定病灶起源。例如,顶盖胶质瘤矢状位可观察到顶盖的增厚增大。但病灶较大时,确定病灶起源可能仍存在困难。胶质母细胞瘤可发生软脑膜和室管膜转移,需要与松果体区母细胞瘤等鉴别。
松果体区肿瘤由于解剖所处的部位容易压迫堵塞中脑导水管,造成梗阻性脑积水,患者通常就诊时以严重的颅高压症状为表现,以往都是采用脑积水引流和脑室-腹腔分流来处理脑积水。其中,脑积水外引流是临时措施,不能获得肿瘤病理学诊断,并且容易造成颅内感染,过度引流还会造成相应的并发症。脑室-腹腔分流后放疗是许多医院常规处理松果体肿瘤的方法,这样的方法也不能获得肿瘤的病理学诊断,同时会造成肿瘤的腹腔种植。随着对松果体肿瘤手术治疗经验的增加,发现单纯的生殖细胞瘤并不多见,占16.2%。有较多的混合性生殖细胞肿瘤占18.1%。手术切除获得完全的病理学诊断,为精准的综合治疗提供了可能。在内镜时代,已经常规采用ETV治疗脑积水[9-10],随后再进行肿瘤的切除。有些单位采用ETV+肿瘤活检的方法,根据活检结果确定后续的治疗方案。ETV同时手术活检容易出血,活检结果比较局限,不能代表完整的病理学诊断;同时,活检还可能造成不必要的脑室系统肿瘤的种植转移。ETV后再手术的方案具有以下优势[7]:
(1)迅速解决脑积水、缓解颅内高压,为进行从容地肿瘤切除争取了宝贵的时间。
(2)ETV术后有时间对患者进行全面的检查,了解相关的身体状况等,为择期手术打下基础。
(3)长期ICP增高,造成患者呕吐、营养状况较差和电解质紊乱,在ETV缓解颅内高压后可以进行水、电解质紊乱的纠治和营养补充,改善体质,为肿瘤切除术提供身体保障。
(4)长期脑积水会造成脑组织间隙水分增加,脑组织处于水肿状态,特别是在脑室壁周围更加严重。这种状态的脑组织顺应性较低,容易手术损伤;随着ETV后脑积水缓解,这样的水肿会逐步好转,脑组织顺应性增加,更加耐受手术过程中的分离和牵拉操作,可以降低手术造成的损伤。
(5)不同于外引流和脑积水分流,ETV术后脑室在相当时间内不会缩小,加上组织间隙水肿减少,甚至可能短时间内脑室腔会增大。这样就为手术提供了有利的空间。
(6)ETV术后ICP降低,术中动静脉压也会降低,出血会大大减少。
(7)ICP降低,可以避免使用脑室引流,直接切开硬脑膜,进入松果体区。
(8)ETV可以意外地发现脑室中的转移肿瘤,等于提供了早期诊断。
(9)由于松果体手术过程中或多或少会电凝切断一些引流静脉,加上手术本身的创伤,术后会出现不同程度的脑水肿,而ETV缓解了脑积水和脑组织间隙水肿,这样就有利于患者安度术后水肿期。
(10)松果体肿瘤即使完全切除,术后仍然可能发生脑积水。可能是由于手术后中脑导水管粘连闭塞或手术区域粘连堵塞等造成迟发性脑积水。
(11)手术后肿瘤复发同样会再次出现脑积水,如果曾经行ETV,可以延缓脑积水的发生,为进一步手术等治疗提供有力的保障。
(12)ETV时可以留取脑脊液,进行相关肿瘤标志物的检查,为诊断提供依据。
松果体肿瘤有几种不同的手术入路,这个取决于肿瘤的位置和形态特征,还有外科医生的经验和习惯、舒适度等。常用的手术入路如下:
幕下小脑上入路:即所谓的Krause入路,其常规是沿着中线进入(midline approach),而小脑的牵拉和静脉系统的阻挡是该入路的主要弊端。中线外入路(off-midline approach)是该入路的重要改良或亚型,包括旁中线(paramedial)、外侧(lateral)及远外侧(far lateral)幕下小脑上入路。幕下小脑上入路较枕部经小脑幕入路的优势在于:无需牵拉枕叶、结构处于正立位而易于辨认、可同时暴露双侧结构。然而,常规的中线入路有如下缺陷:(1)因高耸的小脑蚓部结构及两侧的天幕游离缘遮挡而显露范围较小,深静脉复合体以上、上丘以下、丘脑枕以外均难以暴露。(2)小脑上间隙内连接小脑和幕窦、横窦或窦汇的桥静脉阻挡视野而常需牺牲,加之对小脑的牵拉,易引起术后小脑肿胀。(3)松果体仍被深部静脉阻挡。(4)坐位的空气栓塞风险。而中线外入路从侧方暴露松果体,较中线入路有如下优势:(1)在小脑上间隙、四叠体池两个层面处,均可避开静脉的遮挡。因此可更大程度的保留该区域的静脉。当然,由于静脉系统存在较大解剖变异,需结合术前影像,根据具体情况选择不同的中线外入路。(2)虽然松果体的深度随着入路与中线的偏离而逐渐增大,但小脑幕面的高耸程度逐渐减小。因此,从减小对小脑牵拉来看,中线外入路也优于中线入路。其劣势在于对侧结构暴露的限制。在过去的几年中,旁正中幕下小脑上部入路对松果体肿瘤切除取得了令人满意的效果[15]。这种入路通常采用侧卧位完成,缓解坐位手术的缺点,同时尽量避免患者肩膀的阻挡,术者操作姿势更为舒适。此外,更好的利用重力作用降低颅内静脉压,使小脑自然下垂,扩大手术通道,获得了更为平坦和便捷的手术路径,使得手术区域有更好的显露。而且,旁正中入路不需要对窦汇进行操作。小脑半球侧面和小脑幕之间的通路只有少数桥静脉,可以避免损伤很多中线的静脉。如果需要,切开小脑幕还可以获得更大的暴露范围。所以,越来越多的学者倾向于采用神经内镜下经旁正中幕下小脑上入路来处理松果体区病变。
参考文献
向上滑动查看所有内容
作者简介
吴学潮 主治医师
江南大学附属中心医院

江南大学附属中心医院(无锡市第二人民医院)神经外科始建于1976年,是江苏省医学重点学科、临床重点专科,北京王忠诚脑科中心和院士工作站,国家博士后科研工作站,无锡市重点学科,“太湖人才计划”顶尖医学专家团队。科室目前设南北两院区,有独立NSICU,床位共110张。年收治5000多人次,手术量1200余台,微创手术率大于60%。现有专科医生30人,其中高级职称15人,博士研究生导师2人,硕士研究生导师4人,教授3人,副教授5人,博士13人。科室目前设有 7 大亚专科:神经内镜及垂体瘤微创中心、脑血管病及介入治疗中心、颅底外科中心、脑胶质瘤中心、神经创伤及重症治疗中心、功能神经疾病诊疗中心、脊柱脊髓疾病中心。在国内、省内领先开展神经内镜下微创手术、脑血管介入手术、神经导航引导下微创手术等,手术成功率和肿瘤全切除率高。
经过多年的发展,神经外科建立了无锡市神经外科研究所、中国神经内镜培训基地(首批)、国家高级脑卒中中心、无锡市神经疾病诊疗中心。与澳大利亚威尔士医院、美国纽约长老会医院、德国格赖夫施瓦德大学附属医院和加拿大麦吉尔大学神经研究所等国外著名神经外科中心建立密切联系和合作。在2021年科室与首都医科大学附属北京天坛医院神经外科王硕教授团队合作,成功创建为“太湖人才计划”顶尖医学专家团队,为科室进一步发展提供了新的动力和平台。
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。





