
【大家说】栏目,关注脑疾病转化医学前沿,综合研究成果概述、研究作者自述和国内权威专家解读。本期栏目,我们特别邀请到来自中国医学科学院肿瘤医院神经外科的万经海教授,为我们解读并分享最新发表在《Nature Medicine》上的关于帕博利珠单抗(Pembrolizumab)治疗不同组织学类型的脑转移瘤的II期试验结果。
一、研究概述
脑转移瘤(BM)是肿瘤学中一个日益严峻的挑战,其发病率日渐升高,但治疗方法仍然有限。由于最近的指南建议扩大对BM的筛查,因此越来越多癌症患者的脑转移病变相对较小,且症状很轻;此外,其他部分患者的BM位于无法进行手术的部位。这些情况表明,穿透中枢神经系统(CNS)的全身疗法可能存在机会。
近日,一项单臂、开放标签的II期试验评估了帕博利珠单抗对不同组织学类型BM队列的脑转移瘤疗效,相关结果于2023年6月2日发表在《Nature Medicine》(IF:82.9/Q1)上。

2016年10月6日至2018年10月16日期间,共有58例BM患者入组,分为未治疗组(A组,10例)和进展组(B组,48例)。入组患者先前确诊的原发肿瘤包括乳腺癌、黑色素瘤、非小细胞肺癌、小细胞肺癌、垂体瘤及其他癌症。对于A组,如果患者已对原有或颅外的肿瘤进行过放疗、手术切除或全身治疗,但同时存在至少1个未经任何治疗的BM,便可允许入组;B组纳入进展性BM患者,其此前接受过诸如放疗或手术的CNS针对性治疗。
研究的主要终点是A、B两组的总体颅内获益率,以完全缓解率(CR)、部分缓解率(PR)或神经肿瘤应答评估(RANO)BM标准中的疾病稳定率(SD)进行定义。次要终点包括OS、颅外缓解率(以实体瘤疗效评价标准[RECIST]的1.1标准进行定义)、颅内进展时间(TTPCNS)、颅外进展时间(TTPextracranial)和毒性作用。
疗效和安全性分析中共纳入了57例患者。结果显示,其总体颅内获益率为42.1%(24/57,90% CI:31%~54%),因此研究达到了主要终点。具体而言,A、B组分别有3例(33.3%;90% CI:10~65%)和21例(43.8%;90% CI:31~57%)患者有颅内获益。值得注意的是,队列中有5例患者(8.8%;90% CI:4~18%)的颅内缓解达到了PR或CR。
次要终点方面,两组患者的中位OS为8.0个月(90% CI:5.5~8.7个月),A、B组分别为6.5个月(90% CI:4.5~18.7个月)和8.1个月(90% CI:5.3~9.6个月)。1年OS率为31%(90% CI:19~44%),2年OS率为14%(90% CI:6~24%)。7例患者(12.3%)在入组后的存活时间超过2年,其原有肿瘤的组织学类型包括乳腺癌(5例:2例HER2和HR阳性,2例三阴性,1例HER2阴性/HR阳性)、黑色素瘤和腺泡状软组织肉瘤。

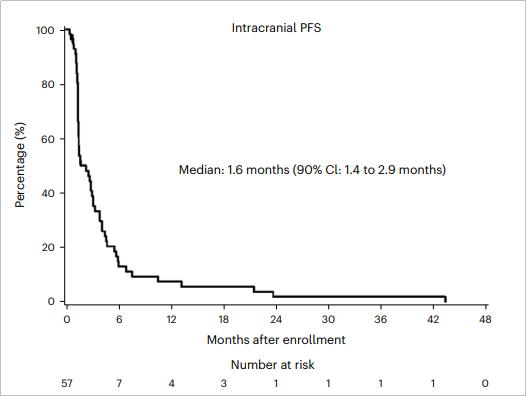
两组患者的总体中位TTPCNS为1.6个月(90% CI:1.4~2.9个月),A、B组分别为1.6个月(90% CI:1.2~4.5个月)和2.2个月(90% CI:1.4~3.1个月);有颅内获益的24名患者,中位TTPCNS为4.1个月(90% CI:3.1~5.5个月)。

颅外病变方面,17例患者在入组时无可测量的颅外病变。其余40例患者的RECIST RR为7.5%(3/40;90% CI:2~18%),颅外获益率为45%(18/40;90% CI:31~29%)。总体中位TTPextracranial为4.5个月(90% CI:2.7~8.0个月),A、B组分别为4.5个月(90% CI:1.2~6.7个月)和4.6个月(90% CI:2.7~8.1个月)。

安全性和耐受度方面,所有患者均发生了至少1件不良事件。30例患者(52%;90% CI:41~64%)发生了≥1件至少可能与治疗相关的3级或更高级不良事件;2例患者发生了至少可能与治疗相关的4级不良事件(脑水肿)。
总之,研究结果表明,阻滞PD-1可能有利于特定的BM患者群体,同时应进行下一步研究,以确定耐药性相关的生物标志物和机制。
+ + + + + + + + + + +
文章来源
Brastianos PK, Kim AE, Giobbie-Hurder A, et al. Pembrolizumab in brain metastases of diverse histologies: phase 2 trial results. Nat Med. 2023;29(7):1728-1737. doi:10.1038/s41591-023-02392-7
二、作者自述
下一步,研究组建议调查与治疗反应相关的生物标志物,特别是针对研究中的“特殊反应者”,这可能有助于预测最可能对治疗有反应的患者群体。作者指出,“还需更多研究来确定这些患者肿瘤的特定方面或导致如此有利反应的肿瘤微环境。”
“我们的研究显示了检查点抑制剂在未来作为BM治疗策略的前景。同时,研究还表明,给予检查点抑制剂的决策不应仅基于原有肿瘤的来源——可能还有一些亟待确认的因素可以预测肿瘤缓解。未来识别这些因素的研究可能有助于指导、告知和定制BM的治疗。”Brastianos博士最后表示。
三、万经海教授的权威解读
然而,虽然研究结果充满希望,但仍存在许多问题:
首先,颅内获益率为42.1%,但颅内RR仅为8.8%;而且,ICI的高毒性反应率不容忽视,因此寻找可以预测治疗反应的生物标志物,把预计免疫治疗效果好的病例筛选出来,进行精准的免疫治疗,具有重要意义。
其次,这项研究中,无论是主要终点还是次要终点(颅内病变方面),B组的结果都好于A组;换句话说,此前接受过诸如放疗或手术等颅内治疗的进展性BM患者,在ICI治疗中获得了相较未治疗组更好的结果。是否是经过治疗的肿瘤可能具有更高几率的突变从而导致对ICI更高的易感性,还需要多中心、大样本验证。
再次,在多个实例中,ICI治疗的颅外和颅内疾病负担之间存在不同反应,这一观察结果说明了一个临床困境,即颅内疾病的充分治疗可能是以颅外疾病的进展为代价的,反之亦然。因此,将来是否能够设计出一种ICI联合方案,旨在同步颅内外的治疗反应,可能是BM治疗有希望的重要挑战。
专家介绍
万经海 教授
中国医学科学院肿瘤医院
神经外科主任,主任医师,博士生导师
中国抗癌协会肿瘤神经病学专委会主任委员
中国临床肿瘤学会(CSCO)神经肿瘤专家委员会副主任委员
北京肿瘤学会神经肿瘤专业委员会候任主任委员
擅长微创手术治疗各种颅脑颅底和椎管内肿瘤;主编专著《脑膜瘤》《颅底肿瘤外科学》《中国肿瘤整合诊治指南——神经保护》,主译《肿瘤相关神经系统并发症》;承担国家自然科学基金等各类课题30项,发表SCI论文42篇
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。






