第一作者:常磊,董文文
通讯作者:章文斌
其他作者:罗备,邱畅,卢越,林兴建
作者单位:南京医科大学附属脑科医院

REF: Chang L, Dong WW, Luo B, et al. Deep brain stimulation improves central nervous system inflammation in Parkinson's disease: Evidence and perspectives [published online ahead of print, 2023 Mar 21]. CNS Neurosci Ther. 2023;10.1111/cns.14167. doi:10.1111/cns.14167
PMID: 36942520
关键词:帕金森病,脑深部刺激,正受激活调节正常T细胞表达和分泌因子,肿瘤坏死因子α,炎症,免疫紊乱
背 景
在帕金森病中,炎症可能导致多巴胺能神经元的退化。之前的研究表明,炎症介质主要促成了这种现象。另一方面,脑深部刺激等侵入性神经调控方法对PD具有更好的治疗效果。其中一个可能性是DBS通过影响炎症来改善PD。因此,我们进一步探索了炎症介质和DBS在PD发病中的作用机制。
方 法
我们使用Luminex分析方法测量了109名术前进行DBS的PD患者、49名术后进行DBS的PD患者以及113名年龄和性别匹配的对照组中的两个炎症标志物,即RANTES和TNF-α的血清水平。随后,对不同组别的血浆蛋白数据进行了统计分析。
结 果
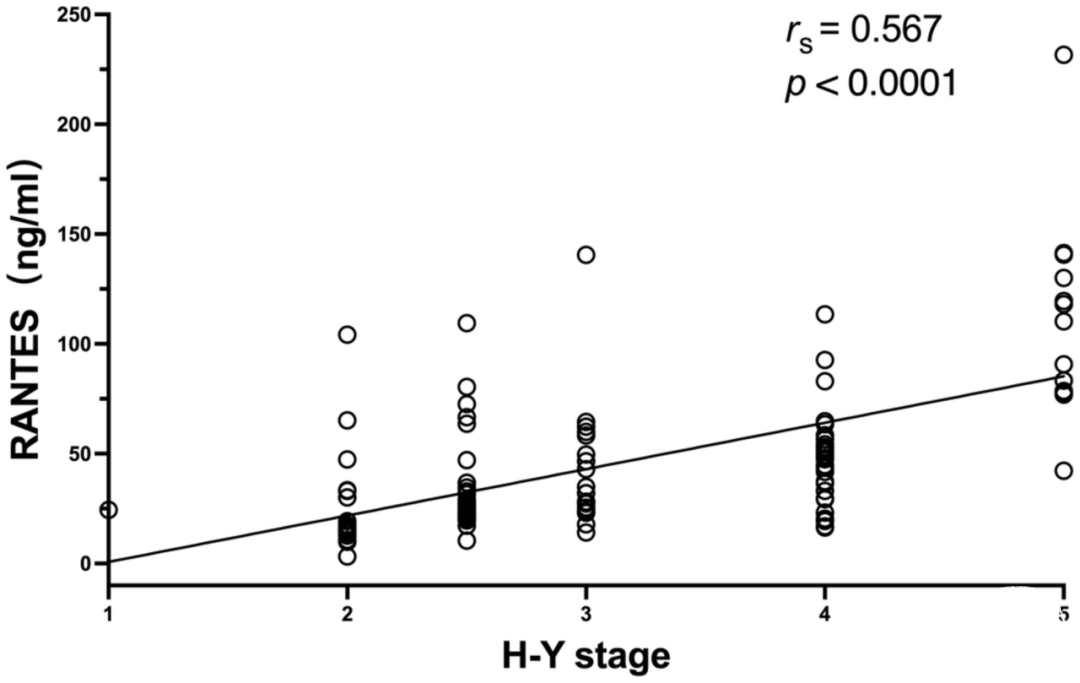
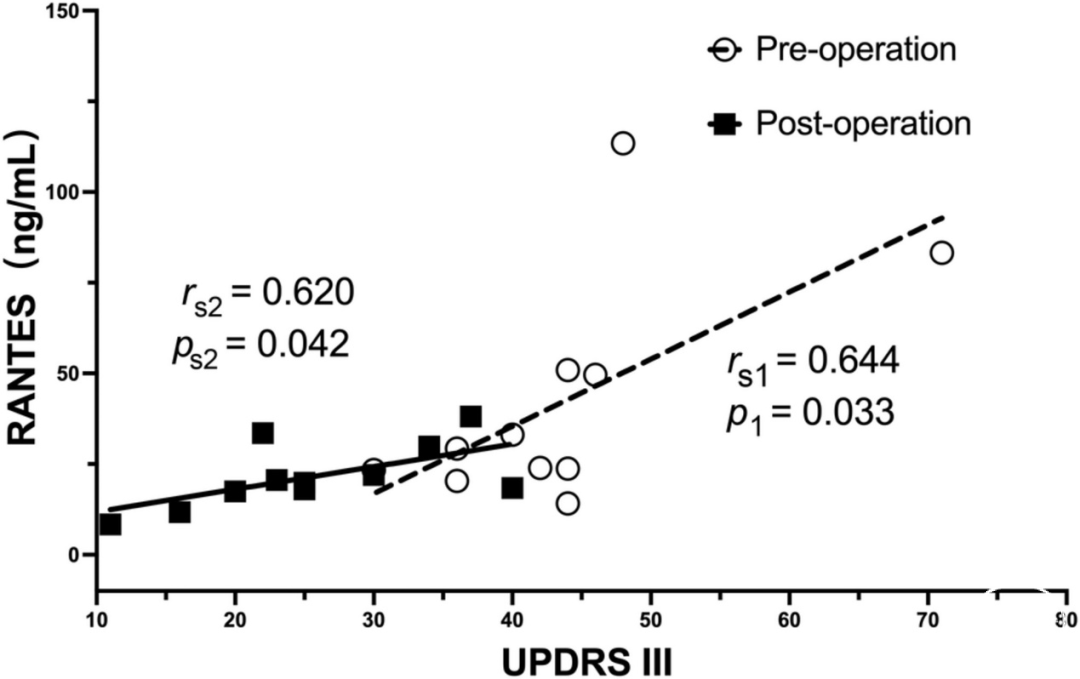
在这三个组别之间,RANTES(p<0.001)和TNF-α(p=0.005)的水平差异显著。在术前PD患者中观察到RANTES水平与Hoehn-Yahr(H-Y)分级之间的强烈且显著的相关性(rs=0.567,p<0.001)。在匹配的患者中观察到RANTES水平与统一帕金森病评定量表Ⅲ(UPDRS III)评分之间的显著相关性(rs1=0.644,p=0.033和rs2=0.620,p=0.042)。TNF-α水平则没有观察到相关性。
结 论
这项研究的结果表明,PD患者存在持续的炎症特征,可能是通过激活单核细胞、巨噬细胞和T淋巴细胞并将它们招募到中枢神经系统(CNS)中实现的。DBS显示出对PD具有显著的治疗效果,可能是通过改善中枢神经系统的炎症环境实现的。
引言
材料和方法
病人和对照组
在这项回顾性研究中,我们招募了2017年10月至2019年10月期间在南京医科大学附属脑科医院接受治疗的158名帕金森病(PD)患者。所有患者根据运动障碍学会PD临床诊断标准由两名神经内科医生诊断为PD,并满足以下标准:(i)在任何血清学检查或临床检查中无活动性感染或全身性炎症的证据;(ii)在招募前3个月内没有使用类固醇、非类固醇或抗炎药物;(iii)没有认知功能障碍,如痴呆、谵妄和包括焦虑和抑郁障碍在内的精神障碍的证据;(iv)愿意并能够参与长期随访。根据干预的不同,PD患者被分为术前组(n=109)和术后组(n=49)。对照组(n=113)从南京医科大学附属脑科医院体检中心招募。对照组中的所有人都是健康的,没有神经退行性疾病的症状。该研究已获得南京医科大学附属脑科医院伦理委员会的批准,所有参与者在入组前提供了书面知情同意。
靶点,DBS参数和左旋多巴等效剂量
样本采集和分析
在静息状态下,于上午8:00至10:00之间采集外周静脉血样本(5mL),在停药(OFF-medication)/开启DBS(ON-DBS)后经过12小时的洗脱期。为避免术后炎症的影响,术后1个月再次采集血样。样本在室温下凝固30分钟后,以3000rpm离心15分钟。然后,收集上清液,转移到1.5mL的冷冻保存管中,并在-80℃保存,直至进一步分析。分析使用来自Millipore Corporation的Luminex试剂盒(美国马萨诸塞州)。按照制造商的说明进行试验,以确定40种蛋白质的血浆水平。适当稀释的血浆样品与抗体偶联微球孵育,然后与生物素化检测抗体孵育,然后加入链亲和素-植红蛋白。捕获的微球复合物使用FLEXMAP 3D系统(Luminex Corporation,美国德克萨斯州)进行测量,仪器设置如下:每个微球事件数为40,样本大小为50μL,鉴别门限为8000-15000。收集原始数据(平均荧光强度),然后进一步处理以计算蛋白质浓度。
数据预处理
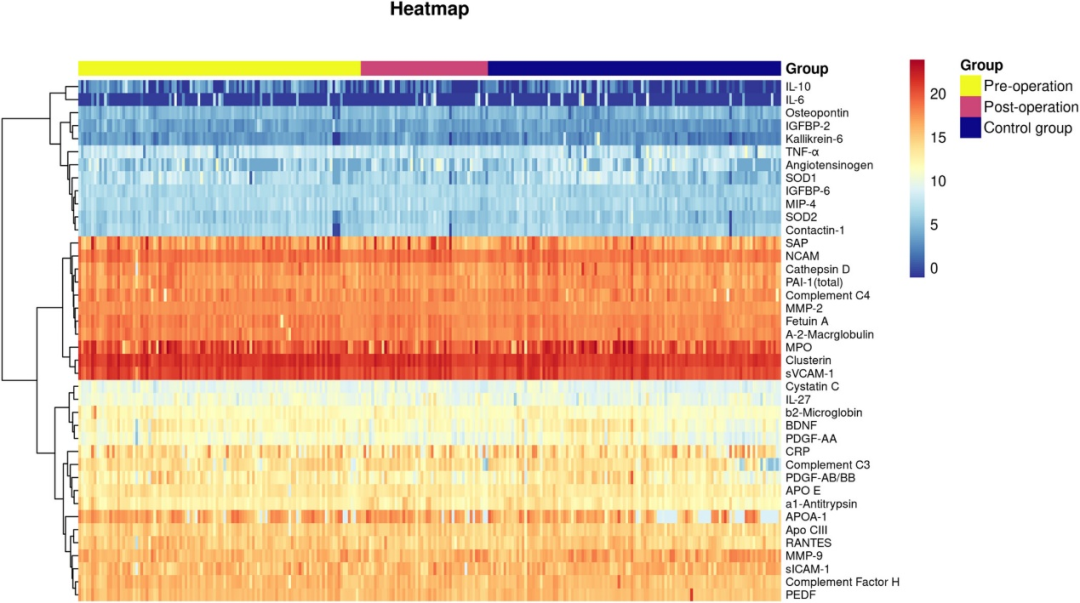

统计分析
分别用Shapiro-Wilk检验和Levene检验来确认所有变量的正态性和方差的同质性的假设。由于偏离正态分布或方差的异质性,使用非参数检验(Mann-Whitney检验,Kruskal-Wallis检验)来比较组间RANTES和TNF-α水平。除非另有规定,当数据符合正态性时,使用t检验。Spearman相关系数用于评估所有数据之间的关系。单向方差分析(ANOVA)和卡方检验也在适当时候使用。在正态分布下,数据以平均值±标准差(SD)表示,在偏态分布下,以中位数(四分位数范围,IQR)表示。结果在P<0.05时被认为具有统计学意义。统计分析使用SPSS 26(IBM,Chicago,IL,USA)和R软件(4.2.0版)进行。
结果
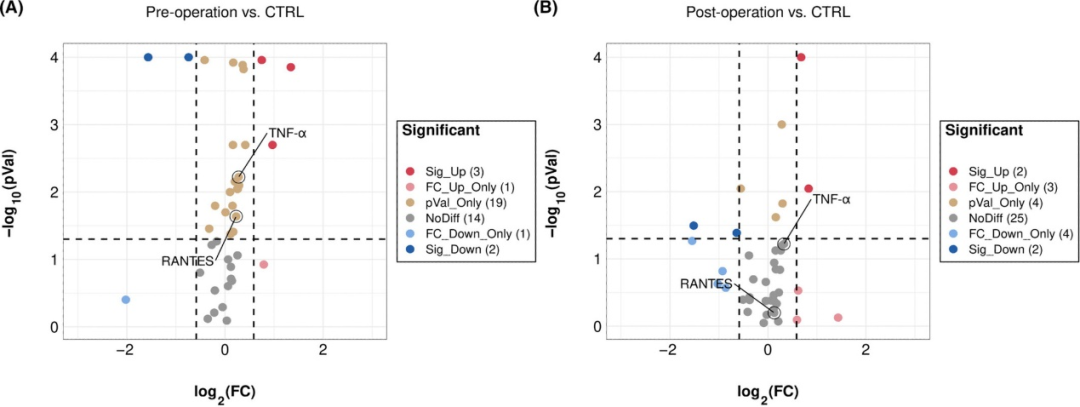
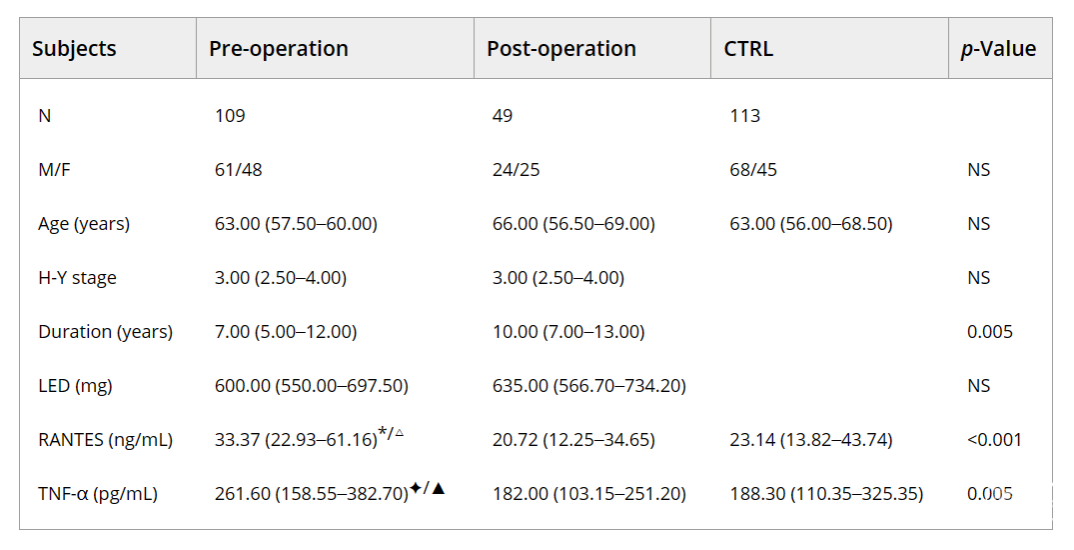
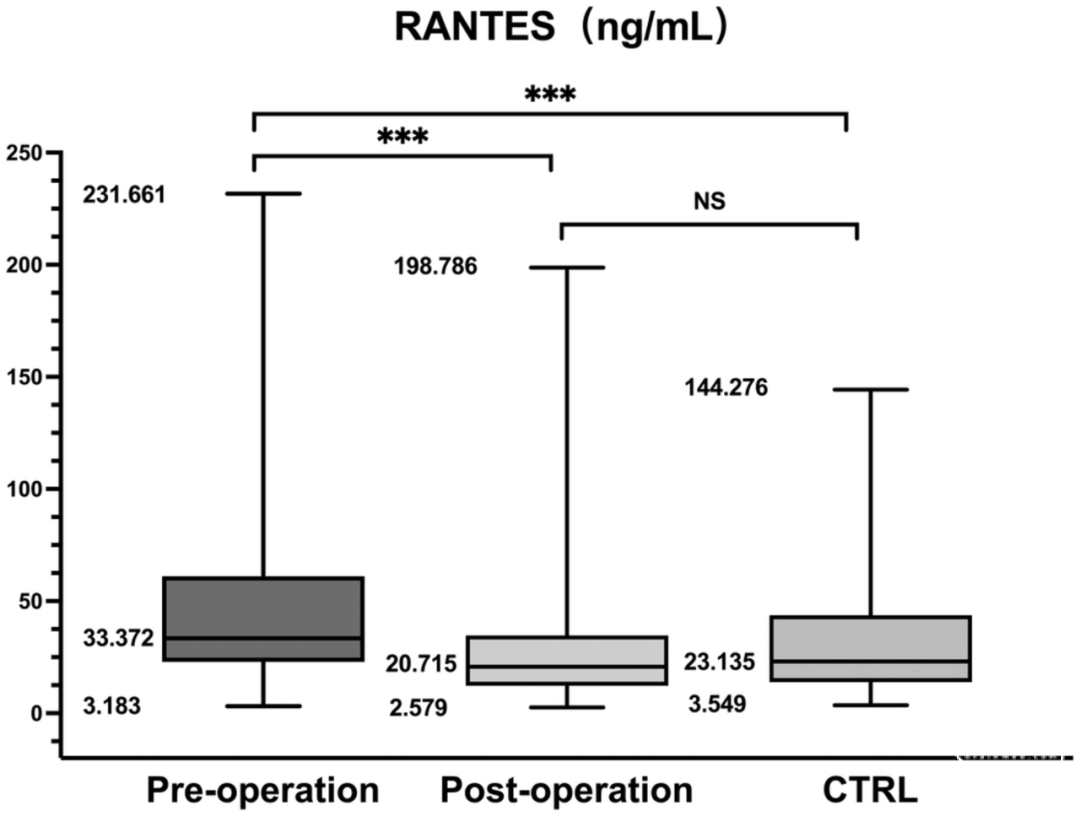
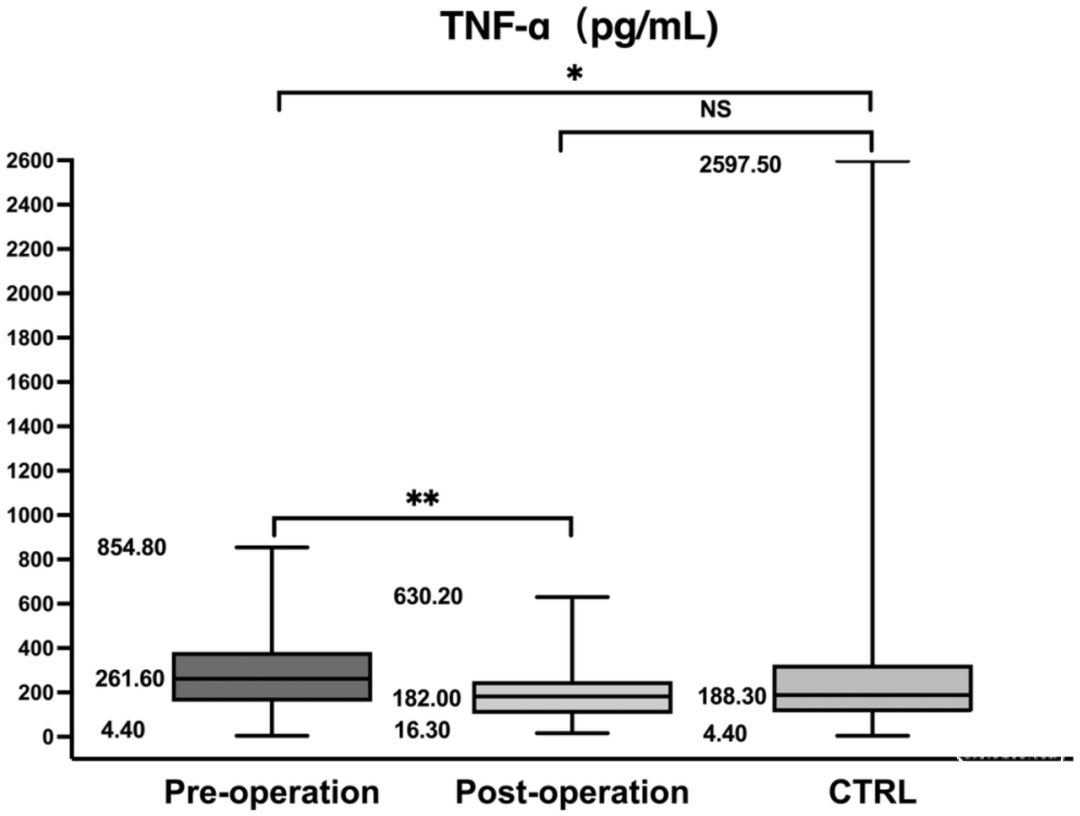
表2总结了参与者的临床和人口学特征。各组之间在性别、年龄或H-Y期方面没有明显差异,但在病程时间方面有明显差异(P=0.005)。与对照组相比,PD组的RANTES和TNF-α水平有明显差异(分别为P<0.001和P=0.005)。比较显示,术前和术后组与对照组之间的RANTES和TNF-α水平明显增加(*p<0.001,△p<0.001,✦p=0.005,▲p=0.002,图3,图4)。由于其他组没有变化,所以只分析了手术前组的H-Y分期和炎症标志物水平之间的关系。在手术前组,血清RANTES水平与H-Y分期相关,显示出强烈的正线性关系(n=113,rs=0.567,p<0.001,图5);然而,TNF-α水平与H-Y分期不相关。为了进一步探讨相互作用,我们检查了另外11名患者的术前和术后血样(表3)。与术后组相比,术前组的UPDRS Ⅲ评分、RANTES和TNF-α水平明显较高(P=0.001,P=0.033,P=0.027)。正如预期的那样,两组的RANTES水平和UPDRS Ⅲ评分之间有很强的明显相关性(n=11,rs1=0.644,p=0.033;rs2=0.620,p=0.042,图6)。TNF-α和RANTES水平也显示出相关性,虽然没有统计学意义,但表明有一致的炎症反应(n=11,rs1=0.545,p=0.083和rs2=0.636,p=0.035)。

讨论
限制性
这项研究显示,PD患者和匹配的对照组之间的血清RANTES和TNF-α水平存在明显差异。我们的研究结果表明,PD患者存在持续的系统性炎症状况,RANTES和TNF-α水平是PD的潜在血浆生物标志物。此外,RANTES和TNF-α水平的升高与PD的严重程度有关,在配对比较中,RANTES水平与UPDRS评分相关。这些结果支持DBS对PD的有效性,并表明其作用机制可能涉及改变系统性炎症反应。不幸的是,我们无法进一步探索细胞-分子机制。在未来的研究中应阐明PD患者血浆炎症因子的来源,并进一步研究DBS的机制,以促进延迟甚至治愈PD。
通讯作者简介
章文斌 主任医师
南京医科大学附属脑科医院功能神经外科
教授,主任医师,博士生导师
主要从事帕金森等运动障碍疾病的外科治疗,近年主持国家重点研发计划子课题及省级重点研发项目等课题5项,发表学术论文50余篇,建立华东地区最早的远程程控中心
《临床神经外科杂志》副主编、编辑部主任
中国医师协会神经调控专业委员会委员
中国医师协会神经外科分会神经电生理监测专业委员会委员
世界华人医师协会、世界华人神经外科协会功能神经外科专业委员会常委
中国神经调控联盟常务理事
湖南省癫痫与帕金森专病联盟特聘专家
国家神经外科手术机器人应用示范项目专家指导委员会委员,作为专家组成员参与制定多个神经调控专家共识
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。








