
撰稿 | 方咚
排版 | AiBrain 编辑团队
突发缺血性脑卒中后,大脑缺血部位会产生广泛的脑损伤以及神经元丢失;因此对于脑卒中的恢复,神经发生至关重要。近年来,由神经元-胶质细胞-脑血管组成的神经血管单元被发现能够维持神经元的正常生理功能以及修复受损的神经元,引起了广泛的关注。
其中星形胶质细胞在神经系统中起着复杂的作用,一方面星形胶质细胞可能形成“胶质疤痕”,抑制神经元的重新连接;但另一方面只有出现瘢痕性星形胶质细胞桥时,成熟神经元中会激活轴突生长遗传程序,并且祖细胞来源的星形胶质细胞可以支持轴突再生。
由于星形胶质细胞与Notch信号通路相关,因此有可能在损伤后转化为神经干细胞。并且在局灶性脑缺血或兴奋性损伤小鼠中可检测到星形胶质细胞向神经元的转化,但目前尚不清楚的是这种现象是如何诱导或调节的。
2022年12月19日,哈佛医学院Eng H. Lo团队在《Nature Communications》杂志上发表了题为“Endothelial cells regulate astrocyte to neural progenitor cell trans-differentiation in a mouse model of stroke” 的研究文章,通过光遗传学、细胞钙成像、微囊泡分离标记,立体定位注射等方法,利用小鼠脑卒中疾病模型,成功验证脑内皮细胞可以调节星形胶质细胞向神经祖细胞的分化转移。该研究能够为中风后的康复治疗提供新的策略。


作者利用细胞去建立脑缺血体外模型,筛选神经元、周细胞和脑内皮细胞作为分化转移信号的潜在来源,将这些细胞与星形胶质细胞共培养。发现只有氧糖剥夺后的脑内皮细胞诱导了星形胶质细胞显著的变化,使扁平多边形的星形胶质细胞变为具有双极突起的神经元形态的细胞(图1c)。这些星形胶质细胞在第3天时表达神经祖细胞标志物(SOX2、PAX6、DCX和PSA-NCAM)(图1d)。RT-PCR也证实在星形胶质细胞内神经祖细胞相关标志物表达增加(图1e,f)。
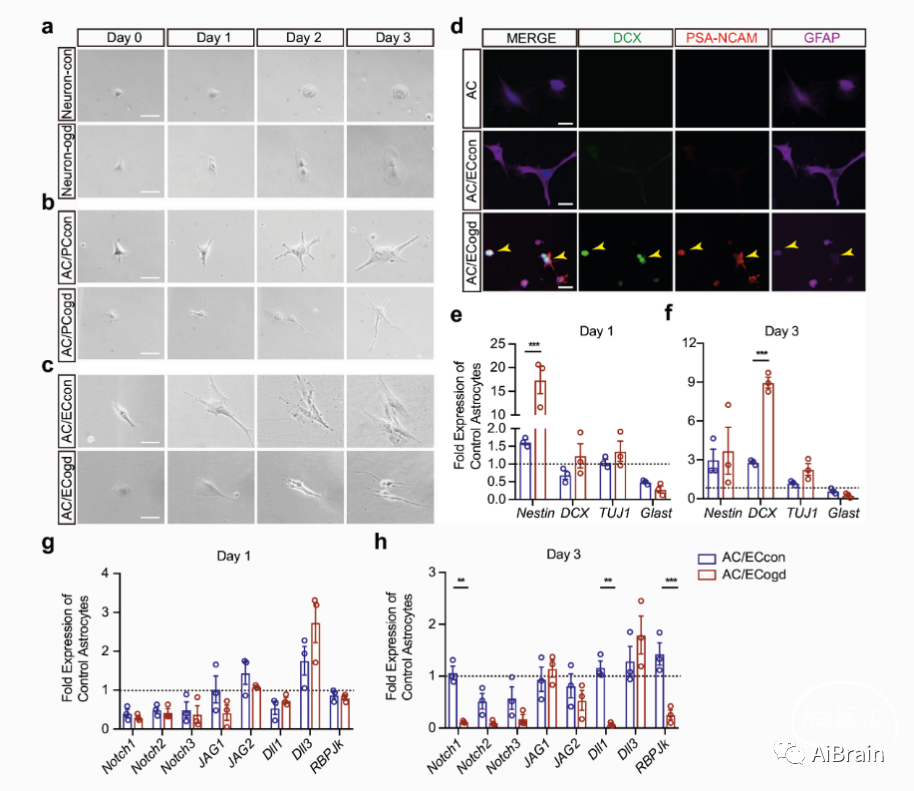
图1:OGD刺激的脑内皮细胞将星形胶质细胞转化为神经祖细胞

细胞外微囊泡是内皮-神经通讯的新介质,作者观察到脑内皮细胞释放的微囊泡增多(图2d)。利用荧光标记微囊泡后发现,随着时间的推移,微囊泡可以被星形胶质细胞吸收(图2e, f)。
为了评估功能相关性,作者将氧糖剥夺后的脑内皮细胞分离出微囊泡,并将其添加到星形胶质细胞培养体系中。第3-7天,星形胶质细胞出现胶质样-神经元形态学改变(图2g, h)。神经元特异性、钙动力学以及TTX阻断反应等都证实,来自氧糖剥夺刺激的脑内皮细胞的微囊泡,可以将星形胶质细胞重编程为神经祖细胞,这些祖细胞最终表现出具有钙活性神经元细胞的潜力(图2j, k, l)。
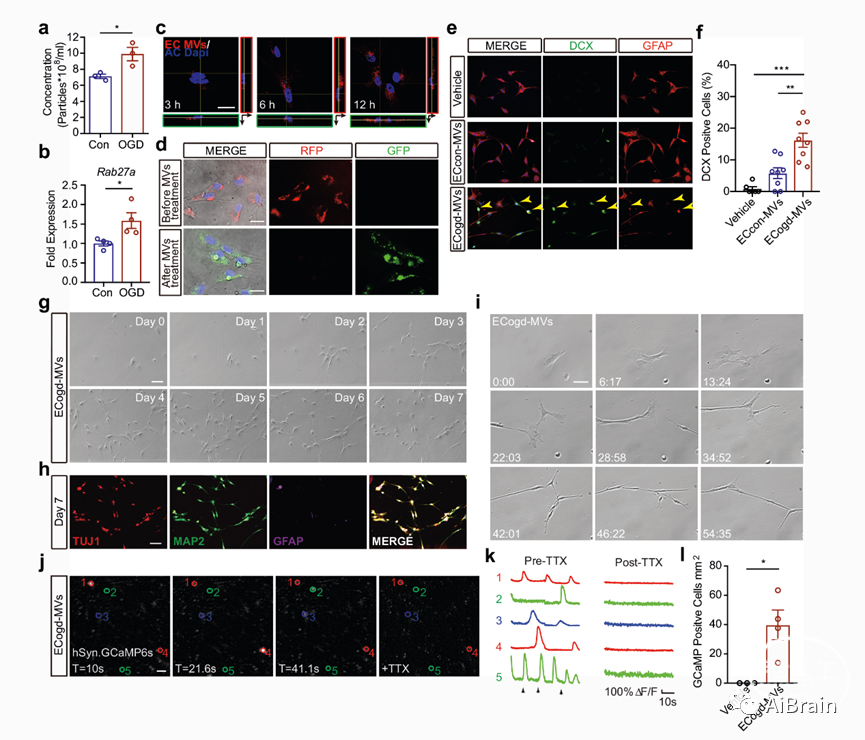
图2:来自OGD刺激的脑内皮细胞的微囊泡将星形胶质细胞重编程为神经祖细胞。

在细胞的转移分化中,往往是由特定的转录因子驱动的,ASCL1是一种基本的螺旋-环-螺旋转录因子,在神经内分泌细胞和神经组织的分化中起重要作用,是神经重编程的关键。作者发现星形胶质细胞与氧糖剥夺后的脑内皮细胞共培养后ASCL1蛋白增加,并且在氧糖剥夺后,脑内皮细胞衍生的微囊泡内ASCL1水平显著增加(图3a, b)。
更重要的是,含ASCL1的微囊泡显著改变星形胶质细胞的形态,星形胶质细胞在第3天神经祖细胞荧光标记(DCX,Nestin)增加,神经元荧光标记(TUJ1,MAP2)在第7天也随之增加(图3j, k)。
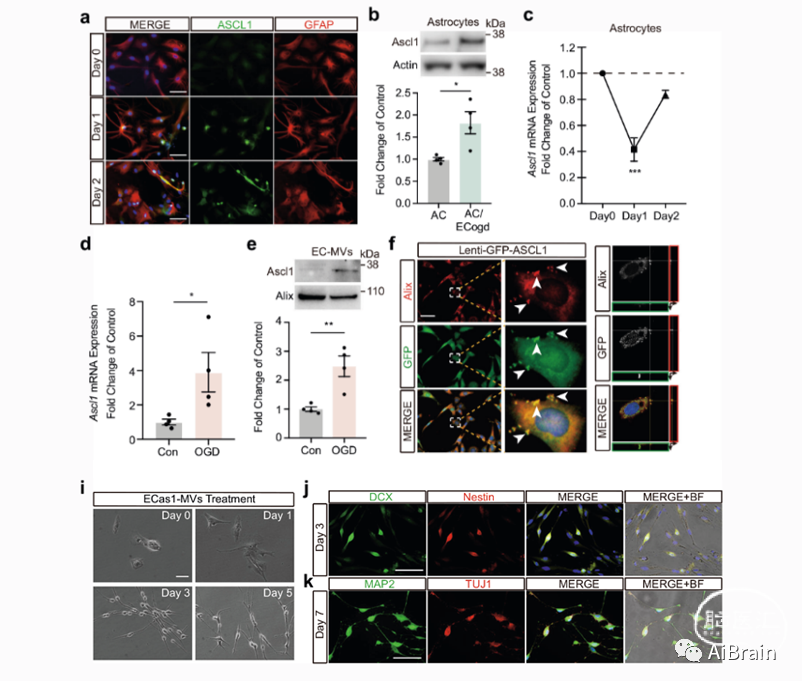
图3:脑内皮细胞衍生的含有ASCL1的微囊泡启动星形胶质细胞转移分化

为进一步评价局灶性脑缺血后脑细胞ASCL1的表达,采用荧光激活细胞分选法去观察缺血同侧皮质的内皮细胞、神经元、小胶质细胞/Mφ和周细胞,发现脑缺血后脑内皮细胞ASCL1 mRNA水平高于其他细胞。这也证实了小鼠局灶性脑缺血后微血管内皮细胞表达神经转录因子ASCL1(图4)。
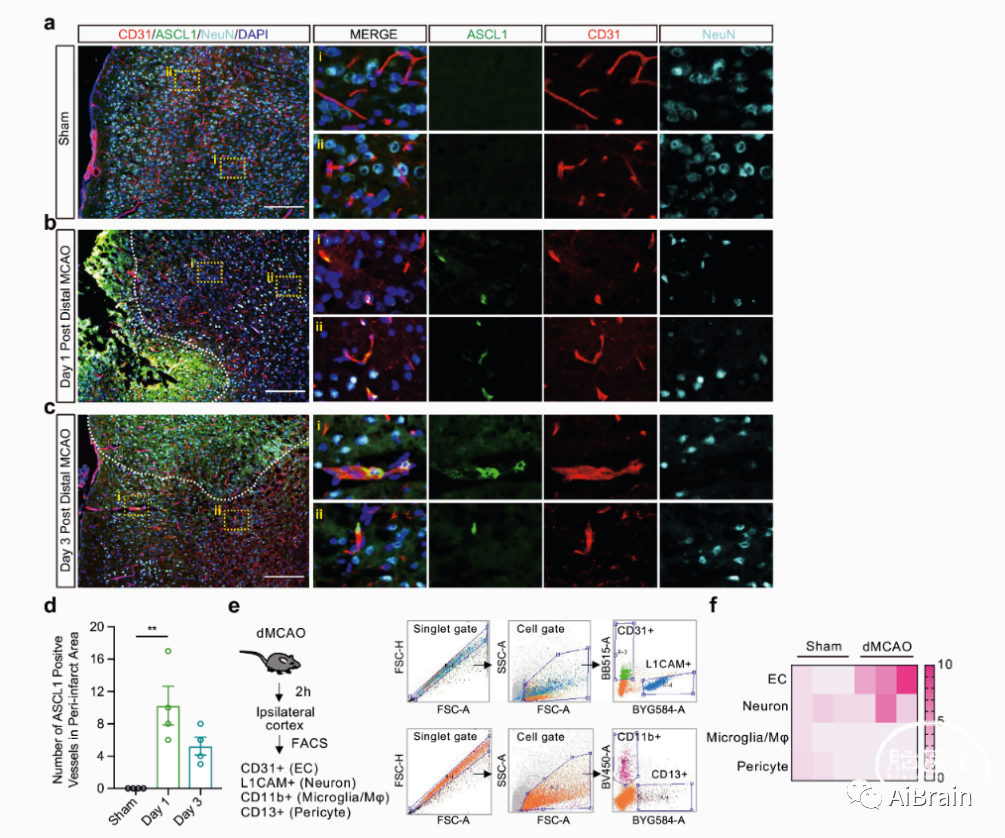
图4:ASCL1在小鼠局灶性脑缺血后脑微血管中表达。

作者进一步将微囊泡注入C57BL6小鼠侧脑室,3小时后在作为神经发生关键位置的SVZ周围,作者观察到标记的微囊泡与星形胶质细胞共定位。在缺血后第10天,通过荧光标记定位,作者发现来自OGD刺激的脑内皮细胞的微囊泡在体内可能将脑卒中后星形胶质细胞转化为神经祖细胞(图5e, h)。
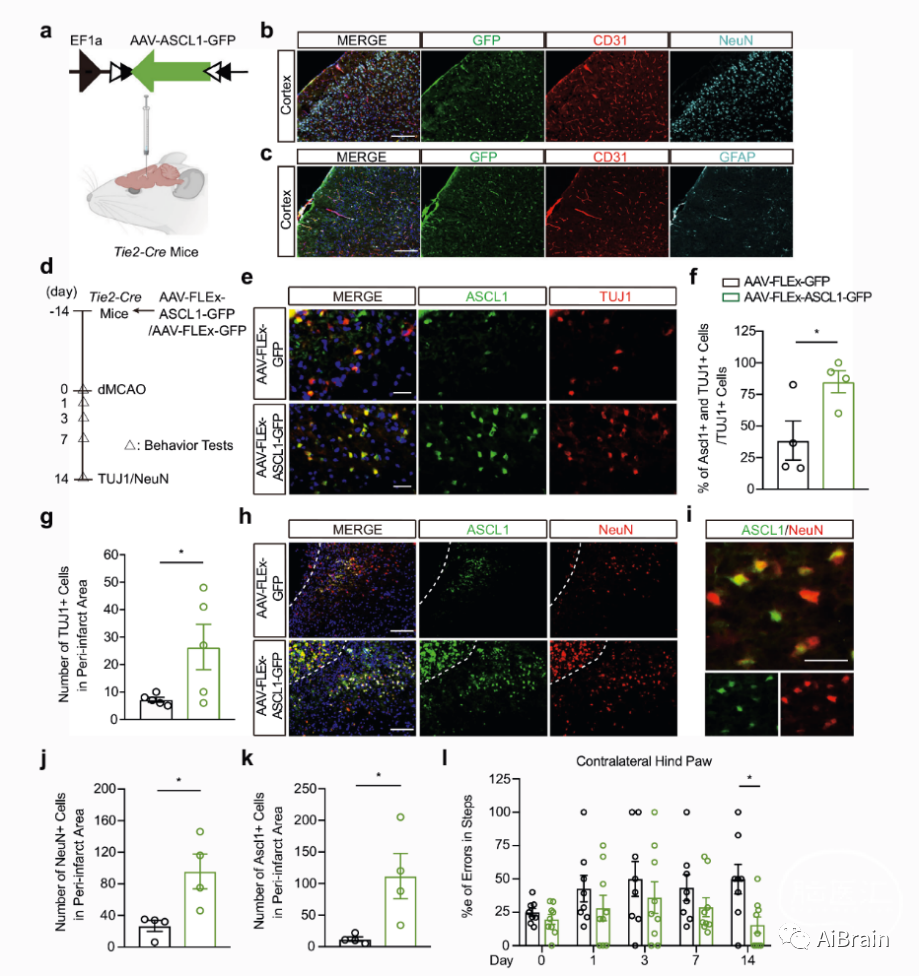
图5:小鼠脑缺血后OGD刺激的脑内皮细胞产生的微囊泡可将星形胶质细胞转化为神经祖细胞

如果脑内皮细胞可以转移ASCL1来诱导星形胶质细胞转移分化,那么是否可以增强这种现象来增加神经发生从而改变卒中后的预后?为了评估这一想法,作者将ASCL1在内皮细胞中特异性高表达,发现TUJ1和Neun阳性神经元明显增多,伴随着更多的ASCL1阳性细胞(图6f)。
然后作者对小鼠进行行为学检测,发现在内皮细胞中特异性高表达ASCL1的小鼠中,与正常小鼠相比网格爬行错误次数明显减少,胶带去除明显加快。所有这些数据提示,内皮细胞特异性ASCL1的过度表达可能有助于脑卒中后神经发生和改善部分神经功能。

图6:局灶性脑缺血后脑内皮细胞ASCL1的过度表达改善了神经功能。
综上,在这项工作中,作者发现了脑内皮细胞可以通过一种非细胞自主的分化转移机制诱导星形胶质细胞转化为神经祖细胞,脑内皮细胞可以释放微囊泡,将神经转录因子ASCL1转移到星形胶质细胞,从而将其转化为神经祖细胞。脑内皮微囊将星形胶质细胞重编程为神经祖细胞的这种能力,可能为脑卒中治疗中操纵胶质细胞反应提供血管途径。
AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或扫码添加AiBrain助手微信获取。


✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。