撰稿 | AiBrain 内容团队
排版 | AiBrain 编辑团队
一
研究概述
在临床中,胶质母细胞瘤(也称为多形性胶质母细胞瘤)约占脑肿瘤的15%左右。侵袭性癌症作为对于人体危害最大的癌症类型之一,一直是医学界的研究重点。
由于肿瘤侵袭性生长的特性,胶质母细胞瘤一般很难治愈:肿瘤会扩散到全脑,因此无法通过手术完全切除。
近期的一项小鼠试验发现了驱动胶质母细胞瘤侵袭性的有关因素。该研究表明,一类胶质母细胞瘤细胞亚群的行为方式与未成熟的神经元十分相似,它们会在大脑自身神经元的刺激下在大脑中不断扩散。相关研究成果于2022年7月31日在Cell上发表。

https://www.cell.com/cell/fulltext/S0092-8674(22)00847-9
胶质母细胞瘤是一种弥散性侵袭的难治性肿瘤。胶质母细胞瘤的一个细胞亚群通过肿瘤微管(肿瘤微管)相互连接,构成了一个具有治疗抵抗性的肿瘤细胞网络。其他的细胞亚群似乎并没有互相连接,而且目前对于它们的生物学作用也知之甚少。
在这篇文章中,作者证明了促进肿瘤细胞在全脑定植的,是那些与其他肿瘤细胞和星形胶质细胞缺少连接,但会通过突触接收来自神经元信号的胶质母细胞瘤细胞。
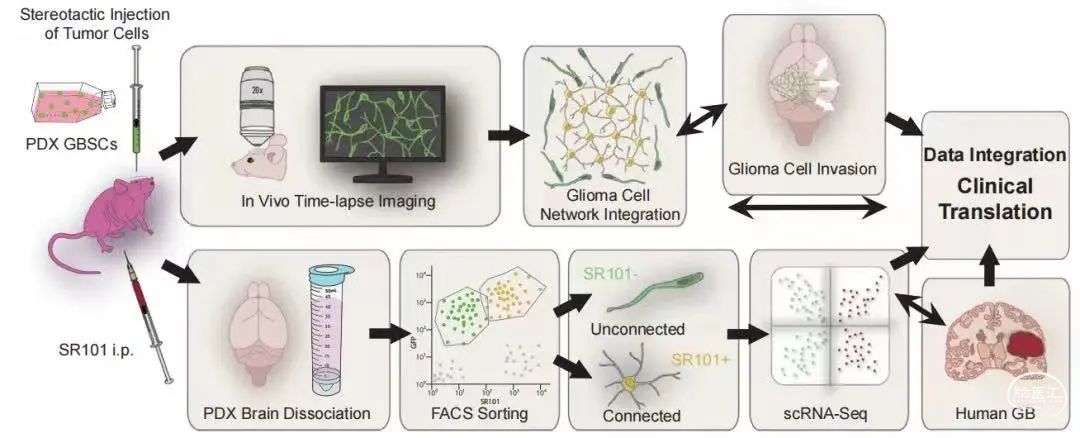
在小鼠模型和人类疾病中,这一细胞亚群对应由单细胞转录组学定义的神经元和神经祖细胞样的肿瘤细胞状态。肿瘤细胞的侵袭与神经元的迁移机制相似,并且会通过一种类似于捕食者在食物稀缺时寻找食物的运动模式(Levy模式)探索大脑的环境。神经元活动会在胶质母细胞瘤细胞中诱发复杂的钙信号,随后形成新的肿瘤微管,并加快肿瘤侵袭的速度。
总之,分子和功能单细胞数据的结果表明,神经元机制在多个层面上控制着胶质母细胞瘤细胞的侵袭,并反映出胶质母细胞瘤扩散与细胞异质性之间密切联系的方式。
二
作者自述
在这项试验中,我们将人类患者的胶质母细胞瘤移植到小鼠的大脑中。同时,基于对SR101染料的摄取程度,研究人员将互相连接的胶质母细胞瘤细胞和无连接的胶质母细胞瘤细胞相互分离,从而区分肿瘤中不同的细胞群。
借助人工智能算法,研究人员对小鼠大脑中单细胞的生长进行了长期观察。通过单细胞RNA测序,研究人员发现,这些未连接的细胞在生长过程中具有与未成熟神经元相似的分子特征。肿瘤细胞入侵大脑的方式也与未成熟的神经元存在相似之处,包括通过分支迁移、运动和移位的能力。简言之,正如本文第一作者,来自德国海德堡大学的Venkataramani所说:“胶质母细胞瘤细胞的行为与成人大脑中比较少见的未成熟神经元十分相似”。
研究人员还发现了胶质母细胞瘤细胞逐渐入侵大脑之后,无连接和互相连接的胶质母细胞瘤细胞之间的动态关系。
未连接的细胞是位于肿瘤边缘的“先锋细胞”,负责探索大脑的环境。一旦未连接的细胞在大脑中找到了合适的落脚点,这些细胞就会转化为连接细胞,与其他连接的胶质母细胞瘤细胞构成一个紧密的网络。
虽然连接的细胞比未连接的“先锋细胞”具有更高的治疗抵抗性,但这些连接细胞无法探索新的脑区。Venkataramani解释到:“现在作者对各类肿瘤细胞类型的生物学功能有了更深入的认识”。
三
同行评述
Reviewer #1:
法国波尔多大学生物医学研究员Andreas Bikfalvi认为:“这项研究的内容非常有趣,作者首次发现神经元的输入会加快胶质母细胞瘤的侵袭速度。”
虽然Bikfalvi认为这篇论文“论证充分,而且非常有趣”,但他也警告“基质硬度、血管、内皮细胞等多种周围因素也会影响癌症的发展。作者仍不了解在综合考虑所有因素后导致胶质母细胞瘤侵袭的主要原因是什么”。
Reviewer #2:
德国雷根斯堡大学医院神经肿瘤科医生Peter Hau在给《科学家》杂志写的一封邮件中表示,“这项研究很快会促进几种转化方法的发展。毫无疑问,它能帮助作者找到抑制这些恶性肿瘤的方法”。研究作者还发现了一种可以抑制小鼠肿瘤微管形成和微管分支的受体抑制剂,该抑制剂可以抑制那些通过突触接收来自胶质母细胞瘤和神经细胞信号的受体,这是作者向临床应用迈出的第一步。
✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。