
撰稿 | 随艺
排版 | AiBrain 编辑团队

关于杨辉和辉大基因
杨辉
杨辉博士,2007年毕业于上海交通大学生物技术学院,获理学学士学位。2007年至2012年就读于中科院上海生命科学研究院生物化学与细胞生物研究所,获博士学位。2012至2014年在美国麻省理工Whitehead研究所从事博士后研究工作。2014年回国担任中国科学院神经科学研究所灵长类疾病模型研究组组长(http://www.cebsit.cas.cn/yjz/yh_/yjfx/)。2015年获得国家优秀青年科学基金资助,2019年获得国家杰出青年科学基金资助。课题组主要研究方向包括基因编辑工具开发及安全性评价、利用基因编辑技术构建动物模型和推动基因编辑应用于成体疾病治疗,先后在nature、science、cell、nature neuroscience等知名国际期刊发表论文近50篇。
围绕 RNA 和DNA 编辑工具,杨辉博士已于 2018 年创立了辉大(上海)生物科技有限公司(简称辉大基因),专注于罕见单基因遗传病以及威胁人类健康常见疾病基因治疗药物的研发和生产。辉大基因总部位于上海,目前已建成研发实验室、药物工艺开发与分析实验室、模型动物试验中心等。公司全部成员近 200 人,其中,研发团队占 70% 以上。自成立以来,辉大基因目前已完成四轮融资,并与多家国内科研机构、医院达成深度合作。
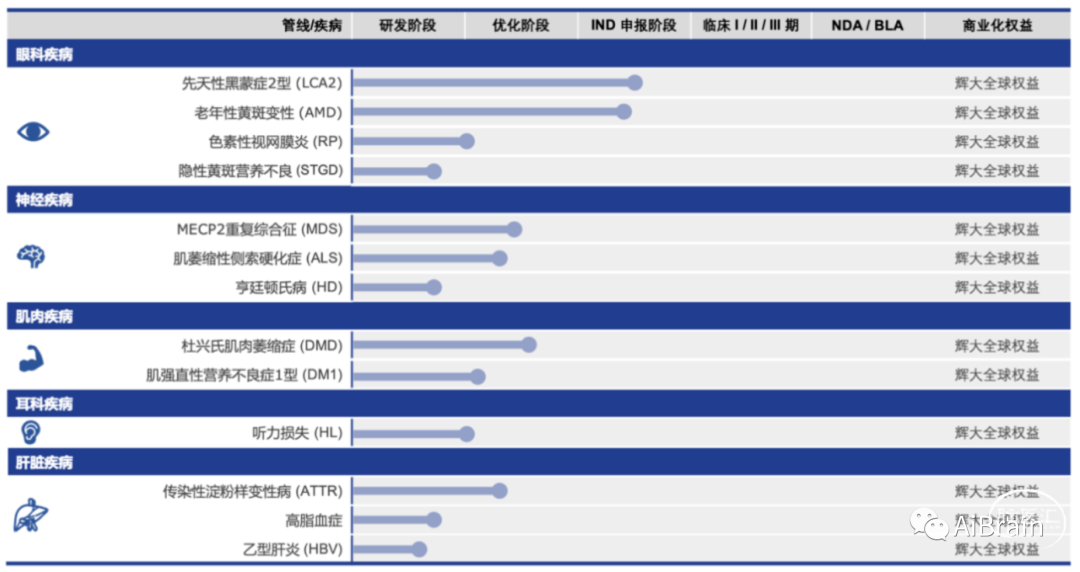
现阶段,辉大基因研发管线涵盖中枢神经、眼科、听力、肌肉、肝脏等多个疾病领域,拥有多项专利技术平台,具备从药物靶点筛选、药物优化、高效动物模型构建,到药效、毒理分析等临床前研发,再到药物工艺开发、生产转化 CMC 以及药品临床及注册申报的一体化研发能力。
不得不说,杨辉博士从课题组到公司,从工具开发到临床转化的整体布局,让科研人更容易看到基础科研的价值,也真正实现了从基础到临床的一步步转化,在帮助患者的路上稳扎稳打得前行。
大多数单基因疾病是由点突变引起的,其中约50%可以通过腺嘌呤碱基编辑(ABE)的A-G转换逆转。尽管来源于Cas9的碱基编辑已被证明可以纠正一些单基因突变,但这些蛋白质通常太大,无法通过单个AAV载体进行有效的体内递送。鉴于RNA编辑活动的规模相对较小且具有可逆性,灵活的RNA碱基编辑工具最近成为密集开发工作的重点。
在单基因退行性肌肉疾病中,杜氏肌营养不良症(DMD)是第二常见的遗传性肌肉疾病,约3500至5000名男性新生儿中就有1人受到影响。DMD仍然缺乏任何有效的治疗方法,并且往往是致命的。先前的一项研究表明,RNA碱基编辑确实可以恢复无义突变诱导的X连锁肌营养不良症(mdx)小鼠的肌营养不良蛋白表达。然而,在这项研究中,他们只获得了有限的肌营养不良蛋白表达,而且,没有观察到治疗小鼠受损肌肉功能的减轻。
2022年12月13日,辉大基因的杨辉团队和福建医科大学的陈万金课题组合作在Journal of Clinical Investigation上发表了题为“Mini-dCas13X-mediated RNA editing restores dystrophin expression in a humanized mouse model of Duchenne muscular dystrophy”的研究文章,该结果表明,辉大基因拥有自主专利的Mini-dCas13x(13e)介导的RNA碱基编辑系统(Mini-dCas13x RNA base editing, mxABE)可以高效恢复杜氏肌营养不良症人源化DMD小鼠模型中肌萎缩蛋白(Dystrophin)的表达。


作者首先确定了患者DMD基因30号外显子中的无义突变,c.4174C>T,p.Gln1392*(图1A)。接着,作者通过患者左二头肌活检组织的组织学免疫染色检查了肌营养不良蛋白的表达。这表明肌营养不良蛋白表达完全丧失(图1B),支持c.4174C>T在患者观察到的病理症状中的致病作用。
为了进一步确认c.4174C>T与DMD病理之间的因果关系,作者设计了一种基因人性化策略,通过用c.4174C>T突变患者的相应人类外显子替换小鼠DMD30号外显子,生成DMDE30mut效应的个性化小鼠模型(图1C)。作者利用CRISPR辅助的敲入方法产生了数只具有正确人源化基因型的小鼠。为了确保人类外显子与小鼠侧翼外显子正确剪接,作者对其进行了RT-PCR,结果证实人源化DMDE30mut小鼠的预期剪接是无缝的(图1D)。
接着,作者通过对人源化突变小鼠的肌肉进行天狼星红、HE染色(图1E)、免疫荧光染色(图1F)、WB分析(图1G)、握力测试(图1H)和CK值测定(图1I),确定该人源化DMDE30mut小鼠表现出与DMD患者中观察到的表型高度相似的分子和功能表型,有力支持了患者DMD症状中c.4174C>T突变的致病作用。这些发现表明,DMDE30mut小鼠准确地概括了在人类患者中观察到的DMD症状,并将其验证为后续评估潜在干预策略的合适模型。
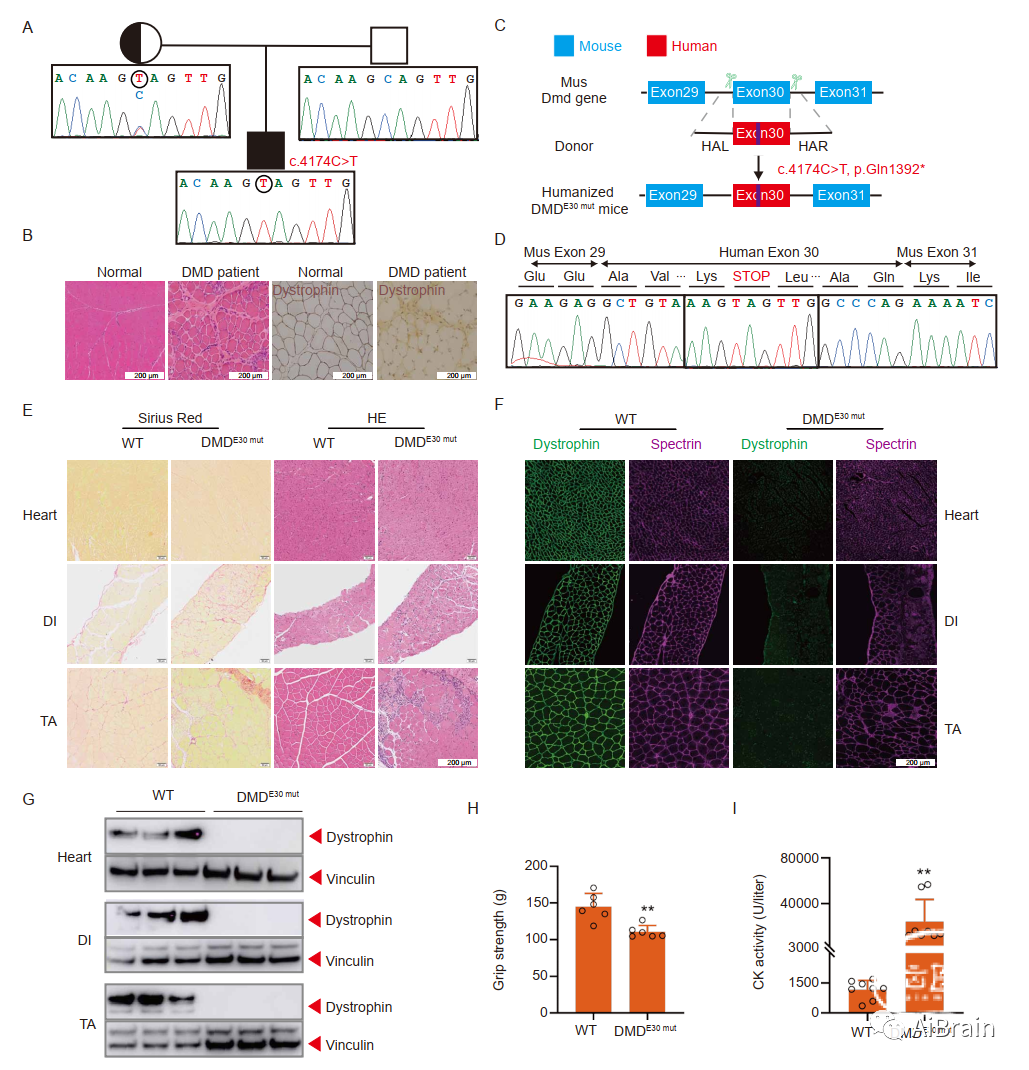
图1:人源化DMD小鼠模型的建立和鉴定。

接下来,作者设计了用于gRNA筛选的双荧光报告子。具体而言,整合了来自mCherry和GFP报告子之间含有c.4174C>T突变的患者的基因组序列,并在HEK293T细胞中表达了带有mxABE的双报告子(图2A)。作者设计了总共24个gRNA,全部长度为30nt或50nt,所有这些都产生了可检测到的GFP荧光。其中,50 nt g6 gRNA表现出最高的GFP挽救效率,平均恢复了95.70%的信号强度(图2B)。GFP挽救后对报告mRNA的深度测序证实,g6提供了最有效的编辑,A-G编辑率为77.88%(图2C)。
为了鉴定用于有效RNA碱基编辑的最佳AAV兼容表达构建体,作者组装了10个mxABE表达组件,并在HEK293T细胞中的GFP挽救实验中测试它们。所有10个mxABE表达组件提供至少79.5%的GFP挽救和79.08%的平均A-G转换效率(图2D,E)。由不同mxABE编辑的突变DMD转录物的靶向测序显示,相邻A位点的A-G编辑效率低且可变(图2F)。这些结果表明,基于mxABE的RNA编辑可用于纠正在DMD中引入提前终止密码子(PTCs)的不同突变。
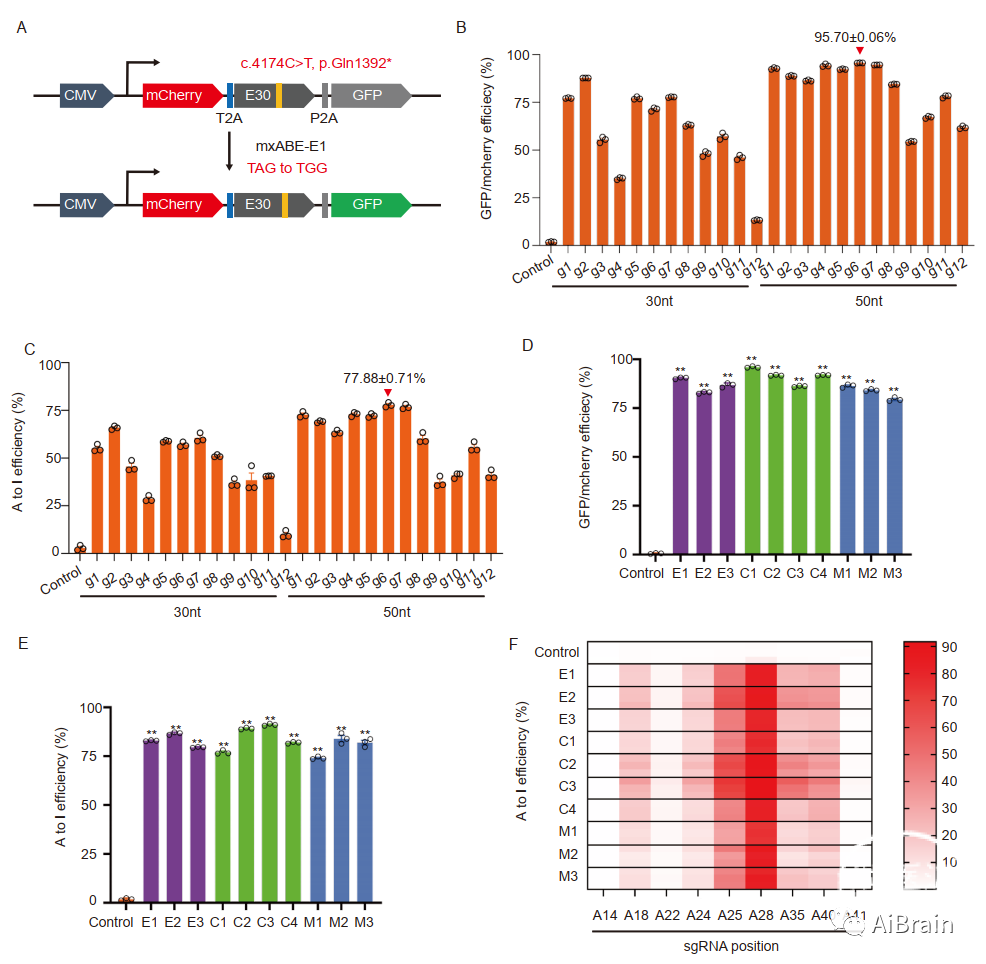
图2:mxABE介导的突变型DMD RNA的纠正。

接着作者对8周龄雄性DMDE30mut小鼠的右胫骨前肌(TA)注射针对c.4174C>T的AAV9 mxABE病毒颗粒,而同一小鼠的左TA注射盐水作为对照(图3A)。所有小鼠均保持在相同条件下,队列分成两半,3周或6周后处死,进行肌肉组织的分子和组织学分析,包括编辑效率、western分析和肌营养不良蛋白表达的组织学染色(图3A)。
作者首先评估了3周后mxABE治疗的短期效果。通过TA组织中提取的DNA的深度测序(图3B)、WB(图3C,D)以及组织学检查(图3E、F),结果显示所有mxABE构建体都有效地挽救了肌营养不良蛋白的表达。
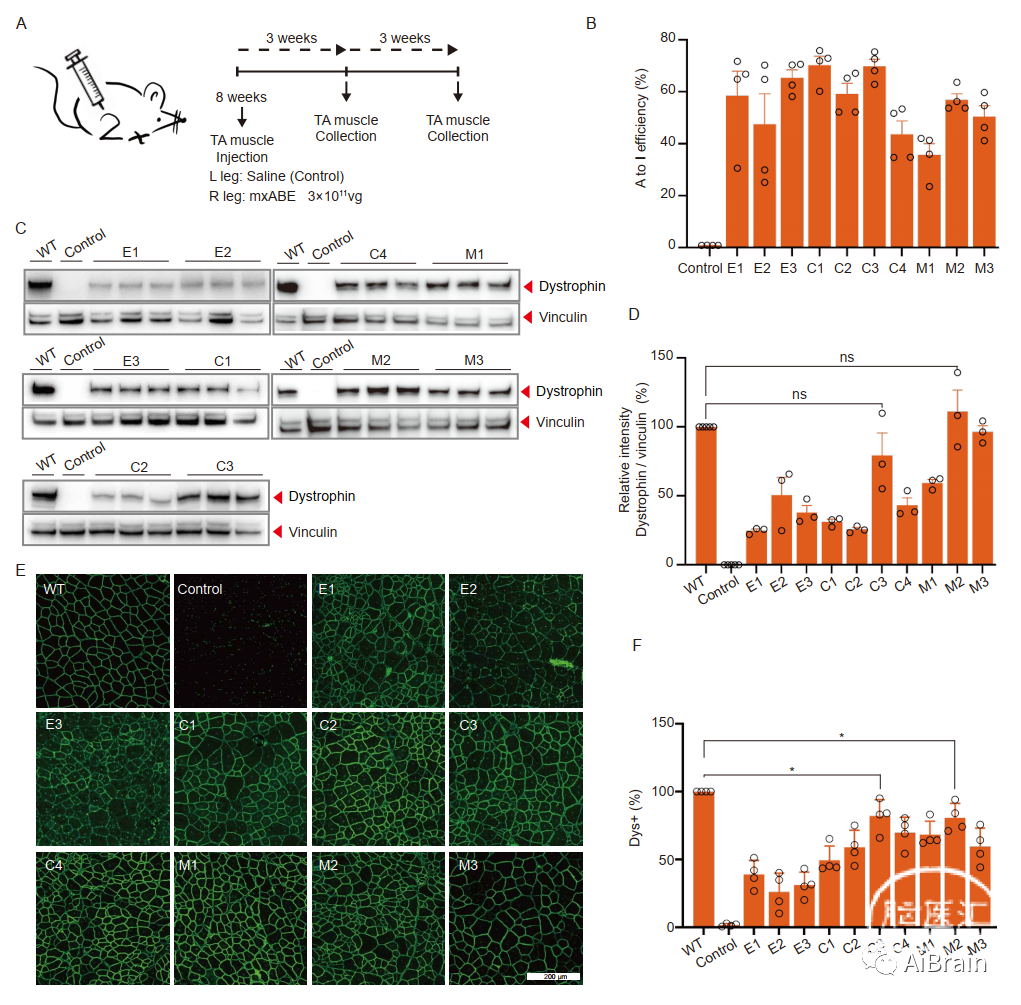
图3:在AAV注射后3周,mxABE稳健地挽救了TA中肌营养不良蛋白的表达。
为了评估EFS、CBh和MHCK7 mxABE对DMDE30mut小鼠的长期影响,在治疗后6周对TA组织进行RNA编辑率、蛋白质表达和组织学分析。与3周值相比,治疗后6周的编辑率约低40%(图4A)。有趣的是,肌营养不良蛋白染色显示,与mxABE治疗后的3周相比,6周时Dys+面积相似(图4B、C),表明持续的治疗效果。
此外,来自注射mxABE的DMDE30mut和WT小鼠的TA裂解物的western印迹带的定量表明,表达MHCK7 mxABE表达的M2载体诱导了最高水平的肌营养不良蛋白表达,约为WT水平的50%(图4D,E)。这些结果表明,尽管肌肉纤维的快速生长和RNA编辑的可逆性。
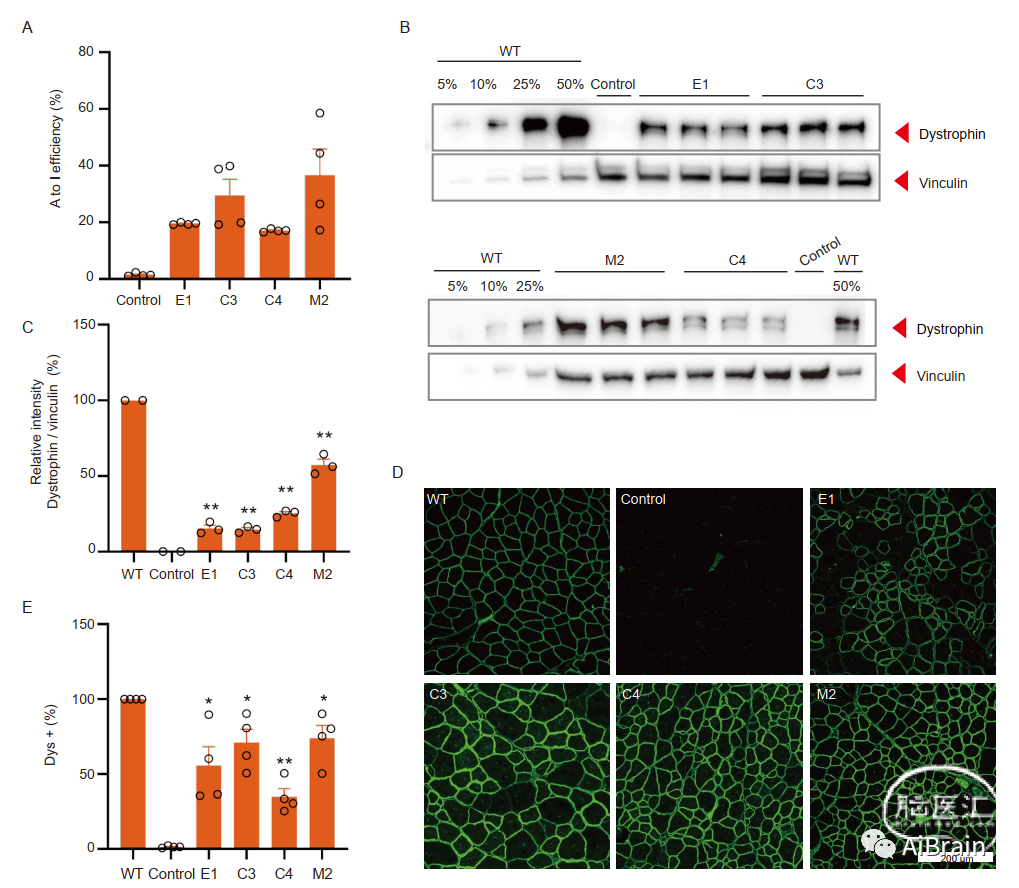
图4:注射后6周AAV-mxABE稳健地挽救TA中肌营养不良蛋白的表达。

在证明了局部注射mxABE可显著恢复TA肌肉中的肌营养不良蛋白表达后,接下来作者研究了DMDE30mut小鼠全身注射AAV mxABE的效果。对于全身注射,作者在出生后3天(P3)将所有10个mxABE构建体的病毒载体或对照盐水腹腔注射到新生DMDE30mut小鼠体内(图5A),并收集了TA、DI和心脏组织,以便在不同时间点进行分析(图5A)。注射后三周,深度测序分析表明,C3 mxABE和M2 mxABE在心脏组织中是非常有效的RNA碱基编辑,但在DI和TA中其RNA碱基编辑效率较低(图5B)。
为了研究观察到的心脏、DI和TA组织校正效率差异的可能原因,作者进行了qPCR、WB分析(图5C)、免疫组织化学分析(图5D、E)、HE、天狼星红染色、CK值水平测定(图5F)和握力测试(图5G),结果表明mxABE治疗的DMDE30mut小鼠的肌肉功能障碍仅部分缓解;因此,需要进一步优化mxABE表达或递送以增强治疗效果。
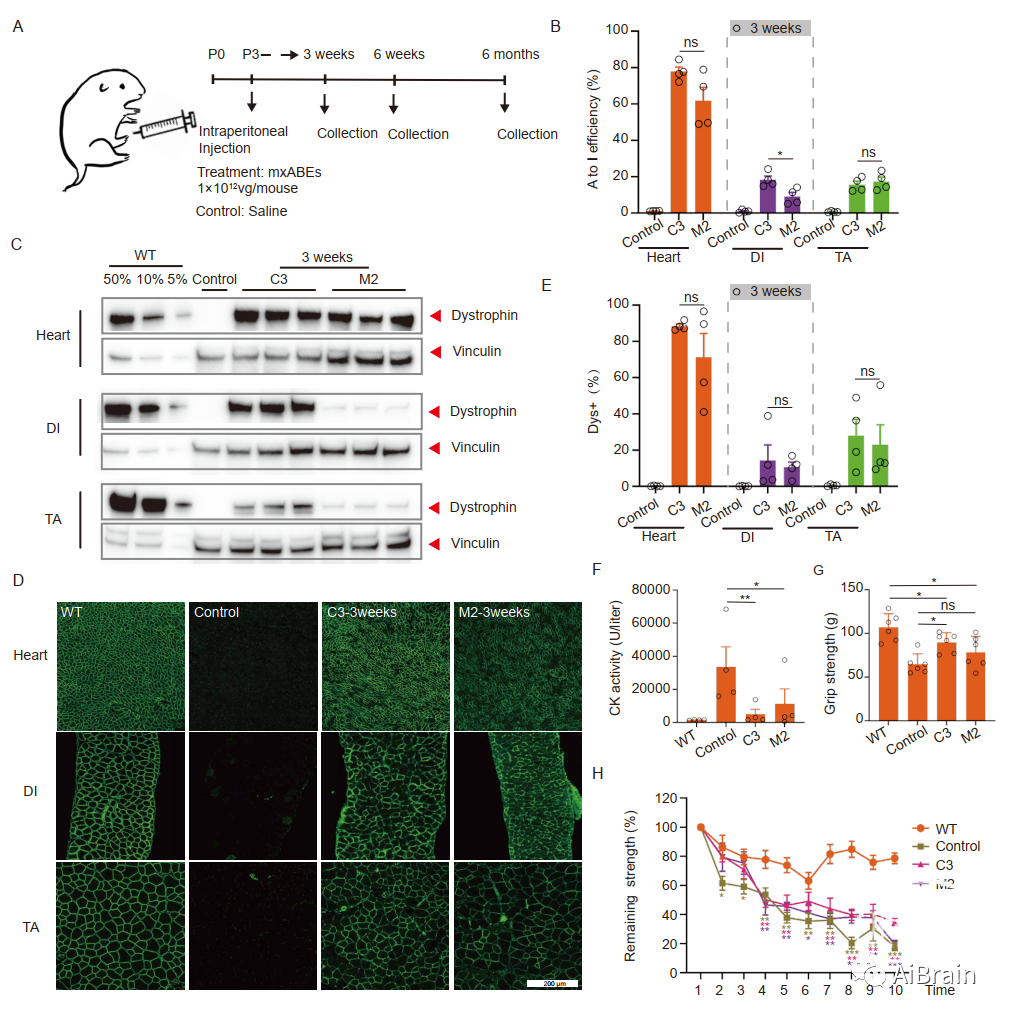
图5:全身递送AAV-mxABE 3周后可挽救多个器官的肌营养不良蛋白表达和肌肉功能。
在6周时,作者还检查了mxABE处理和未处理DMDE30mut小鼠的A-to-I碱基编辑效率(图6A)、肌营养不良蛋白恢复水平(图6B,C)和握力(图6D,E)。结果表明,在通过AAV全身给予mxABE后长达6个月,mxABE可有效恢复DMDE30mut小鼠的肌营养不良蛋白表达。
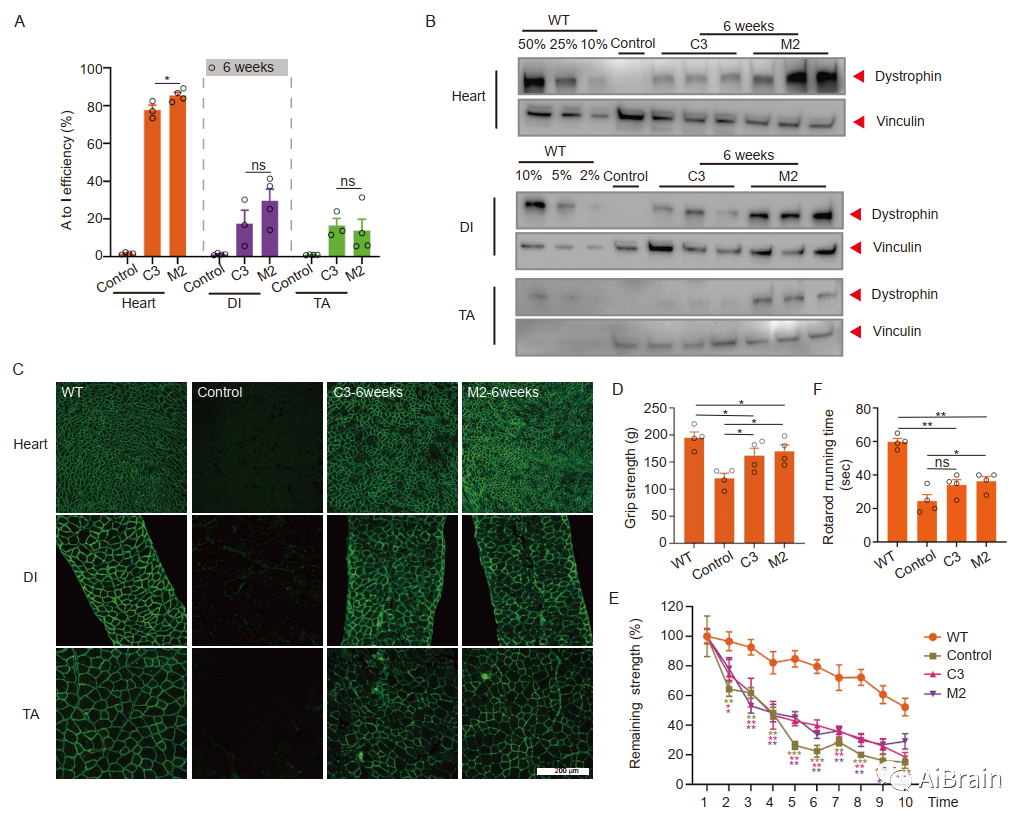
图6:全身mxABE治疗6周后恢复肌营养不良蛋白表达和肌肉功能
综上所述,本研究验证了在诊所收治的DMD患者中发现的致病性无义突变,并建立了DMD的人源化小鼠模型,以研究RNA碱基编辑挽救DMD相关表型的效率。使用包装在AAV中的mxABE碱基编辑器,证明了通过局部或全身给药可以在多个肌肉组织中恢复肌营养不良蛋白的表达,这表明该系统治疗PTCs引起的单基因疾病的潜力。
参考文献(上下滑动查看):
AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或扫码添加AiBrain助手微信获取。


✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。