
排版 | AiBrain 编辑团队

重度抑郁症(MDD)是一种毁灭性的精神障碍,影响全球高达17%的人口,高终生患病率(~17%)以及残疾和自杀的主要原因使重度抑郁症(MDD)成为一种毁灭性的精神疾病,识别抑郁症病理生理机制的努力涉及特定脑回路和网络中的神经元通信。
静息态功能磁共振成像(rsfMRI)是一种强大的无创工具,通过量化静息态功能连接(rsFC)、次慢(~0.1Hz)自发血氧水平依赖性MRI信号波动的相关性,在空间隔离但功能相关的区域之间,在全脑尺度上研究神经元通信。越来越多的证据表明,抑郁症患者在参与情绪处理的关键功能中枢表现出异常的rsFC,例如腹内侧前额叶皮层(vmPFC)、背外侧PFC(dlPFC)、前扣带(ACC)、杏仁核(AMY)、丘脑(TH)、纹状体(Str)和海马体(HP)。尽管rsfMRI在诊断抑郁症和指导抑郁症治疗方面具有巨大潜力,但抑郁症中rsfMRI连接异常的机制仍然知之甚少。
同时我们知道,星形胶质细胞是哺乳动物大脑中最丰富的神经胶质细胞类型,与抑郁症密切相关。来自抑郁症患者尸检分析和动物研究的证据表明,情绪相关大脑区域的星形胶质细胞密度、标志物和胶质递质的变化,因此,星形胶质细胞是潜在的支撑rsfMRI连接机制的关键候选者。然而,星形胶质细胞在rsfMRI连接中的作用对于正常和抑郁的大脑仍然没有得到充分研究。
2022年11月18日,南方医科大学生物医学工程学院的冯衍秋课题组在Science Advances上发表了题为“Astrocyte dysfunction drives abnormal resting-state functional connectivity in depression”的研究文章,该研究通过探索星形胶质细胞特异性功能丢失和获得对全脑rsFC的影响,以及异常rsFC与Itpr2−/−小鼠抑郁样行为之间的关联,阐明星形胶质细胞功能障碍在驱动抑郁症患者的异常rsfMRI连接中的作用。


为了研究星形胶质细胞功能障碍是否导致抑郁症患者的rsfMRI连接异常,作者首先通过比较Itpr2−/−和野生型(WT)小鼠的全脑rsFC,研究了星形胶质细胞Ca2+活性降低如何影响rsFC。全脑两两相关矩阵的组间比较显示,与WT小鼠相比,Itpr2−/−小鼠的全脑rsFC有显著变化(图1A和B)。
为了量化Itpr2−/−小鼠中受影响最严重脑区的rsFC变化,作者计算了抑郁相关网络中的效应量(Itpr2−/−小鼠vs.WT小鼠)(图1D)。效应量分析显示,与野生型小鼠相比,Itpr2−/−小鼠中mPFC-Str、mPFC-AMY、mPFC-SsCx等通路中的rsFC显著降低(图1,D和E)。而IP3R2敲除增加了DRN-Ant、mPFC-DRN、DRN-TH、Hb-SC和SsCx-VCx通路中的rsFC(图1,D和E)。
这些结果表明,星形胶质细胞功能障碍可导致预测抑郁样行为的全脑rsfMRI连接异常,尤其是在抑郁相关网络中。
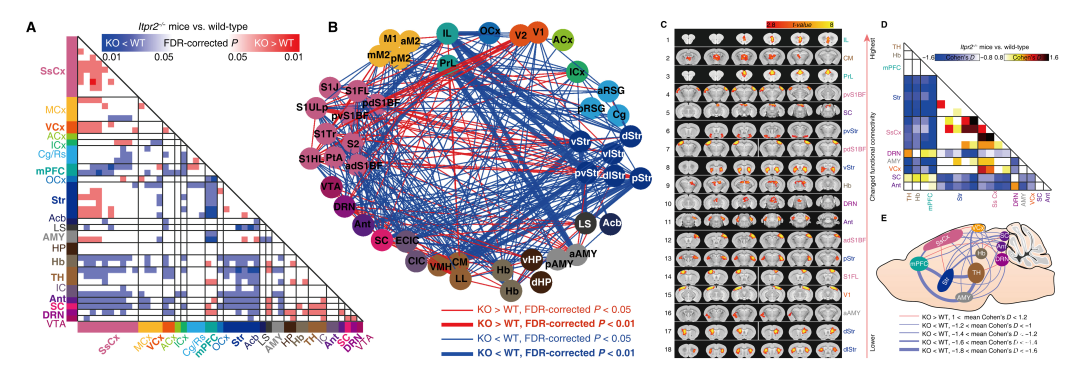
图1:通过rsfMRI研究Itpr2−/−和WT小鼠的全脑功能连接

为了进一步确定星形胶质细胞在抑郁症rsFC中的作用,作者直接检测了光遗传刺激mPFC星形胶质细胞对抑郁症相关网络的影响。
作者将在胶质纤维酸性蛋白(GFAP)启动子(gfaABC1D)下表达ChR2的腺相关病毒(AAV)注射到WT或Itpr2−/−小鼠的mPFC中,从而选择性地刺激星形胶质细胞(图1A和B)。
结果表明,光遗传学激活mPFC星形胶质细胞可以减轻Itpr2敲除引起的rsFC改变。
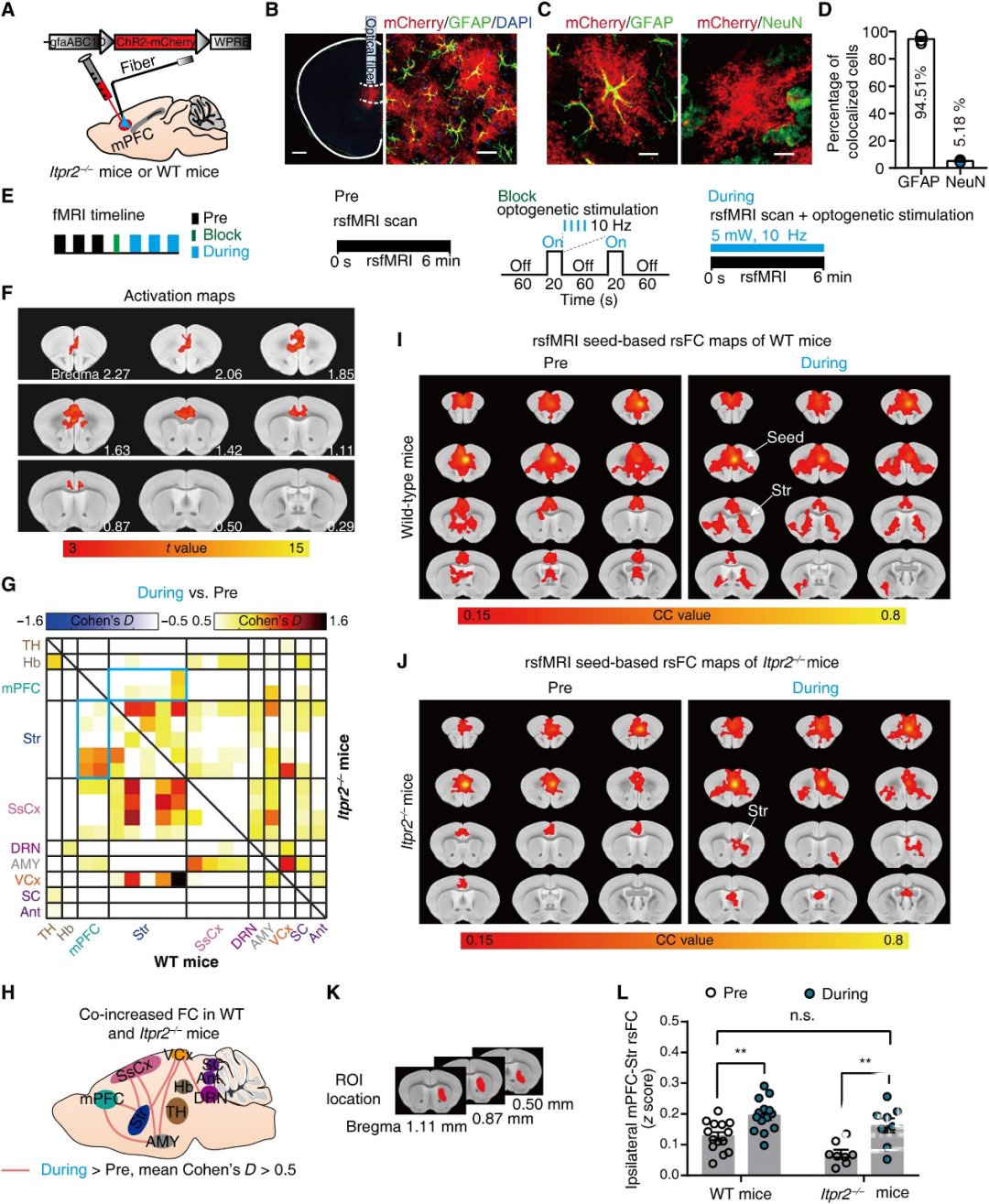
图2:mPFC星形胶质细胞的光遗传学刺激增加了抑郁症相关网络中的rsFC。

为了了解星形胶质细胞如何调节rsFC以及是否通过调节神经元通讯,作者使用锰增强MRI(MEMRI)来确定星形胶质细胞功能障碍是否影响神经元通讯。
作者首先将MnCl2注入Itpr2−/−和WT小鼠的mPFC中,并在注射后的第一个24.5小时追踪Mn2+的积累(图3,A和B)。
结果表明,星形胶质细胞功能障碍降低了神经元交流,并且mPFC-Str通路是在Itpr2−/−小鼠和抑郁症患者中显示rsFC改变的mpfc相关通路中唯一受到显著影响的神经环路。
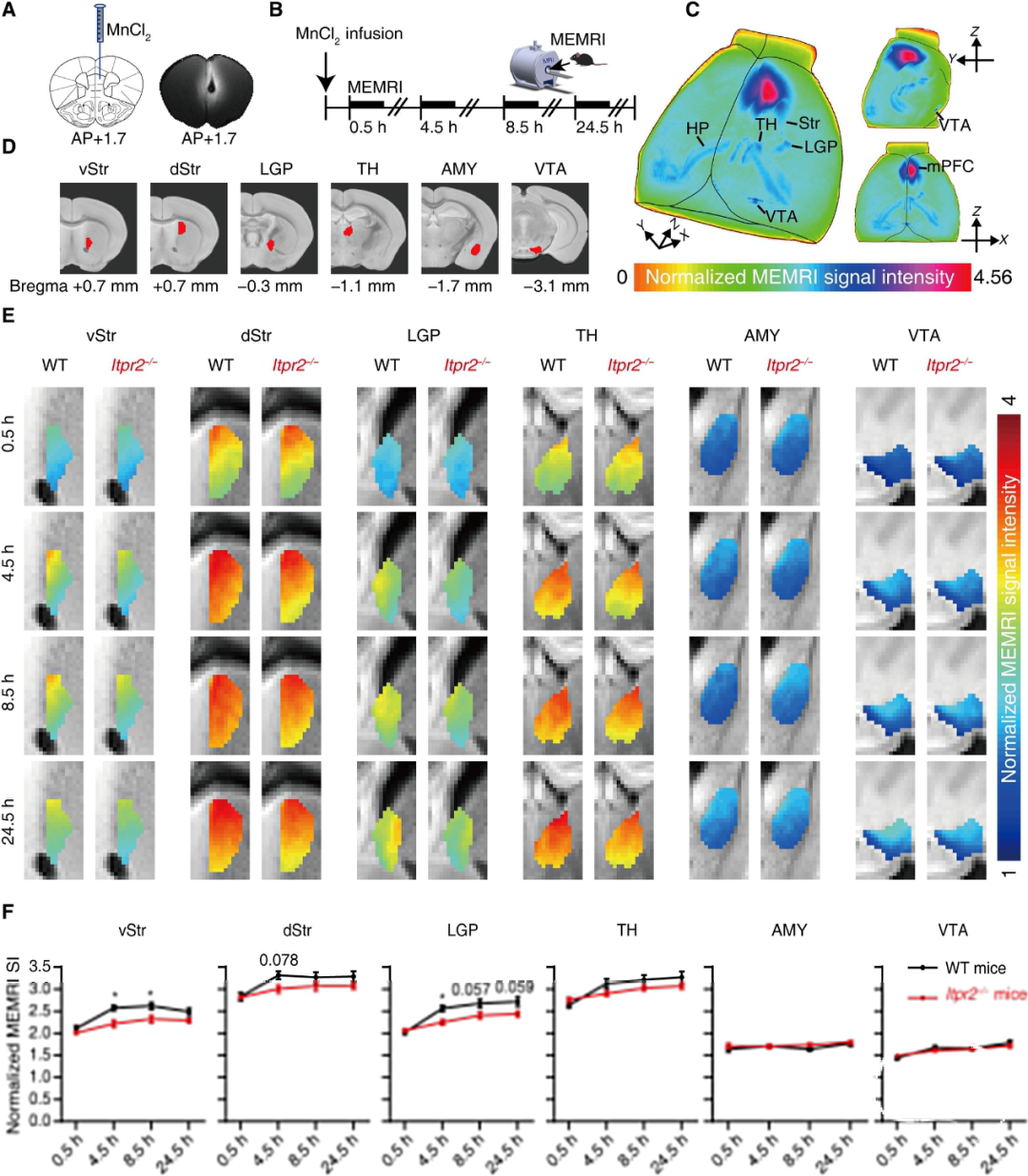
图3:Itpr2的缺失会损害mPFC到Str神经元通讯。

利用光遗传刺激直接调节mpfc相关通路的神经元通讯,作者试图进一步确定星形胶质细胞功能障碍引起的异常rsFC与Itpr2−/−小鼠抑郁样行为之间的关系。
作者在Itpr2−/−小鼠的mPFC内注射了AAV-CamkII-hChR2-mCherry或AAV-CamkII-mCherry,并在受感染细胞上方插入了光纤(图4,A和B)。
结果表明,光遗传学激活mPFC神经元部分挽救了rsFC,尤其是mPFC-str和mPFC-amyrsFC,并挽救了Itpr2−/−小鼠的抑郁样行为。
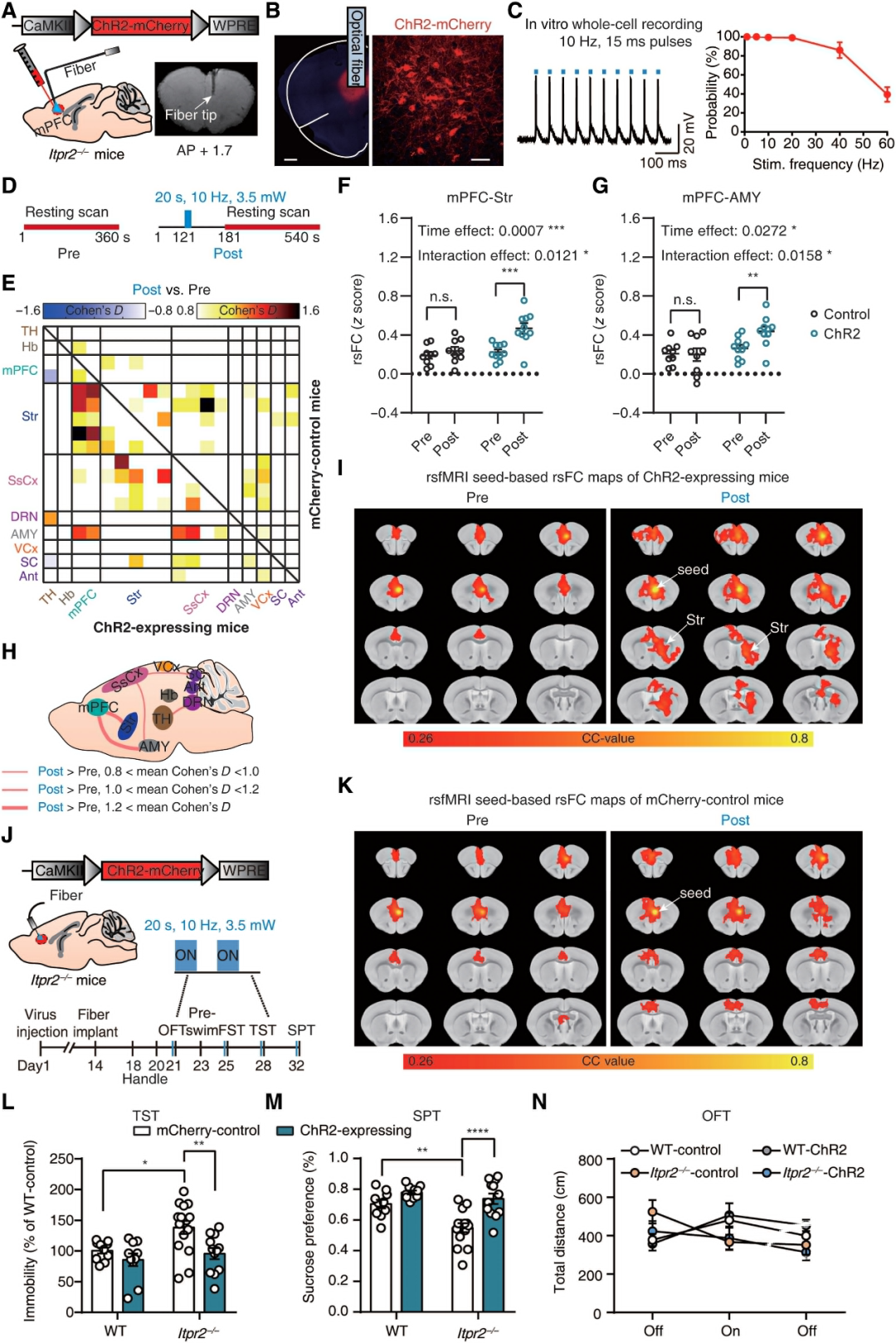
图4:光遗传学激活mPFC神经元可改善Itpr2−/−小鼠的部分rsFC和抑郁样行为。

结合MEMRI和光遗传激活mPFC神经元的结果(图3和图4),作者表明mPFC-str通路可能是介导Itpr2−/−小鼠抑郁样行为的最重要神经回路,因为mPFC-amy通路中的Mn2+积累没有变化(图3、E和F)。
作者接下来利用光遗传刺激选择性地调节了Itpr2−/−小鼠的mPFC-str投射,AAV-CamkII-hChR2-mCherry或AAV-CamkII-mCherry单侧注射到Itpr2−/−的mPFC中(图5,A和B)。
结果表明,光遗传激活mPFC-Str投射挽救了大多数异常的rsFC,尤其是mPFC-Str和mPFC-AMYrsFC,并在Itpr2−/−小鼠中产生抗抑郁作用。
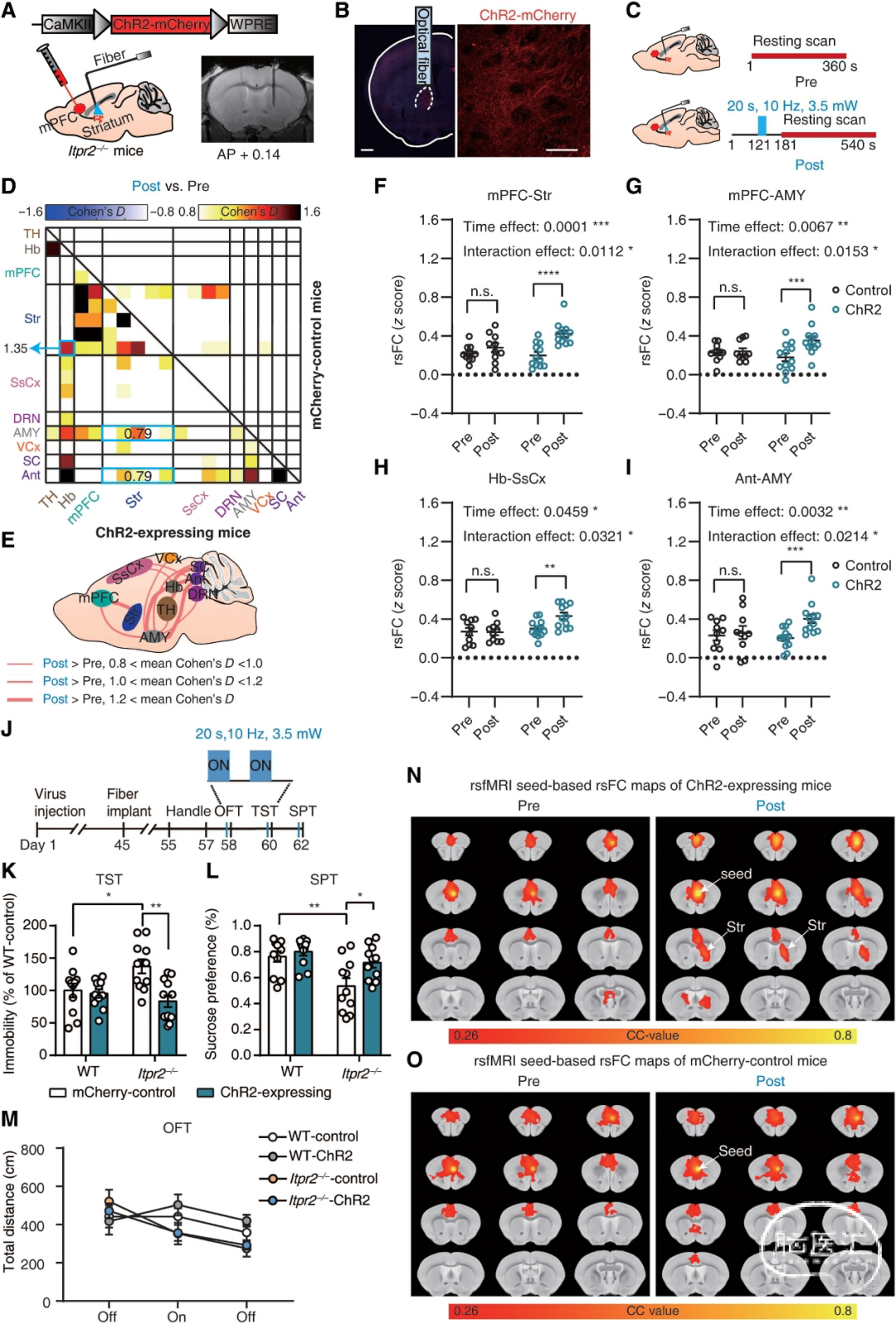
图5:光遗传学激活Str区mPFC末端可部分改善rsFC和抑郁样行为。
综上所述,作者发现,在抑郁症相关网络中,Itpr2−/−小鼠的rsFC特征降低。抑郁症患者表现出与Itpr2−/−小鼠高度一致的rsFC变化,可以通过星形细胞活化来部分挽救这一特征。
此外,使用光遗传刺激增强mpfc相关的rsFC,尤其是mPFC-StrrsFC,与改善Itpr2−/−小鼠的抑郁样行为平行,表明星形胶质细胞功能障碍驱动抑郁症患者的异常rsfMRI连接。
本项工作为抑郁症中星形胶质细胞机制和rsfMRI测量的网络异常之间的看似合理的因果关系提供了一个以前未识别的和机制上的见解。
参考文献:
Liu J, Mo JW, Wang X, et al. Astrocyte dysfunction drives abnormal resting-state functional connectivity in depression. Sci Adv. 2022;8(46):eabo2098. doi:10.1126/sciadv.abo2098
AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或扫码添加AiBrain助手微信获取。


✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。