排版 | AiBrain 编辑团队

脑缺血(cerebral ischaemia)广义上来讲是指脑血液供应不足,难以满足脑组织代谢需求,从而产生一系列症状的综合征。脑缺血后发生的分子级联反应十分复杂,阻碍了神经保护疗法的发展。
在脑缺血期间或之后,轻度至中度(31-34°C)的低温对神经有强大的保护作用。低温可以同时抑制多种机制的脑细胞死亡,减缓代谢过程,以限制组织损伤,为脑缺血患者提供附加或协同的有益临床效果。
然而,目前使用的由外围冷传感器触发的降低核心体温(Tcore)到所需水平是无效的。冷却过程还会引起强烈的反作用,在清醒的病人中难以忍受的寒颤产热,并对心脏、肺和大脑产生副作用。因此,迫切需要一种更好的方法来诱导治疗性低温。
哺乳动物和鸟类进化的一个决定性特征是恒温,通过Tcore和代谢的持续均衡调节实现。然而,许多哺乳动物物种,包括小鼠,在面临食物短缺或恶劣环境条件时,可以启动麻木状态(Torpor)和冬眠。身体进入低温状态,Tcore下降到远低于其稳态设定值。体温调节中心位于下丘脑视前区(POA)。温敏神经元(WSNs)是实现身体降温和低温所需的恒温器。温度调节神经元的几个亚群聚集在POA中,每个亚群都有独特的基因表达模式。来自POA Vglut2-TRPM2神经元的兴奋信号促进低体温。谷氨酸能Adcyap1阳性细胞、Q-神经元和雌激素敏感的内侧视前区(MPA)神经元群体也足以驱动代谢率和体温的协同下降,类似于Torpor状态。Torpor小鼠降低了Tcore、运动、代谢率、感官感知和呼吸,但没有出现颤抖发热和器官损伤的迹象。因此,有人认为,在如经历脑外伤或手术的人类患者中诱导一种类似麻木的状态有助于减少器官损伤。
2022年11月12日,南方科技大学生命科学学院侯圣陶教授和宋昆教授课题组合作在《Nature Communications》杂志在线发表题为“Hypothermia evoked by stimulation of medial preoptic nucleus protects the brain in a mouse model of ischaemia”的研究论文。该研究有效证实脑深部电刺激(DBS)激活小鼠下丘脑内侧视前核(MPN)温敏神经元能够诱导低体温,实现对于脑卒中后的神经保护作用。

研究人员使用化学遗传学方法特异性激活MPN中的兴奋性神经元(包括WSNs),以证明选择性激活WSNs引发保护性低温。Song及其同事先前已证明1,在双侧POA(Vglut2-Cre-CNO组)中,预注射表达cre依赖的Gq-DREADD融合到mCherry(AAV-hSyn-DIO-Gq-mCherry)的腺相关病毒(AAVs),给Vglut2-ires-Cre敲入小鼠全身注射化学活化剂氯氮平-N-氧化物(CNO),可在30分钟内迅速诱导低温,将Tcore稳定降低到~30°C(图1a-c)。低温持续12小时,可以反复诱导且不引起任何明显的长期不良反应。随着CNO逐渐消失,Tcore恢复到正常状态36.5-38°C之间(图1b)。在短暂性大脑中动脉闭塞(tMCAO)1小时后,使用化学遗传学诱发低温显著保护小鼠大脑免受缺血/再灌注损伤(图1d)。与低温tMCAO组(HT30)相比,常温tMCAO组(NT)梗死核心体积为55.93±4.00% vs. 6.97±0.51%(图1e),由于低温导致梗死体积减少了近92%。HT30组小鼠的脑水肿也明显减轻(图1f),其神经功能缺损评分、和前爪拉力也显著优于NT小鼠(图1g,h)。
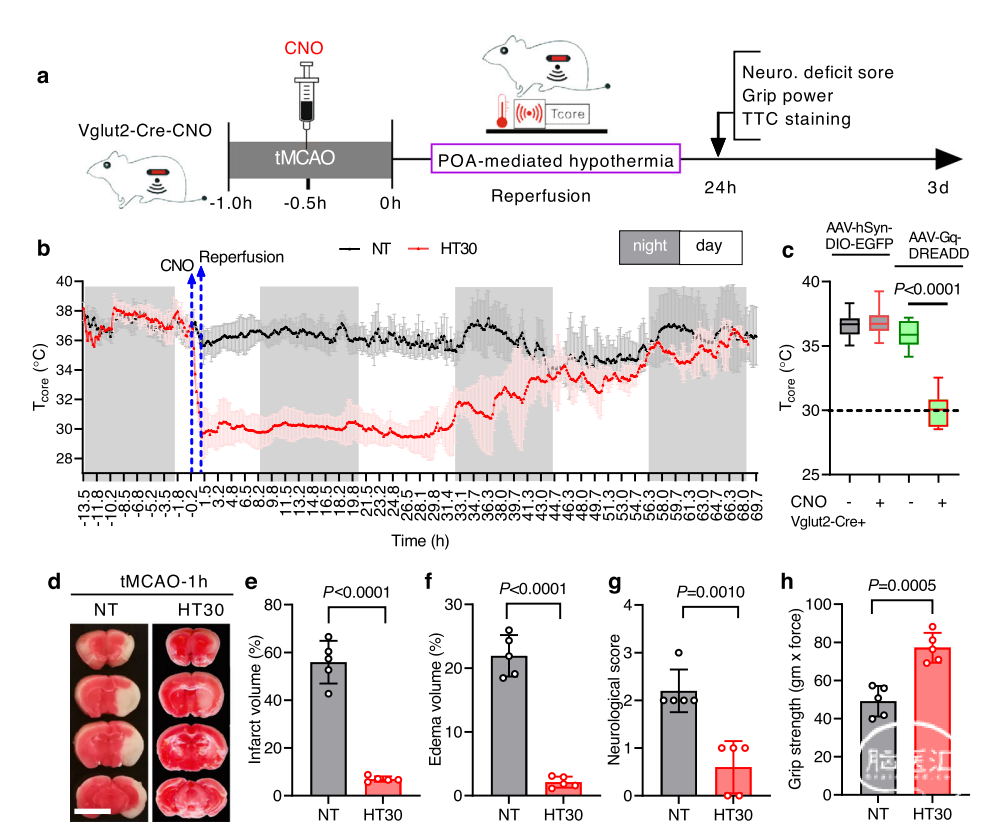
图1:化学遗传学诱导的低温在再灌注期间保护了缺血性脑。
在化学遗传学和表面冷却引起的低温期间,小鼠生理和代谢反应发生显著差异(图2)。首先,注射CNO后,棕色脂肪组织温度(TBAT)与Tcore一起下降(图2a),而TBAT在表面冷却期间保持较高,下降速度低于Tcore(图2b)。第二,在化学遗传学诱发低温期间小鼠没有颤抖,但表面冷却的小鼠不受控制地发抖(图2c)。颤抖的程度(颤抖次数)与Tcore的下降呈负相关(图2c)。第三,在表面冷却诱发低温过程中,去甲肾上腺素水平(图2d)和血糖水平(图2e)升高。第四,随着表面冷却过程中Tcore的进一步减少,呼吸速率显著增加(图2f)。相反,在Vglut2-Cre小鼠化学遗传诱导低温过程中,这些生理参数几乎没有变化(图2c–f)。
然后,研究人员使用间接量热法测定了低温过程中代谢率的差异(图2g–i)。小鼠的化学遗传诱发低温显示,耗氧量(VO2)减少了59%,产热减少了60%,呼吸交换率(RER)减少了11%。相比之下,在表面冷却诱导的低温期间,代谢率保持较高,VO2消耗减少10%,产热减少8%,RER水平降低5%(图2g–i)。表面冷却诱导低温小鼠的呼吸速率(每分钟呼吸次数)远高于化学遗传学诱导的低温小鼠(图2f)。总之,这些数据表明,WSNs激活会引起一种生理和代谢率降低的麻木状态。相比之下,表面冷却是有压力的,并引起强烈的颤抖产热。这些数据表明,刺激WSNs可以在人体中实现可耐受的治疗性低体温。
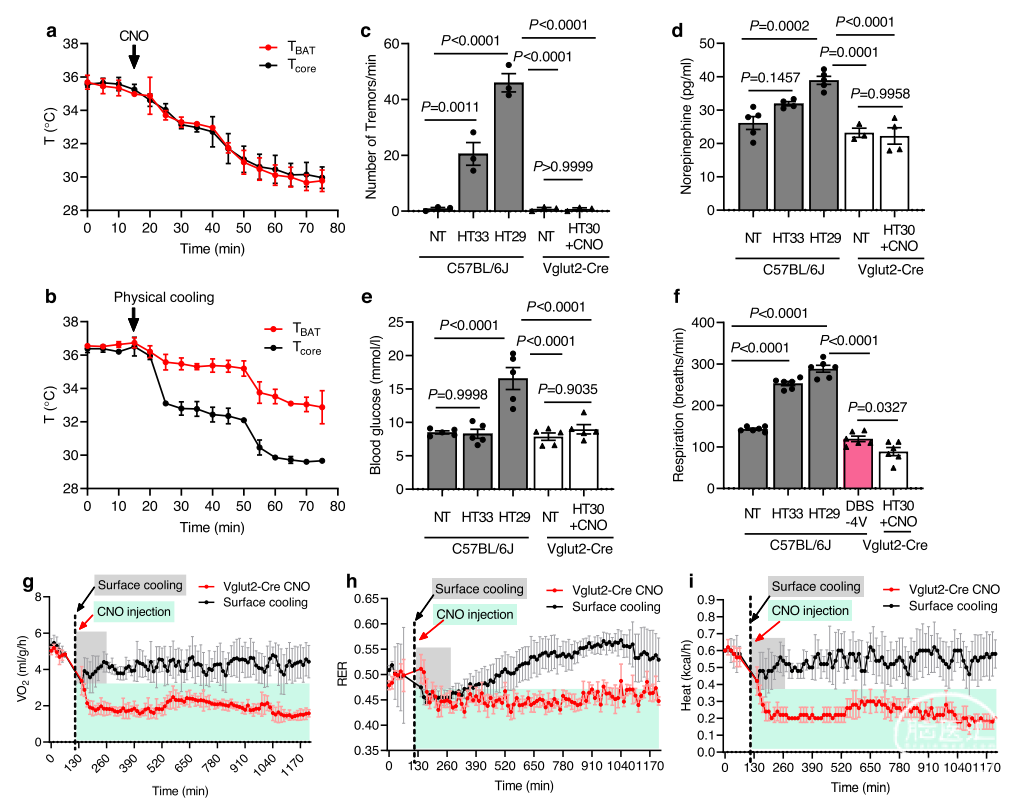
图2:由化学遗传学和表面冷却引发的低温过程中生理和代谢变化。
DBS可以调节神经环路,已被用于治疗多种神经障碍疾病。目前,尚未尝试使用高频刺激(HFS)降低Tcore以保护大脑。在此,研究人员使用了植入双侧MPN的开环电极刺激系统进行DBS,同时使用腹部植入遥测温度传感器或直肠传感器跟踪Tcore(图3a–c,b’)。根据经验选择刺激设置以最大化效益。HFS电压设置为1,2,3,4V,在40、100或130Hz频率下,脉冲宽度为90µs。HFS电压和频率与Tcore在30分钟内降至32-34°C相关(图3d–g)。后续实验在4V、100Hz、90μs的脉冲宽度下进行。关闭DBS后,Tcore在2h内逐渐恢复正常(图3h)。与未处理的对照组小鼠相比,33-34°C下的DBS小鼠VO2消耗减少(28%±0.08%),产热减少(23%±0.05%),RER减少(16%±0.04%)(图3i-l)。与表面冷却低温小鼠相比,DBS期间呼吸速率显著降低(图中的HT29)。这些代谢和生理参数与DBS诱发的低温和WSNs的化学遗传学激活非常相似。
重要的是,tMCAO小鼠在tMCAO后1h和4h分别进行4h DBS,发现对大脑具有显著的保护作用,并在再灌注1d和3d检查时保留了运动功能(图3m-o)。与再灌注1d和3d tMCAO脑相比,DBS脑梗塞体积(图3n)和水肿(图3o)明显减少。神经功能缺损评分(图3p)和前爪握力(图3q)也得到了较好的保留。这些数据表明,即使使用DBS进行延迟低温治疗也能有效地保护缺血性脑。
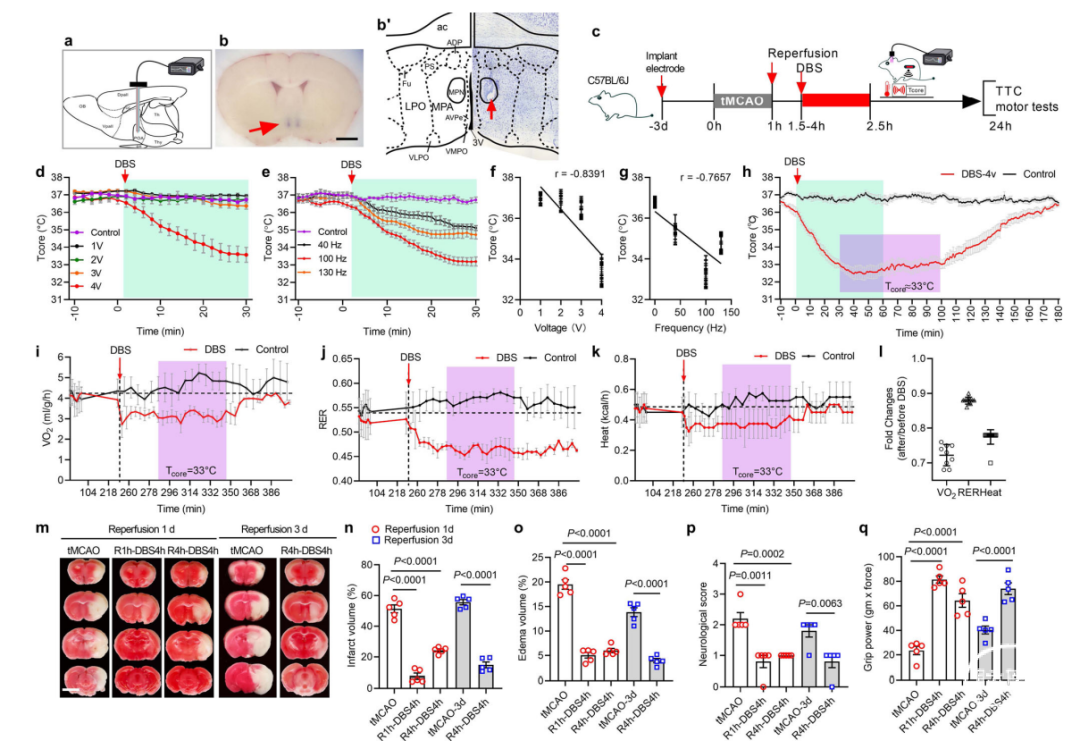
图3:深部脑刺激(DBS)诱发的低温保护缺血性脑。
MPN的DBS可导致Tcore和代谢降低。为了证明Tcore的减少是DBS介导脑保护作用的关键,研究人员对tMCAO小鼠(1 h缺血)进行了4h DBS,同时在整个DBS和再灌注期间将Tcore维持在36.5 ± 0.5°C(图4a–f)。tMCAO组(图4b中标记为NT)和DBS tMCAO组(图4b中标记为DBS@36.5°C)在梗死体积、神经功能缺损评分和前爪牵引强度方面无差异(图4c,e,f)。DBS tMCAO组水肿体积仅轻微减少(图4d)。这些数据表明,Tcore降低是DBS介导的大脑保护作用的关键。
第一,研究人员提供了强有力的证据来证明WSNs的激活有助于DBS引发的低体温。首先,由于WSNs主要位于MPA,在MPA中的MPN DBS可能会激活WSNs。为了观察邻近脑区的DBS是否也会引发低温,将电极立体定向植入外侧视前核(LPO)、腹侧苍白球(VP)以及不确定包含WSNs的区域(VDB)(图4g,j)。对LPO、VP和VDB的DBS刺激均未产生低于34°C的治疗性低温(图4h,i,k)。在刺激LPO和VDB期间,Tcore仅发生了轻微的降低,这表明MPN是引发低体温的特定DBS靶点区域。
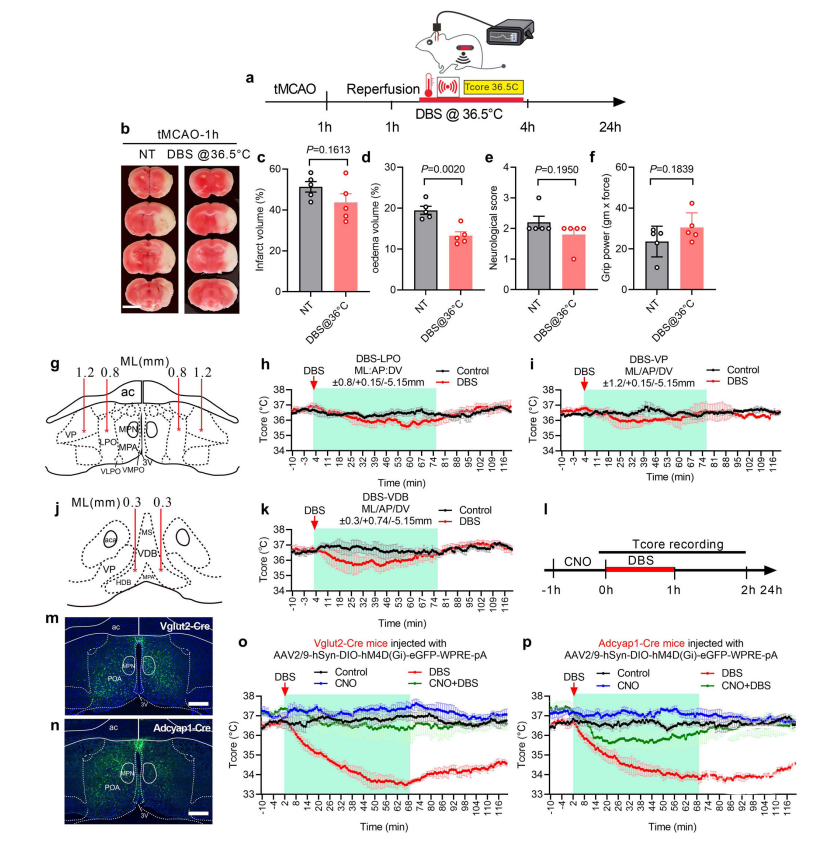
图4:在降低Tcore以对脑保护的DBS选择性和特异性测定。
第二,DBS诱导c-Fos蛋白与WSNs的特定生物标志物共表达,包括脑源性神经营养因子(BDNF)和Adcyap1。DBS诱导的c-Fos表达主要在POA的MPA(81%)和MPN(14.9%)中(图5a–d,h),视前正中核(MnPO)和视前腹内侧核(VMPO)(图5a,c,h)。MPN中大多数c-Fos阳性细胞与BDNF共定位(81.9%;图5f,i),73.6%的BDNF细胞也与c-Fos共定位。Adcyap1是谷氨酸能WSNs亚群的特异性标记,其表达主要发生在双侧MPA中,如使用RNAscope探针的原位杂交所示(图5b,d)。MPN中只有22.4%的c-Fos mRNA阳性细胞与Adcyap1 mRNA共定位,21.9%的Adcyap1 mRNA阳性细胞与c-Fos RNA表达共定位(图5g,j)。这些数据表明,DBS激活了MPA中的WSNs,这有助于诱导低体温。
第三,为了明确显示DBS激活WSNs在诱导低温治疗水平方面至关重要,研究人员将抑制性AAV2/9-hSyn-DIO-hM4D(Gi)-eGFP-WPRE-pA注射到Adcyap1-2A-cre敲入(B6.Cg-Adcyap1tm1.1(Cre)Hze/ZakJ)和Vglut2-ires-Cre敲入小鼠的MPN中,分别沉默Adcyap1和Vglut2神经元。注射的抑制性AAVs主要在双侧POA中表达(图4m,n)。兴奋性Vglut2神经元的沉默完全阻断了DBS诱发的低体温(图4o)。有趣的是,抑制MPN中的Adcyap1+神经元部分阻断了DBS诱发的低体温(图4p),表明MPA中的其他WSNs参与了对DBS刺激响应。
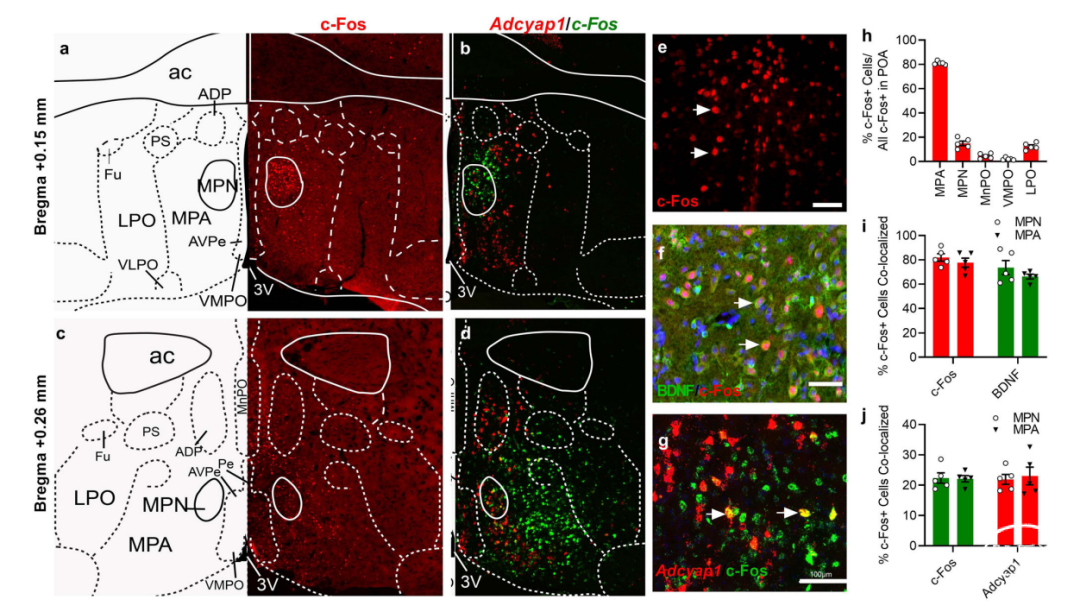
图5:DBS诱导的WSN标记的表达。
第四,DBS在体外直接激活了WSNs。研究人员对C57BL/6J小鼠脑切片的MPN进行了电生理采样,以显示在电压从0.5到8V升高时,AP放电速率增加的神经元亚群(图6a,b)2。由50 μM d-2-氨基-5-磷戊酸(d-AP-5)、10 μM 6-氰基-7-硝基喹啉-2,3-二酮(CNQX)和20 μM bicuculline组成的突触传输抑制剂,完全改善了HFS诱发的AP放电(图6c,d)。特定的N-型电压门控钙通道(N-VGCC)抑制剂ω-conotoxin-GVIA(2.5 µM),也阻断了4V HFS诱导的AP(图6d,右图)。然后,研究人员测定了大脑切片上POA神经元对温度升高的反应,以识别WSN、中度温敏神经元(MSN)、温度不敏感神经元(ISN)和无AP的沉默神经元(沉默细胞)(图6e–g)。将大脑切片温度从26°C升高到33、36和39°C,可以确定20%的细胞为WSNs(图6f,g),22.5%为MSNs,40%为ISNs,17.5%为沉默细胞,证实了先前的报道3。沉默细胞对温度升高没有反应(图6f)。对大脑切片进行4V HFS,然后在33-39°C的温度下进行热刺激。这种刺激序列能够确定对电刺激和热刺激都有响应的WSNs,其放电率显著增加(图6h)。数据显示,27.5%的神经元对4V HFS和39°C热刺激都有反应(图6i),23.6%的神经元仅对4V HFS有反应。总的来说,这些数据表明4V HFS确实激活了MPN中的WSNs。
第五,突触囊泡胞吐是神经活动对HFS反应的另一个标志。双向方差分析显示,4V HFS和ω-conotoxin-GVIA抑制作用之间存在统计学上显著差异,即4V和ω-conotoxin-GVIA对突触囊泡胞吐均产生影响。
第六,在注射了Gq-DREADD-AAV的C57BL/6J和Vglut2-Cre小鼠的急性脑切片上,使用Fluo-8测量神经元细胞内钙在HFS和热刺激下的瞬变。研究发现,HFS显著增加了MPN神经元亚群中细胞内钙瞬变([Ca2+]i)的平均强度(dF/F0)和频率(min)(图6j,k)。兴奋性和抑制性突触抑制剂,包括D-AP-5(50 µM),CNQX(10 µM)和bicuculline(20 µM),在响应4V HFS时阻断[Ca2+]i(图6i-l),使用ω-conotoxin-GVIA阻断N-VGCC也抑制了[Ca2+]i(图6k,l)。总之,在体DBS和体外脑切片实验表明,MPN的HFS激活了温敏神经元,这有助于诱导低体温和防止脑缺血。轴突和突触机制也有助于DBS诱发低体温。
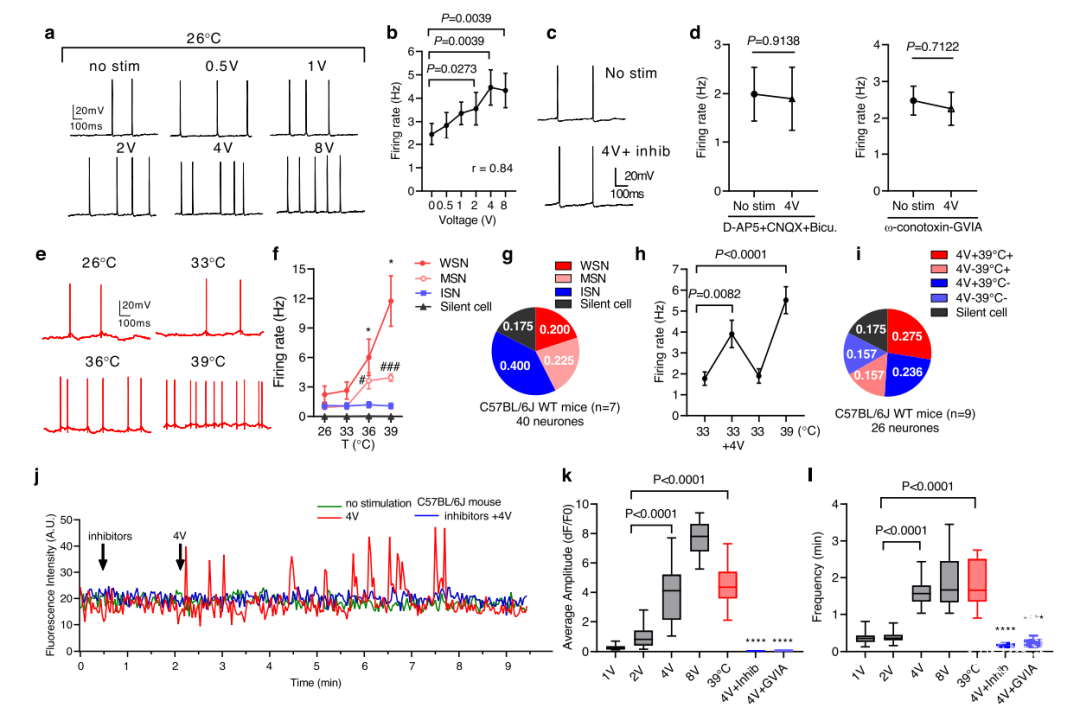
图6:DBS激活MPN中的温敏神经元(WSNs)。
脑缺血是世界范围内导致死亡和残疾的主要原因。脑缺血疗法代表了最重要的未满足医疗需求,并强调了对新靶点目标的迫切需求。该项研究建立了使用DBS诱发的中低温用于大脑保护的概念证明,将该技术应用于人类脑卒中治疗需要进一步的研究。

参考文献(上下滑动查看):
AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或扫码添加AiBrain助手微信获取。




声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。