
引用本文:陈清亮, 申猛, 梁昊, 等. Neuroform Atlas支架辅助弹簧圈栓塞大脑中动脉分叉处宽颈动脉瘤的初步临床应用研究 [J] . 中华神经医学杂志, 2022, 21(7) : 706-709.
DOI:10.3760/cma.j.cn115354-20220128-00059
目的
初步评估Neuroform Atlas支架辅助弹簧圈栓塞大脑中动脉分叉处宽颈动脉瘤的有效性及安全性。
方法
回顾性分析河南省直第三人民医院影像介入科、郑州大学第一附属医院介入科治疗中心自2021年1月至2021年12月使用 Neuroform Atlas支架辅助弹簧圈栓塞治疗的11例大脑中动脉分叉处宽颈动脉瘤患者的临床资料。所有患者术前均经CTA和(或)DSA确诊为大脑中动脉分叉处动脉瘤,所有患者均接受Neuroform Atlas支架辅助弹簧圈栓塞治疗。术后即刻DSA检查以Raymond分级评估动脉瘤栓塞情况。观察术后并发症情况,以评估治疗的安全性。患者术后6个月随访,复查DSA,评估动脉瘤有无复发及支架内血流通畅情况。
结果
手术结果:11例Neuroform Atlas支架辅助弹簧圈栓塞动脉瘤手术均顺利完成,技术成功率100%。术后即刻DSA检查显示:Raymond分级Ⅰ级9例、Ⅱ级1例、Ⅲ级1例(直径为2mm的未破裂小动脉瘤)。围手术期间未观察到脑实质出血或支架内急性血栓形成等严重并发症发生。出院前5例破裂动脉瘤患者mRS评分0分1例、1分2例、3分2例;6例未破裂动脉瘤患者无明显神经功能缺损症状。
随访结果:随访期间未发生脑卒中相关事件,末次随访时5例破裂动脉瘤患者mRS评分0分4例、1分1例,6例未破裂动脉瘤患者未见明显神经功能缺损症状。术后6个月所有患者均接受影像学随访。9例患者行DSA检查,结果显示Raymond分级Ⅰ级8例、Ⅱ级1例,未见置入支架血管狭窄或者闭塞。2例患者行CTA检查,结果显示支架内血流通畅,未见载瘤动脉明显狭窄及动脉瘤复发。
结论
综上所述,采用Neuroform Atlas支架辅助弹簧圈栓塞颅内动脉分叉处宽颈动脉瘤,动脉瘤闭塞率高的同时并发症发生率低,有效性及安全性较好,临床效果满意。
随着磁共振血管造影(MRA)技术的普及,颅内动脉瘤的检出率显著增加并发现大脑中动脉M1段分叉处动脉瘤占比较高[1]。因其特殊的三岔口解剖结构及复杂的血流动力学因素,破裂出血的几率也较高[2]。血管内介入治疗该区域动脉瘤,特别是宽颈动脉瘤时操作技术难度相对较大,组合“Y”或“T”型支架辅助栓塞以及“冰激凌”技术辅助栓塞后患者的并发症发生率相对较高,因此,部分神经外科专家更倾向于采用开颅直视下瘤颈夹闭术治疗大脑中动脉分叉处宽颈动脉瘤[3]。
随着神经介入器材的更新换代,越来越多的神经介入专家开始尝试采用新型支架进行该区域动脉瘤的血管内介入治疗,并取得了令人满意的临床效果[4-5]。Neuroform Atlas支架是一款为复杂部位动脉瘤辅助栓塞而设计的新型支架,在国内使用时间较短,积累的病例数量有限,其辅助栓塞大脑中动脉分叉处宽颈动脉瘤的有效性和安全性尚有待评估。基于此,本研究收集使用Neuroform Atlas支架辅助弹簧圈栓塞治疗的11例大脑中动脉分叉处宽颈动脉瘤患者的临床和影像学资料,分析其栓塞术后即刻以及远期疗效、围手术期并发症的发生情况,现报道如下。
研究对象及一般资料:
选择河南省直第三人民医院影像介入科、郑州大学第一附属医院介入科治疗中心自2021年1月至2021年12月使用Neuroform Atlas支架辅助弹簧圈栓塞治疗的11例大脑中动脉分叉处宽颈动脉瘤患者,其中男性4例,女性7例;年龄(57.7±9.2)岁,范围45~69岁;其中6例未破裂动脉瘤为体检时发现;5 例破裂动脉瘤患者因头痛、呕吐入院,急诊CT提示蛛网膜下腔出血,Hunt-Hess 评分Ⅰ级2例、Ⅱ级2 例、Ⅲ级1例。所有患者术前均经CTA 和(或)DSA确诊为大脑中动脉分叉处动脉瘤,其中位于左侧大脑中动脉分叉处7例,位于右侧大脑中动脉分叉处4例;动脉瘤直径(3.7±1.3)mm,范围2.0~5.2 mm;体颈比0.5±0.2。
手术方法
所有患者均为气管插管下全麻,经右侧股动脉入路,行全脑DSA检查及载瘤动脉的3D图像重建,明确动脉瘤的大小、形态及与分叉动脉的毗邻关系,进而确定支架、选择置入的动脉。路图模式导引下用8F 导引导管配合6F 中间导管(Tethys 115 cm,上海加奇公司;Navien 115 cm,美国美敦力公司)上行到颈内动脉眼段水平。微导丝(Synchro 14 200 cm,美国史赛克公司)配合支架输送导管(Excelsior SL-10,美国史赛克公司)尽可能进入到预释放支架的动脉的远端。栓塞工作位下将输送弹簧圈导管(Echelon10 90°、45°或者直头,美国美敦力公司)进入瘤腔内, 第一个弹簧圈“成篮”后经DSA确认分叉动脉处血流未受影响,调整DSA机头至支架,释放工作位释放支架,释放至瘤颈处时轻轻推送支架,采用“灯笼”或“穹窿”技术[6],尽可能覆盖瘤颈,保护分叉对侧动脉不被弹簧圈堵塞,DSA证实分叉动脉都通畅后,再全部释放支架并解脱第1个弹簧圈;恢复弹簧圈填塞工作位,依次填入弹簧圈(Target 电解脱弹簧圈,美国史赛克公司;Axium 机械解脱弹簧圈,美国 EV3 公司;维心电解脱弹簧圈,山东维心医疗器械有限公司)致密栓 塞瘤腔。栓塞术后即刻患者行头颅C臂CT扫描,判断有无脑实质出血或蛛网膜下腔出血增多。
围手术期管理
未破裂动脉瘤患者:术前5天给予阿司匹林 100mg/天+氯吡格雷75mg/天口服,术中鞘管置入后立即静脉给予2000U肝素,手术持续时间每超过1个小时追加1000U肝素,术后继续口服阿司匹林100mg/天+氯吡格雷75 mg/天。
破裂动脉瘤患者:术中第1枚弹簧圈成篮、Neuroform Atlas支架释放后依据体质量立即给予静脉团注盐酸替罗非班注射液5~10mL,后微量泵入盐酸替罗非班注射液5~10mL/小时,持续24-36小时;围手术期间多次查患者的活化部分凝血酶时间,根据结果调整抗凝、抗血小板药物用量;在手术中至术后1周内持续泵入尼莫同注射液以防止脑动脉痉挛。其中 4例患者在动脉瘤栓塞后接受腰大池置管引流。
疗效评价
术后即刻行DSA检查,采用Raymond分级评估动脉瘤的栓塞程度:Ⅰ级为完全栓塞,瘤腔完全不显影;Ⅱ级为次全栓塞,瘤体填塞完全,瘤颈处可见少量造影剂进入;Ⅲ级为不完全栓塞,造影剂在瘤体内有充盈[7]。
随访
术后通过门诊和电话进行临床随访,采用改良Rankin量表(mRS)评分评估患者的临床预后,其中mRS评分0~2分为预后良好,3~6分为预后不良。术后6个月采用DSA或CTA进行影像学随访,评估动脉瘤的栓塞程度、支架置入血管、载瘤动脉和动脉瘤复发情况。
手术结果
Neuroform Atlas支架辅助弹簧圈栓塞11例动脉瘤均顺利完成,技术成功率100%。术后即刻DSA检查显示:Raymond分级Ⅰ级9例、Ⅱ级1例、Ⅲ级1例(直径为2mm的未破裂小动脉瘤)。围手术期间未观察到脑实质出血或支架内急性血栓形成等严重并发症发生。出院前5例破裂动脉瘤患者mRS评分0分1例、1分2例、3分2例;6例未破裂动脉瘤患者无明显神经功能缺损症状。
随访结果
本组患者出院后均接受电话和门诊随访, 随访时间6.3~9.7个月,随访期间未发生脑卒中相关事件,末次随访时5例破裂动脉瘤患者mRS评分0分4例、1分1例,6例未破裂动脉瘤患者未见明显神经功能缺损症状。术后6个月所有患者均接受影像学随访。9例患者行DSA检查,结果显示Raymond分级Ⅰ级8例、Ⅱ级1例,未见置入支架血管狭窄或者闭塞。2例患者行CTA检查,结果显示支架内血流通畅,未见载瘤动脉明显狭窄及动脉瘤复发。
典型病例
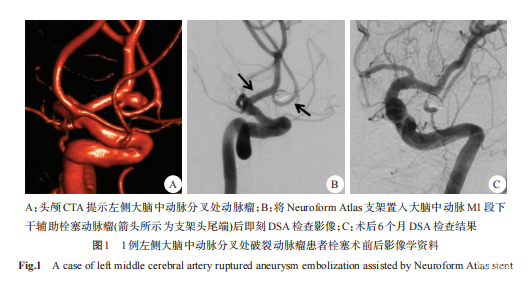
病例1:患者男性,52岁,以突发头痛4小时为主诉入院,头颅CT示蛛网膜下腔出血,CTA提示左侧大脑中动脉分叉处动脉瘤,大小2.6mm×3.7mm,宽颈,瘤颈与大脑中动脉M1段下干关系密切。采用Neuroform Atlas支架(2.5mm×24 mm)辅助弹簧圈栓塞治疗,术后即刻DSA检查显示动脉瘤栓塞满意,Raymond分级Ⅰ级,术后6个月复查DSA显示动脉瘤栓塞满意,无复发,Raymond分级Ⅰ级,同时大脑中动脉M1段上下干血流未受影响。具体内容见图1。
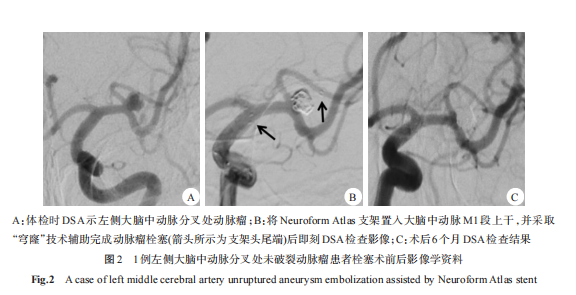
病例2:患者女性,45岁,以体检时发现左侧大脑中动脉动脉瘤为主诉入院,DSA显示左侧大脑中动脉分叉处动脉瘤,大小 3.6mm×3.9mm,宽颈,瘤体位于大脑中动脉M1段上下干居中位置。采用Neuroform Atlas支架(2.5mm×24mm)置入大脑中动脉M1段上干,并采取“穹窿”技术辅助弹簧圈栓塞动脉瘤,术后即刻DSA检查显示动脉瘤栓塞满意,Raymond分级Ⅰ级;术后6个月复查DSA显示动脉瘤栓塞满意,无复发,Raymond分级Ⅰ级,同时大脑中动脉M1段上下干血流未受影响。
大脑中动脉分叉处宽颈动脉瘤临床多见,其破裂出血风险也高。因该区域解剖结构复杂且存在着介入操作路程远、血管走形迂曲、分叉处2支血管相互影响、载瘤动脉直径过小等因素,血管内介入治疗较其他部位动脉瘤(如后交通动脉瘤等)技术操作难度大,并发症发生率和治疗成本也高[8]。同时因该部位动脉瘤外科术中暴露相对简单,开颅夹闭手术难度相对较低,特别合并颅内血肿的患者可同时行血肿清除术。因此,对于该部位动脉瘤,神经外科专家多倾向于外科夹闭手术治疗[9]。
近年来随着人们健康体检意识的增强和无创检查技术的进步,越来越多的未破裂脑动脉瘤通过无创头颅MRA体检发现,本组患者中有6例通过MRA体检发现。这类患者往往难以接受外科开颅夹闭手术带来的创伤以及可能出现的脑梗死、颅内感染等并发症的风险,并为此承担着巨大的心理和生理压力。
近年来随着新型辅助栓塞支架的推出(如LVIS支架等)和介入操作技术的进步,越来越多的神经介入专家对大脑中动脉分叉处宽颈动脉瘤进行了血管内介入治疗的初步尝试, 并取得了较为满意的临床结果[3-4,10]。但也发现了以往辅助栓塞支架的弊端:输送导管管径大,通过迂曲纤细动脉能力差;支架整体输送装置硬度大,顺应性差;支架释放后对分叉对侧血管血流影响大,“Y”形或“T”形双支架释放技术增加了手术操作及射线曝光时间、技术难度和成本,也相应增加了并发症的出现比率[3]。以上不足限制了大脑中动脉分叉处动脉瘤血管内介入治疗的应用。
分叉处动脉瘤辅助栓塞支架置入血管的选择标准如下:拟置入支架血管与动脉瘤瘤颈关系密切,支架置入后能更好地保护双侧动脉血流不受影响;血管直径≥2mm且不能过于迂曲。本组4例患者拟置入支架的分叉处动脉纤细(直径约2mm),且血管迂曲转角大,常规2.0F以上支架输送导管(如:Headway 21 微导管,美国 Microvention 公司;Select Plus 微导管,美国史赛克公司)通过困难且风险较高。Neuroform Atlas支架是美国史赛克公司研发的Neuroform系列支架的升级产品,为杂合环激光雕刻自动膨胀式支架,可以通过直径更小的SL-10导管(1.7F,美国史赛克公司)输送,在颅内动脉远端部位如大脑中动脉M1段分叉处、前交通段等动脉瘤辅助栓塞中的优势更加明显。本组11例患者SL-10微导管在微导丝导引下均顺利进入到达预释放分叉动脉的远端并完成了支架释放,技术成功率100%。杂合环设计的支架,使栓塞微导管穿网眼通过相对简单,特别对于载瘤动脉纤细不能同时2根微导管通过或者支架释放后栓塞导管脱出瘤腔的病例有重要价值。本组1例右侧大脑中动脉分叉处动脉瘤患者在M1段分叉上干内释放Neuroform Atlas支架后,栓塞导管不慎脱出瘤腔,后采用穿支架网眼模式顺利重新进入瘤腔,并完成弹簧圈致密栓塞。在临床工作中,我们体会到Neuroform Atlas支架支撑力适中,杂合环设计对血管适形性能好,在分叉动脉纤细而大脑中动脉M1段主干动脉较粗的血管内释放也能做到良好的贴壁,同时支架释放后对分叉动脉走形和血流扰动小。另外,尽管因本组病例数较少没有观察到不良事件的发生,但从理论上来说,这种支架的设计能极大减少相关的小血管出血和脑梗死的发生率。因支架的杂合环设计,通过半释放状态在瘤颈部小心推压可将支架“穹顶”,穹窿顶部分支架可疝入瘤颈处,把宽颈动脉瘤变为窄颈,在阻挡弹簧圈于瘤腔内同时保证分叉动脉的血流通畅。该性能对于分叉正中部位动脉瘤价值较大。本组有4例术前预计可能会采取双支架“Y”形释放技术的分叉正中动脉瘤患者,均采用此项技术后用单支架顺利完成辅助栓塞手术。
本组患者均取得不错疗效,分析原因,一方面得益于该类型支架金属覆盖率低,能有效降低支架内血栓形成发生率[10]。另一方面也得益于对适应证的把控和围手术期的科学管理,不过,需要指出的是,由于本组中破裂动脉瘤患者的Hunt-Hess评分均在Ⅲ级以内,没有明显需要外科清除的颅内血肿,同时CT显示无明显占位效应且中线结构无明确偏移,故采用血管内介入治疗,否则,我们也是建议患者行外科开颅直视下动脉瘤夹闭并血肿清除术治疗的。
综上所述,采用Neuroform Atlas支架辅助弹簧圈栓塞颅内动脉分叉处宽颈动脉瘤,并发症发生率低,临床效果满意。但本组患者样本数较少,随访时间短,尚需要多中心、大样本病例来验证其安全性和中、远期疗效。
参
考
文
献
陈清亮
河南省直第三人民医院
主任医师,硕士研究生导师,河南省直第三人民医院放射介入科主任。
郑州大学研究生毕业,硕士学位,师从于郑州大学介入治疗研究所所长、中原学者韩新巍教授。
郑州大学介入治疗研究所专家库成员,中国白求恩精神研究会介入医学会常务委员,河南省抗癌协会肿瘤微创治疗委员会常务委员,河南省科普协会介入医学会常务委员,河南省糖尿病学会微循环分会常务委员,河南省呼吸与重症学会介入医学分会常务委员。
河南省澍青医学高等专科学校特聘教授。河南省中医药大学优秀讲师。本科全过程教学优秀讲师。河南省基层医生培训讲师。
主持省级科研立项三项,获河南省医学科技奖2项。国家发明专利3项。发表核心期刊以上论文20篇。主编本专业专著一部,副主编三部。
点击或扫描上方二维码
查看更多“介入”内容






