排版 | AiBrain 编辑团队
综述简介
脑室内递送MECP2以延长瑞特综合征模型小鼠的寿命
Extension of the Lifespan of a Mouse Model of Rett Syndrome by Intracerebroventricular Delivery of MECP2

杨侃1 • 仇子龙1, 2
1中国科学院脑科学与智能技术卓越创新中心神经科学国家重点实验室,上海200031,中国
2复旦大学附属华山医院国家老年疾病临床医学研究中心,上海200040,中国
第一作者:杨侃
通讯作者:仇子龙、杨侃
瑞特综合征(Rett syndrome, RTT)是属于自闭症谱系障碍(ASD)范畴的神经发育性疾病。绝大部分瑞特综合征患儿携带甲基化CpG结合蛋白2(MECP2)基因突变,主要在女性患者中伴有寿命缩短和大脑发育迟滞、认知障碍、社交障碍以及运动能力异常等各种神经功能障碍1, 2, 3, 4。
MECP2是X染色体连锁基因,MECP2的缺失会导致MECP2-/y男性胎儿流产,或者在新生儿以及青少年时期死亡5。Mecp2-/y雄性小鼠由于具有可预测的有限生存期,因此非常适合用于瑞特综合征遗传干预候选策略的实验评估6。
相关研究结果显示,利用腺相关病毒血清型9(AAV9)通过体内静脉注射重新引入野生型MECP2,能在一定程度上延长Mecp2-/y小鼠的寿命7。然而,静脉注射AAV9-MECP2后,野生型小鼠肝脏中MECP2蛋白的表达水平是脑内的6倍8。这将引发致命的肝毒性,并为针对瑞特综合征进行的基于AAV9策略的人类临床遗传干预带来严重的安全性问题9。
本项研究中,研究人员在病毒载体的设计和病毒递送方式等方面进行了探索和改进,通过在新生小鼠脑室内注射AAV9病毒以递送MECP2的方式,显著延长了瑞特综合征模型小鼠的寿命,并且一定程度上改善了其生存质量。
首先,研究人员推测静脉注射递送AAV9- MECP2引发的肝向性可能归因于以下两点:第一,内源性Mecp2启动子的偏向性10;第二,AAV9衣壳对肝脏的亲和性11。
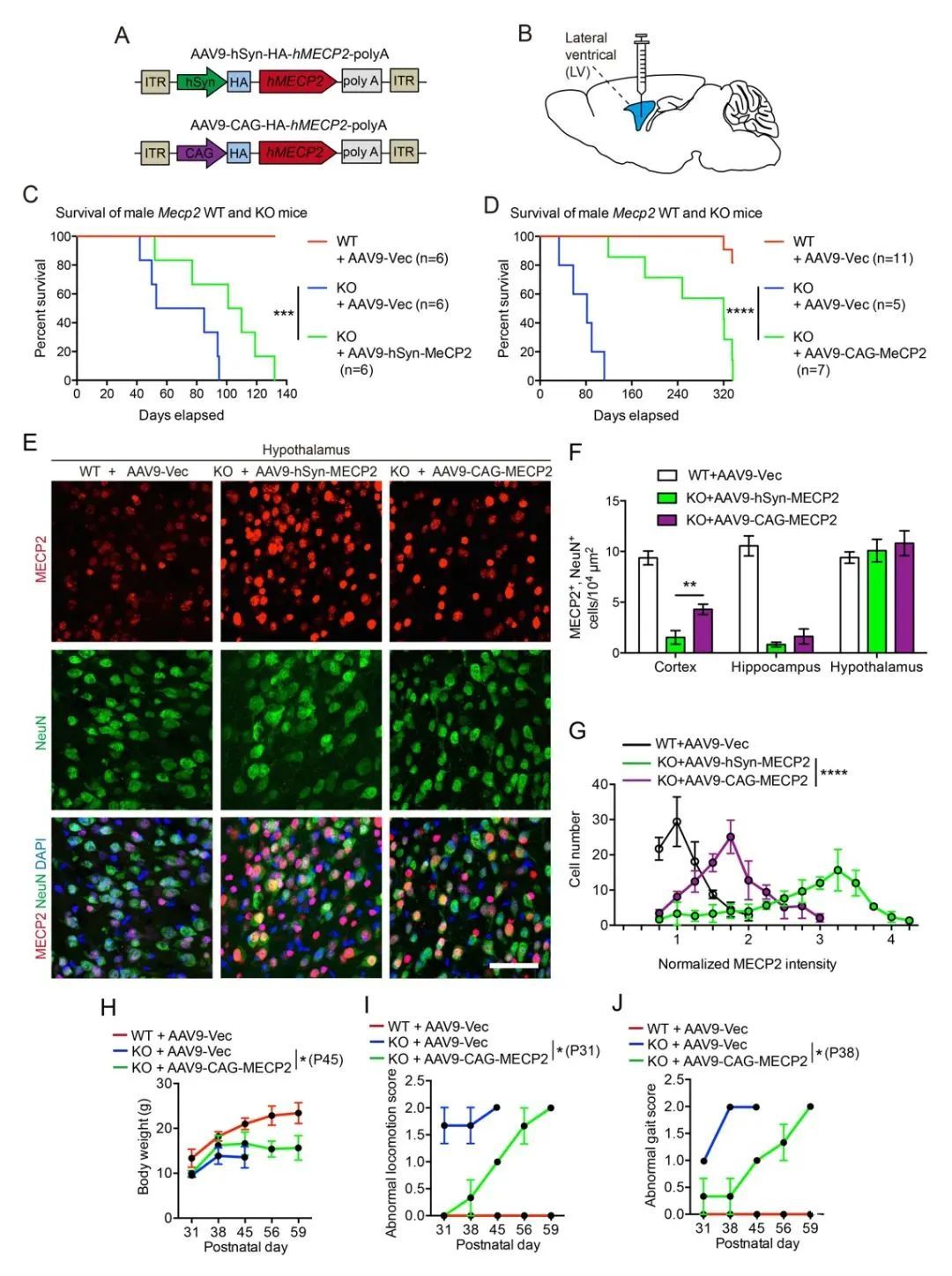
为避免使用内源性Mecp2启动子,提高MECP2在神经元中的侵染效率,研究人员设计了一个由人突触蛋白(hSyn)启动子驱动的MECP2表达载体(图1A)。同时考虑到MECP2也可能在非神经元细胞中发挥作用12,将CMV早期增强子/鸡β-肌动蛋白(CAG)启动子替换了hSyn启动子,以实现MECP2在脑中所有类型细胞中更普遍的表达(图1A)。前人的研究表明,仅在Mecp2突变小鼠的大脑中重新引入MECP2可以全面补偿正常表型13。因此,通过对新生小鼠进行立体定向脑室内(ICV)注射,可以确保AAV递送远离肝脏(图1B)。
研究人员发现,AAV9-hSyn-MECP2和AAV9-CAG-MECP2的脑室内递送都明显延长了Mecp2-/y小鼠的寿命。具体而言,AAV9-hSyn-MECP2将Mecp2-/y小鼠的中位存活百分率延长了28.70天(或 41.05% 的寿命)(图1C;***P = 0.0005; Gehan-Breslow-Wilcoxon test);而AAV9-CAG-MECP2则将Mecp2-/y小鼠的中位存活百分率延长了204.83天(或 273.11% 的寿命)(图1D;****P < 0.0001; Gehan-Breslow-Wilcoxon test)。因此,AAV9-CAG-MECP2的脑室内递送策略优于已知的其他报道。
此外,研究人员还发现通过在新生小鼠脑室内递送AAV9-CAG-MECP2能够实现Mecp2-/y小鼠皮层、海马和下丘脑等脑区中MECP2蛋白的有效回补(图1E),并且表现出更高的侵染效率(图1F)和更低的局部过表达风险(图1G)。更重要的是,脑室内递送AAV9-CAG-MECP2部分挽救了包括体重减轻(图1H)、运动评分异常(图1I)和步态评分异常(图1J)在内的病理特征。这表明,Mecp2-/y小鼠除了显著延长寿命以外,其生存质量也得到了一定程度改善。
综上所述,该项研究提出了一种全新的MECP2脑室内递送策略,显著延长了瑞特综合征模型小鼠寿命,一定程度上改善了其生存质量,为瑞特综合征早期遗传干预提供了安全有效的新选项。
△上下滑动查看△
关键词:瑞特综合征;MECP2;AAV-9;脑室内递送
参考文献(上下滑动查看):
原文链接:
https://link.springer.com/article/10.1007/s12264-022-00974-y



声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。