
排版 | AiBrain 编辑团队

阿尔茨海默病(Alzheimer's disease, AD)是一种发病进程缓慢、随着时间不断恶化的神经退行性脑部疾病。AD的疾病机制一直没有明确定论,Aβ沉积曾经被认为是重要的病理因素,但几乎所有针对Aβ的临床药物都宣布失败,因此探索AD发病机制及寻找新的药物靶点十分重要。
近日,中国科学院昆明动物研究所赖仞研究员团队牵头发现抗菌肽LL-37的表达在AD病人中大脑显著增加,进一步研究发现LL-37可以诱导氯离子通道CLIC1上调和膜转移,并激活CLIC1从而诱导氧化自由基产生、神经胶质细胞过度兴奋、神经性发炎等。
研究成果最近以“Human antimicrobial peptide LL-37 contributes to Alzheimer’s disease progression”为题在线发表于Molecular Psychiatry。

小鼠和猕猴动物实验显示,LL-37可以导致Aβ表达量升高、神经原纤维缠结、神经元死亡,尤其可以导致脑萎缩和侧脑室脑腔体积扩大、神经突触可塑性和认知记忆能力损伤等AD相关病理症状。
CLIC1基因敲除小鼠或者干预CLIC1-LL-37互作,能够显著抑制这些病理症状的发生。
有趣的是,该团队还比较了不同动物物种来源的LL-37类似物对CLIC1的激活能力,结果发现只有人类和白颊长臂猿来源的LL-37才能激活CLIC1,而小鼠和其他灵长类动物来源的LL-37没有能力激活CLIC1。
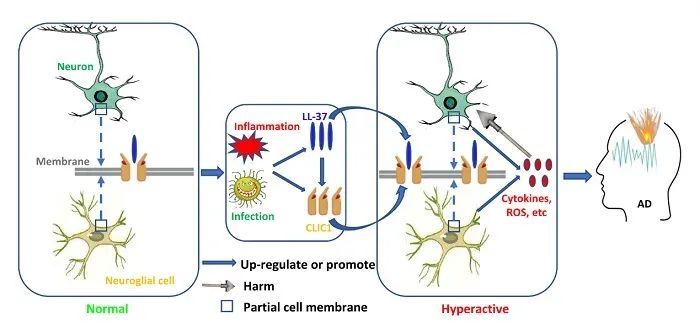
LL-37激活CLIC1通道诱导神经毒性促进阿尔茨海默症疾病进程
基于该结果和以前其他的一些研究及假设,他们谨慎地推论AD也许只在人类和极少数灵长类动物种类上发生。考虑到AD发生与感染的关联性及LL-37作为一种抗菌肽在感染情况下高表达,LL-37可能是AD发生的一种重要驱动因子。
此外,该研究也第一次发现了CLIC1的内源性激动剂LL-37。干预LL-37、CLIC1或者CLIC1-LL-37互作提供了可能的AD治疗或者药物研发策略。
赖仞(昆明动物研究所)、Michele Mazzanti(意大利米兰大学)、胡新天(昆明动物研究所)、舒友生(复旦大学)为本文的共同通讯作者;北京天坛医院赵继宗院士团队也对本研究做出了重要贡献;陈雪(昆明动物研究所)、邓穗馨(复旦大学)、王文超(昆明动物研究所)、Stefania Castiglione(意大利米兰大学)及段自磊(昆明动物研究所)为本文的共同第一作者。该项目获得了科技部重点研发计划等项目的支持。
论文链接:
https://doi.org/10.1038/s41380-022-01790-6

✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。