| AiBrain内容团队编辑
肠道微生物和大脑之间的相互交流在大脑发育、行为和功能中起到重要作用(J. F. Cryan et al.),其具体作用机制十分复杂。无菌小鼠的使用在识别可能受微生物群调节的大脑系统方面发挥了重要作用,包括血脑屏障通透性、脑容量、神经回路、髓鞘形成和小胶质细胞的改变 (J. F. Cryan et al.)。近日,来自麦克马斯特大学的Jane Foster教授在Science上发表了观点文章,通过微生物代谢信号通路探讨了肠道微生物与大脑健康联系的作用机制。
在肠脑轴的背景下,神经、内分泌、代谢和免疫通路促进微生物群到大脑的信号传导 (J. F. Cryan et al.)。在寻找将肠道微生物群与大脑健康联系起来的直接机制的过程中,微生物代谢途径的潜在作用变得显而易见。微生物衍生分子,包括神经递质、短链脂肪酸、胆汁酸、乳酸和维生素,在胃肠道环境中发挥局部作用,但也可以进入循环以在包括大脑在内的偏远部位发挥作用 (G. Caspani et al.)。当前研究需要准确提出将肠道微生物与大脑功能联系起来的生物学机制,从而筛选出作用于病理生理过程的微生物相关调节剂,并评估它们在人类疾病中的致病作用。
作者例举了两种与肠道微生物相互关联的脑疾病:肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)和自闭症(ASD,autism spectrum disorder)。这两种脑疾病与肠道微生物相互关联的作用机制受到微生物代谢物质调控。
ALS是一种神经退行性运动神经元疾病,会导致肌肉无力和萎缩。研究表明,与ALS相关的 Akkermansia muciniphila 对疾病的严重程度有积极的影响,该微生物可以减弱疾病的严重程度,而在抗生素治疗的ALS小鼠模型中,与ALS相关的瘤胃球菌Ruminococcus torques或 Parabacteroides distanonis 的定植会加剧ALS 症状。此外,模型小鼠定植A. muciniphila后疾病严重程度的改善与血清中nicotinamide(NAM)生物合成中间体的富集有关,并且独立补充NAM的小鼠也改善了行为和神经运动功能 (E. Blacher et al.)。
最近针对微生物群-大脑连接的研究,有效地将动物模型中的作用机制的研究发现对应到相关的临床人群中(E. Blacher et al., B. D. Needham et al., A. Stewart Campbell et al.)(见图)。
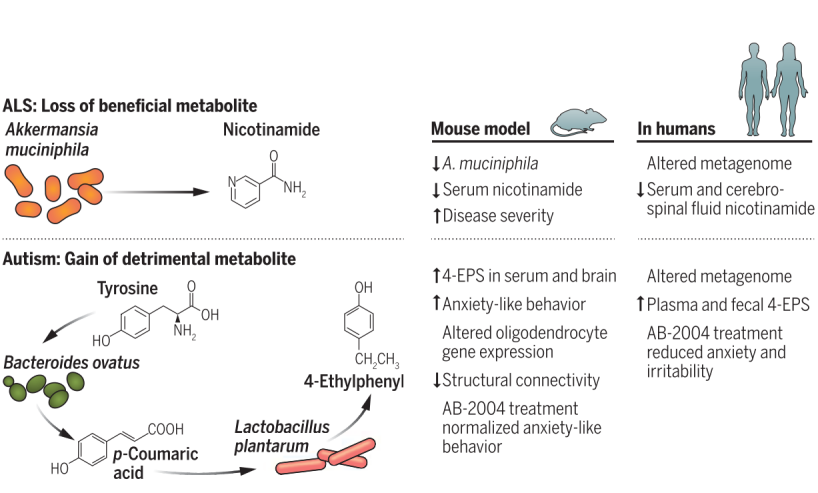
例如,在ALS动物模型中鉴定的微生物代谢物信号通路与ALS患者血清中观察到的代谢物变化类似 (E. Blacher et al.)。在一组37名ALS患者中,与29名健康人相比,这些ALS患者血清和脑脊液 (CSF) 中的NAM浓度降低了。并且,ALS 患者和健康个体之间肠道微生物群的组成出现差异。然而,Akkermansia 或其他微生物在影响人类ALS 中NAM浓度的特殊作用尚未被证实 (E. Blacher et al.)。
此外,大量临床前和临床证据表明肠道微生物群在ASD中发挥作用 (H. E. Vuong & E. Y. Hsiao)。最近的一项研究发现了一种影响小鼠焦虑行为的微生物代谢产物途径,这是ASD中经常出现的一种临床症状(H. E. Vuong & E. Y. Hsiao)。先前的临床前和临床工作表明,大量微生物衍生的芳香族代谢物4-乙基苯基硫酸盐(4-EPS)对ASD母体免疫激活模型小鼠和ASD病人的行为产生病理及生理影响(B. D. Needham et al., E. Y. Hsiao et al.)。进一步的研究表明,肠道共生细菌卵形拟杆菌(Bacteroides ovatus)可以代谢酪氨酸(一种常见的膳食氨基酸)产生对香豆酸(p-coumaric acid),而对香豆酸又可以被第二种共生细菌植物乳杆菌(Lactobacillus plantarum)代谢产生4-EP,然后4-EP被宿主细胞磺化产生4-EPS。在小鼠中接种工程化合成4-EP的细菌后,这些小鼠脑内少突胶质细胞成熟和髓鞘形成相关的基因出现差异化表达,脑内出现更低的结构连接,并且小鼠出现加剧的紧张行为。进一步给过量生产4-EP的小鼠灌喂富马酸氯马斯汀(clemastine fumarate),以促进少突胶质细胞成熟,发现小鼠的焦虑行为出现改善(B. D. Needham et al.)。
该过程的可能的机制是肠道衍生的代谢物可以向大脑发出信号,通过影响少突胶质细胞和髓鞘形成来影响小鼠的焦虑行为(B. D. Needham et al.)。 尽管如此,目前还不清楚4-EPS 浓度的增加如何影响少突胶质细胞成熟、髓鞘形成和脑连接的作用机制。
在一项平行研究中,4-EPS 被确定为可操作的治疗靶点,在 ASD患者 中具有潜在的临床益处(A. Stewart Campbell et al.)。在小鼠中进行的概念验证实验表明,口服胃肠道限制性吸附药物AB-2004,可结合并阻断芳香族代谢物(T. Niwa et al.),降低4-EP+小鼠(一种接种工程化过量生产4-EP细菌的小鼠)尿液中的4-EPS 浓度并改善焦虑症等行为缺陷(A. Stewart Campbell et al.)。一项针对患有自闭症的青少年1期开放标签临床试验表明,口服AB-2004安全且耐受性良好,并且减少了患者的焦虑和易怒行为,尤其是在基线时相关指标得分高的个体中(A. Stewart Campbell et al.)。这项初步观察性试验表明,针对ASD中的肠道衍生代谢物可能是有益的。
总之,个体病理及生理变化可能是由保护性微生物代谢物(如 NAM)的消耗和有害微生物代谢物(如 4-EPS)的升高导致的。这些结果标明或许可以通过分别提供补充剂或治疗性药物靶向微生物和/或代谢物来改善个体健康状态。
然而,将基础科学发现转换成创新的临床干预措施具有挑战性。毕竟对动物模型起作用的微生物不一定在人类疾病中也起作用,需要在临床样本中研究微生物代谢物信号通路的组成和功能变化,以确定微生物代谢物信号通路对人类健康的影响。此外,神经系统疾病的巨大临床异质性也充满挑战性,需要多种并行方法来开发基于微生物的、药理学的、饮食和生活方式的治疗策略以改善临床结果。

Jane Foster 教授
目前任教于加拿大McMaster University,Foster实验室聚焦于研究免疫系统和肠道微生物如何影响大脑功能和行为。
详细信息可查看实验室网页http://www.jfosterlab.com/。
PMID: 35617384
DOI: 10.1126/science.abo4220
文章链接:
https://www.science.org/doi/10.1126/science.abo4220?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
参考文献(滑动查看):

✦往期回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。










