以下文章来源于美力脑科学 ,作者胡柯嘉
关键词
Parkinson’s disease; deep brain stimulation; impulsivity; subthalamic nucleus; globus pallidus; reward processing; local field potentials; impulse control disorder
帕金森病;脑深部电刺激;冲动;丘脑底核;苍白球;奖赏处理;局部场电位;冲动控制障碍
背景
脑深部电刺激(Deep Brain Stimulation,DBS)能够通过脑深部装置记录神经电生理活动,其中在β波段(13-30Hz)剧烈的神经元振荡活动和同步性被称为β振荡,被认为可能是帕金森病运动功能低下状态的电生理生物标志物。帕金森病患者的β波段功率在DBS高频刺激和多巴胺能药物的作用下减弱了对药物剂量的依赖,而且减弱的程度与运动行为的改善有关。因此β波段振荡的剧烈活动与其持续时间,可能是帕金森病患者运动障碍状态的一个生物标志物。DBS的疗效依赖于对受帕金森病影响的脑环路的调节,即传感器模拟网络,这就要求DBS电极在小靶点上有着很高的准确性,如丘脑底核(subthalamic nucleus,STN)。DBS可以影响病理性β振荡频率,通过恢复感觉-运动网络的β振荡的生理性活动来实现。
DBS在STN中的感觉运动区实现了精准的调控体积(volume of tissue modulated,VTM))。然而因为还没有在自由活动的帕金森病患者身上同时测量运动行为和DBS的不同刺激强度下的STN动力学,即尚不能证明不同强度下的所调控的组织体积在多大程度上涵盖了STN的感觉运动区。
来自斯坦福大学医学院神经病学和神经科学系Yasmine M. Kehnemouyi研究团队首次展示了STN内的所调控的体积与STN-DBS不同刺激强度下的运动迟缓症状之间的相互作用。该研究使用了美敦力第一代完全植入感应神经刺激器(ActivaTM PC+S,Medtronic PLC),这使得研究者有可能在植入DBS的帕金森患者自由活动期间同步记录的STN神经活动以及其定量运动数据。
研究内容

10名临床确诊的帕金森病患者(7名男性)使用标准功能无框架立体定向技术和多通道微电极记录在STN的双侧感觉运动区植入DBS电极(3389型电极,美敦力PLC)。每个STN的背侧和腹侧边界用微电极记录确定,电极0放置在STN的腹侧边界,DBS电极通过两根导线连接到植入的研究性神经刺激器上,所有的实验测试都是在药物关期情况下进行,即停用长效多巴胺拮抗剂48小时,停用多巴胺激动剂和受控释放的卡比多巴/左旋多巴24小时,以及在研究访问之前停用12小时的短效药物治疗。所有参与者都签署了参与研究的书面知情同意书,该同意书得到了美国食品和药物管理局(FDA)和斯坦福大学医学院机构审查委员会(IRB)的批准。该研究结果在线发表于2020年6月11日的《Brain》杂志。
研究结果表明,16个STN DBS帕金森病患者中有10个具有良好特征被纳入分析。参与者的平均年龄为是55.3±9.0岁,平均病程是8.9±3.1年。术前关闭和开启药物治疗后的UPDRS III的得分是41.8±11.6和18.6±7.6。实验期间关闭药物治疗和STN DBS的UPDRS III评分分别为39.6±14.6和10.7±7.2。实验是在被试者初次程控后2.5±0.6年进行的。
研究者发现,STN DBS刺激改善了运动迟缓、降低了β功率并缩短了β爆发脉冲群的持续时间,同时β功率和爆发持续时间降低与运动迟缓改善相关,β爆发持续时间的减少与VTM和感觉运动型STN重叠增加有关,进而VTM与感觉运动STN的重叠程度和β爆发持续时间的变化可预测运动迟缓的改善。
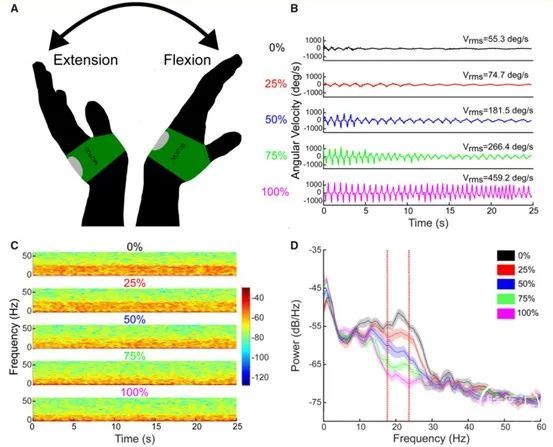
图1. 刺激对行为和β功率影响的示例。(A)用Motus陀螺仪固定在手背上进行重复性手腕屈伸(rWFE)任务的说明。(B)在每个刺激条件下的rWFE任务期间,一个有代表性的个体的角速度痕迹的例子。(C)每个刺激条件下rWFE任务期间STN LFPs的频谱图。(D)每个刺激条件下rWFE平均的PSD图,垂直红线表示β波段6Hz的感兴趣区,阴影代表95%的置信区间。
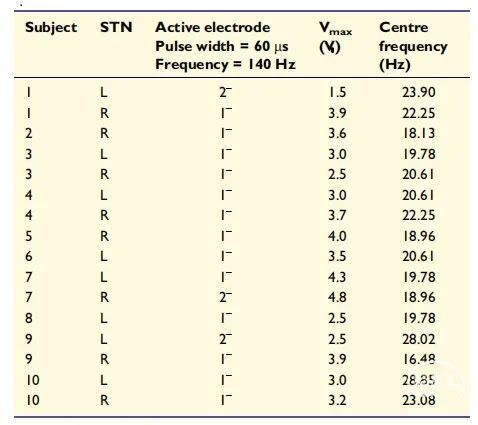
图2 STN-DBS所用刺激参数。
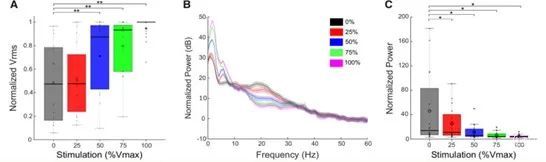
图3. DBS改善了行为并减弱了β功率。(A) 叠加单个数据的箱形图描述了RWFE期间的均方根速度(Vrms)归一化为每个STN的最大Vrms。DBS改善了Vrms,在50%、75%和100%的Vmax时与无刺激时有显著差异。75%和100%Vmax时与无刺激有显著差异。(B)在每个DBS强度下,所有STN的大平均PSDs在rWFE期间。(C) 大平均箱形图与个别数据叠加描述了在每个DBS强度下的rWFE期间每个STN的运动带的平均归一化功率。刺激逐渐减少运动带功率,在所有DBS强度下都与不刺激有明显差异。粗横线代表中位数,开放圈代表平均值。*P5 <0.05, **P5 <0.01.
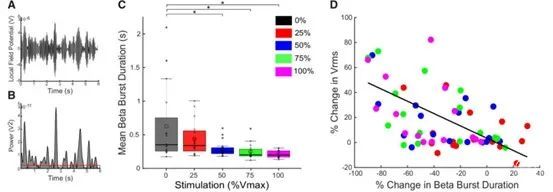
图4. DBS在rWFE过程中减少了运动频段的爆发时间,较短的爆发时间与运动迟缓的改善有关。(A)在部分rWFE任务中,6Hz运动频段的带通滤波LFP。(B)A中运动频段滤波信号,红色水平线表示用于爆发识别的基线。灰色阴影区域代表了已识别的爆发脉冲串。(C)方框图,上面叠加了单个数据,描述了每个刺激强度的运动波段爆发持续时间。DBS逐渐减少了运动带的平均爆发时间,在50%、75%和100%的最大电压下出现了明显的差异。(D)根据线性混合模型计算,运动波段爆发持续时间的百分比变化与V rms的百分比变化之间存在着显著的相关性(P<0.001)。粗横线代表中位数,开放圆圈代表平均值。*P<0.05.
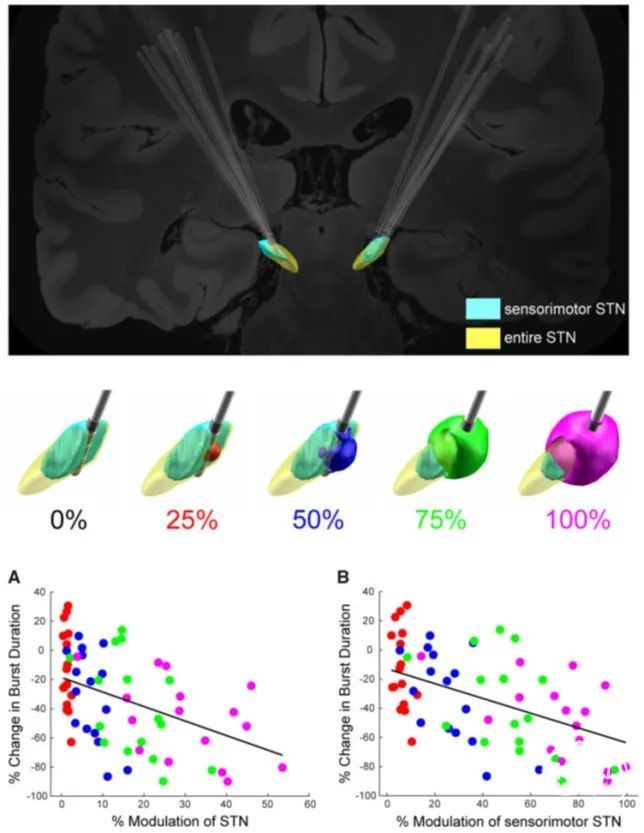
图5. β功率和爆发持续时间的变化取决于整个STN和感觉运动STN中调制的理论组织量。顶部:针对所有STN电极导线的感觉运动STN(浅蓝色)的DBS电极导线放置。中间:0%、25%(红色)、50%(蓝色)、75%(绿色)和100%(品红色)Vmax时一个STN中的VTM示例覆盖在STN上。整个STN用黄色表示,感觉运动区用浅蓝色表示。底图:(A)运动频带功率变化%与STN调制%之间的关系。(B)运动带爆发持续时间的%变化与STN感觉运动部分的%调制之间的关系。STN作为一个整体和STN感觉运动区域的%调制显著预测了爆发持续时间的变化,P<0.001,在STN感觉运动部分观察到更强的关系。
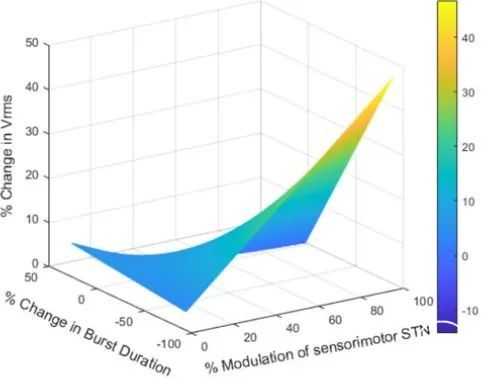
图6.运动频带爆发持续时间的变化与VTM与感觉运动STN的重叠量相互作用,预测Vrms的增加。热图代表运动带猝发持续时间变化、VTM与感觉运动STN的重叠%和Vrms的增加%之间的3D相互作用。运动带爆发持续时间的更大减少和VTM与感觉运动STN的更大重叠与Vrms变化%的更大增加相关,P<0.05。色条表示Vrms的%变化。
总结
最后,研究者总结到,本研究的结果揭示了迄今为止STN DBS的理论机制,通过阐明生理学(β振荡)、解剖学(电极导线位置)和行为学(运动学)之间的相互作用,在帕金森病长期植入患者的运动过程中使用同步神经和运动学记录。具体而言,本研究表明,STN DBS期间运动迟缓的改善取决于运动期间β功率和β爆发持续时间的减少,以及STN感觉运动区域的调节程度。除了STN DBS在帕金森病中的机制见解外,这些结果强调了在闭环STN DBS运动期间使用β功率和猝发持续时间的可行性,因为这些特征在运动期间和高频STN DBS期间仍可测量,它们的调节通过准确放置在感觉运动STN中的DBS电极导线以剂量依赖的方式与运动迟缓的改善有关。
编者注:本篇文章研究进行时,闭环刺激的Percept PC还未上市。
Robert S. Eisinger, Jackson N. Cagle, Jose Alcantara, Enrico Opri, Stephanie Cernera, Anh Le, Elena M. Torres Ponce, Joseph Lanese, Brawn Nelson, Janine Lopes, Christopher Hundley, Tasmeah Ravy, Samuel S. Wu, Kelly D. Foote, Michael S. Okun, Aysegul Gunduz. Distinct roles of the human subthalamic nucleus and dorsal pallidum in Parkinson’s disease impulsivity, Biological Psychiatry, 2021, Available online 6 March 2021,https://doi.org/10.1016/j.biopsych.2021.03.002.
复旦大学-哈佛医学院联合培养外科学博士。
临床方面主要致力于脑深部刺激治疗运动障碍性疾病,脑立体定向脑电图对癫痫病灶的精准定位,脊髓电刺激技术的探索应用,同时对脊柱微创和内镜治疗有一定经验。
科研方面主要致力于神经调控的机制和临床转化,术中神经电生理相关的运动、认知计算神经科学解码,脑机接口和神经假体研制。获上海市浦江人才计划支持,并作为负责人主持多项省部、校级课题。目前以第一作者或通信作者发表 SCI 论文 18 篇,国内核心期刊论文 5 篇。担任多个 SCI 期刊审稿人等学术兼职。





