「领域快报」是AiBrain筹备的特别栏目,是由海内外知名高校的一线青年科研工作者(博士后、PI)精选的领域科研动态,旨在为学科融合、交叉合作提供平台和机遇。
作者:Neurochick 美国国立环境卫生科学研究所博士后
「领域快报」
神经科学技术与方法
Cell
新一代高分辨率可佩带式微型快扫双光子显微镜
当代神经科学研究的一个重要目标是探索动物神经系统如何编码复杂的行为。为了能够利用光学成像方法实时监测和操纵行为动物脑内大规模的神经细胞活动,科学家们开发出了一系列工具,包括更轻更小的高分辨率在体显微镜,基因编码的钙离子或神经递质指示剂,以及拥有高精度时空表达特征的细胞特异性光学、化学敏感通道蛋白。随着近年来各种新材料、新技术的出现和应用,这些工具也得到了迅速的迭代,从而使研究者们能够在更贴近原始动物生理活动的条件下获取更高质量的数据。本文介绍了今年上半年发表的三种新工具,希望能够对读者有所启发和帮助。

Cell (IF 41.582, 发布时间2022.03.21)
双光子显微镜(2PM)用于生物医学研究已有超过三十年时间,利用其检测在体神经细胞的变化也超过20年。早期的研究受限于扫描时间长、光学器件精度和灵活程度不足、光源设备体积和产热量大等因素,需要将模式动物的头部固定在特殊的实验台上,因此无法进行复杂行为学活动中神经细胞的实时监测。
2009年由Mark Schnitzer小组开发的可佩戴在动物头部的微型荧光显微镜(miniscope) 使得实时监测自由活动中的动物脑内单个神经细胞成为可能。然而,miniscope的成像的背景噪音高,无法准确还原不同景深的目标等缺陷使得该技术无法达到双光子显微镜的成像质量。因此科学家们一直尝试开发新的微型2PM。
今年三月挪威科技大学Moser研究小组在Cell杂志上报道了该组最新开发的微型双光子显微镜MINI2P。本文第一作者宗伟健博士在其攻读博士期间曾在北京大学分子医学研究所程和平院士和陈良怡研究院联合课题组参与开发了前几代的微型2PM如FHIRM-TPM,MINI2P系统沿用前代设计中的了空心光子晶体纤维(HC-920)来传输920nm飞秒激光脉冲作为激发光源,使用双轴对称高速微电机系统(MEMS)扫描器进行快速点扫描,并且使用柔性光纤束来收集荧光信号。
在此基础上作者团队开发了新的可微调透镜组μTlens,在提高了扫描深度、降低响应时间、扩大可调节屈光范围的同时,显著降低了系统工作时因电流产生的热效应,并将显微镜总重控制在2.4g左右,这使得MINI2P非常适合佩戴在小鼠颅窗上,在保证动物正常活动的同时进行长时间的扫描。
此外,作者团队设计了快速扫描(最高扫描频率达40 Hz)和大范围扫描(最大单视窗面积约0.25 mm2)两种模型,以满足不同的实验需求。增大的扫描范围及深度结合配套软件的拼接功能使MINI2P可连续扫描2.2✕2.2 mm2范围内超过10,000个神经元。
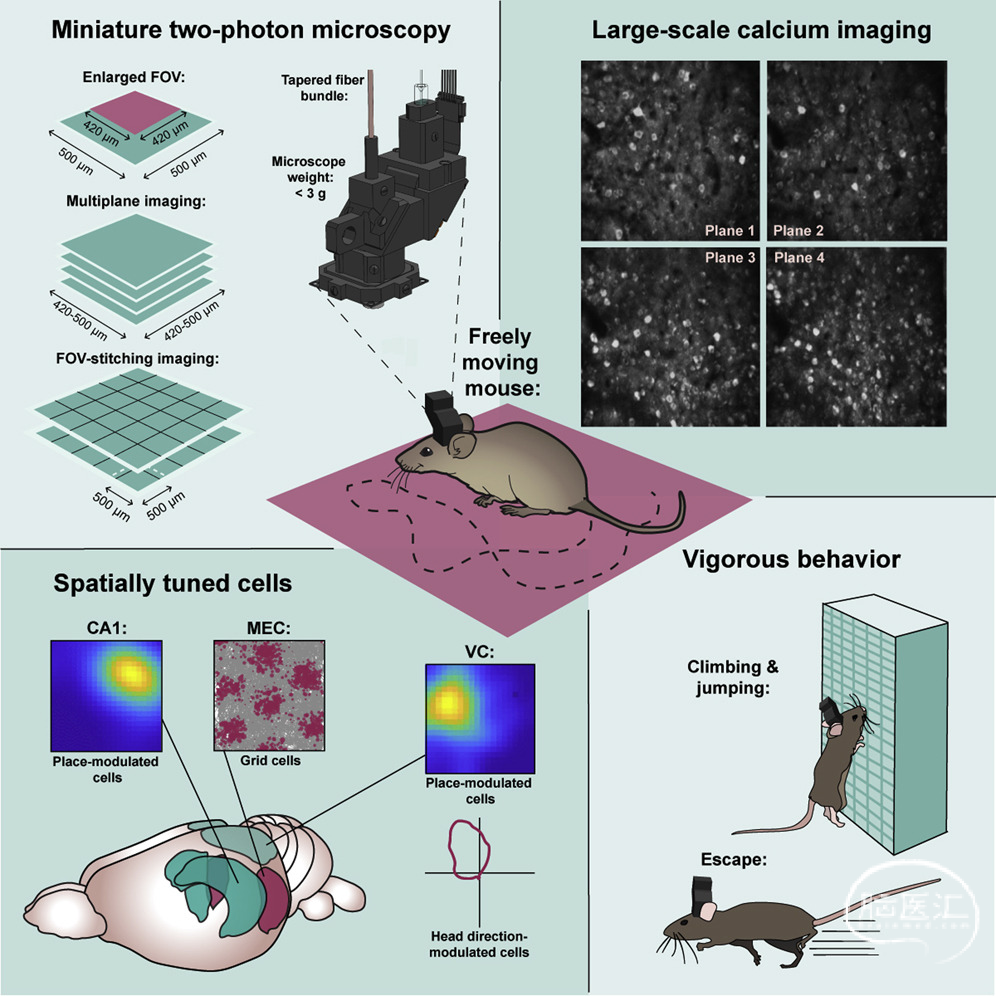
宗博士之前团队的作品FHIRM-TPM乍一问世就在多个神经科学会议引起轰动。而新的MINI2P相较前作,在重量、成像面积、系统散热等特性上有着巨大的改进,毫无疑问将成为帮助人们探索动物行为的神经基础的重要工具。
★

实验室简介:Edvard Moser
挪威科学技术大学心理学系,Kavli研究所空间和记忆研究小组Moser实验室长期聚焦于利用脑内大规模电极阵列或高分辨率双光子显微成像技术记录在体神经活动,以探索包括内嗅皮层在内的大脑皮层编码空间、时间和记忆的高级神经机制。Moser小组的主要成果包括发现内侧内嗅皮层网格细胞参与大脑空间定位功能,以及外侧内嗅皮层网络参与编码时间序列信息。因Dr. Edvard Moser及May-Britt Moser发现网格细胞对揭示大脑空间编码的贡献,两位教授与前导师Dr. John O’Keefe共同获得了2014年诺贝尔生理学与医学奖。
★
文章链接DOI:
https://doi.org/10.1016/j.cell.2022.02.017
Abstract
We developed a miniaturized two-photon microscope (MINI2P) for fast, high-resolution, multiplane calcium imaging of over 1,000 neurons at a time in freely moving mice. With a microscope weight below 3g and a highly flexible connection cable, MINI2P allowed stable imaging with no impediment of behavior in a variety of assays compared to untethered, unimplanted animals. The improved cell yield was achieved through a optical system design featuring an enlarged field of view (FOV) and a microtunable lens with increased z-scanning range and speed that allows fast and stable imaging of multiple interleaved planes, as well as 3D functional imaging. Successive imaging across multiple, adjacent FOVs enabled recordings from more than 10,000 neurons in the same animal. Large-scale proof-of-principle data were obtained from cell populations in visual cortex, medial entorhinal cortex, and hippocampus, revealing spatial tuning of cells in all areas.
Neuron
基于G蛋白偶联受体的高敏感度ATP指示剂GRABATP1.0

Neuron (IF 17.17)发布时间:2022.03.02
小分子神经递质/调质在神经系统中起着介导和调节突触传递和神经细胞状态的重要作用。受限于较低的时空分辨率和侵入式的测量方法,传统的微透析、基于电化学的探针(如FSCV)或生物荧光反应并不能实时、实地测量且灵敏度较低;一些基于基因改造荧光蛋白的探针如ecAT或pm-iATPSnFR等则在信噪比和细胞特异性方面有所不足。
北京大学李毓龙教授研究组及其合作者以G蛋白偶联受体(GPCR)为基础,通过改造GPCR基因编码使其能被不同种类神经递质、调质激活的方法(GRAB)开发了多巴胺、乙酰胆碱、5-羟色胺、腺苷等一系列小分子神经递质/调质的探针,陆续发表在高水平期刊上,并有多篇已发布在生物预印本(BioRxiv)平台上。
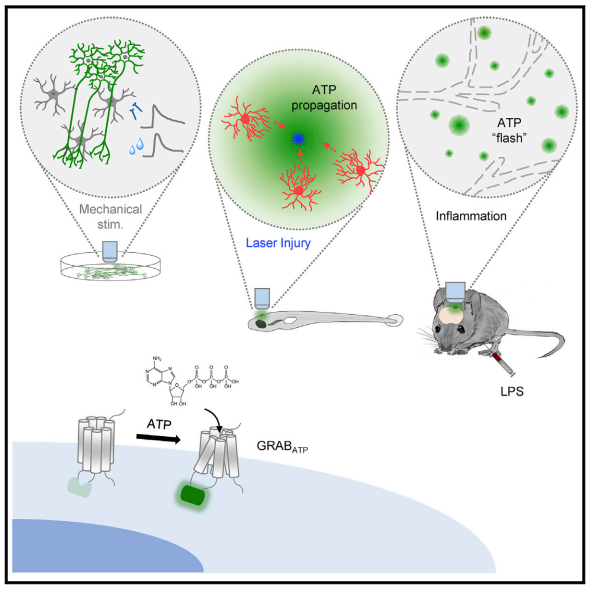
今年三月的Neuron杂志报道了李毓龙小组最新开发的腺苷三磷酸(ATP)荧光探针GRABATP1.0。该文证实了GRABATP1.0拥有亚秒级的快速动力曲线,数十纳摩尔水平的ATP亲和力并能够以亚细胞水平的分辨率定位ATP分泌的位置。使用GRABATP1.0,作者在不同模式动物的体外和在体模型中都能够检测到明显的标志ATP释放的荧光信号,表明其能够作为ATP检测工具的灵敏度及广阔的适用范围。相比于已有的ATP探针如pm-iATPSnFR,GRABATP1.0有着更好的信噪比、更高的时空分辨率及细胞特异性。
这一强有力的ATP检测工具将能够帮助研究者们对ATP介导的神经传递和调控进行系统性的研究,并能和其他神经递质探针联合研究不同递质系统的相互作用,使我们对ATP信号在神经系统相关疾病机制中的角色有新的认识。
★

实验室简介:李毓龙研究组
北京大学麦格文脑研究所、北大生命科学学院国家重点膜生物实验室李毓龙研究组研究方向包括:系统性探索和鉴定潜在的新型小分子神经递质及其受体;开发可遗传编码的神经递质、调质的荧光探针,并利用这些工具在果蝇和小鼠中研究生理和病理下的神经递质释放的调节及其对脑功能的影响;结合光遗传学和成像技术,无损伤地研究神经元之间的电突触连接;探究神经元中高密度核心囊泡对于食物摄取、侵犯行为和生物节律的作用。
实验室网址:
http://www.yulonglilab.org/faq_cn.html
★
文章链接 :
https://doi.org/10.1016/j.neuron.2021.11.027
Abstract
The purinergic transmitter ATP (adenosine 5′-triphosphate) plays an essential role in both the central and peripheral nervous systems, and the ability to directly measure extracellular ATP in real time will increase our understanding of its physiological functions. Here, we developed a sensitive GPCR activation-based ATP sensor called GRABATP1.0, with a robust fluorescence response to extracellular ATP when expressed in several cell types. This sensor has sub-second kinetics, has ATP affinity in the range of tens of nanomolar, and can be used to localize ATP release with subcellular resolution. Using this sensor, we monitored ATP release under a variety of in vitro and in vivo conditions, including stimuli-induced and spontaneous ATP release in primary hippocampal cultures, injury-induced ATP release in a zebrafish model, and lipopolysaccharides-induced ATP-release events in individual astrocytes in the mouse cortex. Thus, the GRABATP1.0 sensor is a sensitive, versatile tool for monitoring ATP release and dynamics under both physiological and pathophysiological conditions.
Nature Methods
可检测和修正钙成像实验中错误识别的钙信号的新模型

Nature Methods(IF28.55)发布时间:2022.03.28
钙成像已经成为广泛使用的监测神经细胞集群活动的技术。钙成像实验数据处理的核心是识别神经细胞膜电位电位变化导致的特征性钙信号瞬时变化(Ca2+ transient),并以此推断神经细胞活动编码动物生理变化和行为的关系。因此识别Ca2+ transient的准确性将严重影响研究的结论。
随监测技术进步而产生的越来越大的数据集使原始的人工手段识别Ca2+ transient变得越来越不现实。为了提高处理数据的效率并减少因人为习惯不同产生的偏差,科学家们陆续开发了多种算法与软件如CNMF、Suit2P等对大数据集进行自动化处理。
然而受限于当前的成像技术和算法精度,记录过程中的一些特例可能会导致在输出的Ca2+ transient时间序列中出现错误,如不同细胞的交叠将会使自动算法无法区分交叠的细胞而将来源于不同细胞的Ca2+ transient识别为来源同一细胞,或是不规则的、低信噪比的信号导致算法无法正确识别Ca2+ transient。
针对这些问题,普林斯顿大学David Tank教授及约翰霍普金斯大学Adam Charles教授的研究小组合作发表文章,检验了当前流行的一些Ca2+ transient识别算法,提出了一系列指标来评估算法识别的Ca2+ transient时间序列的准确性,并开发了一个新的软件SUEDO对错误的结果进行纠正。
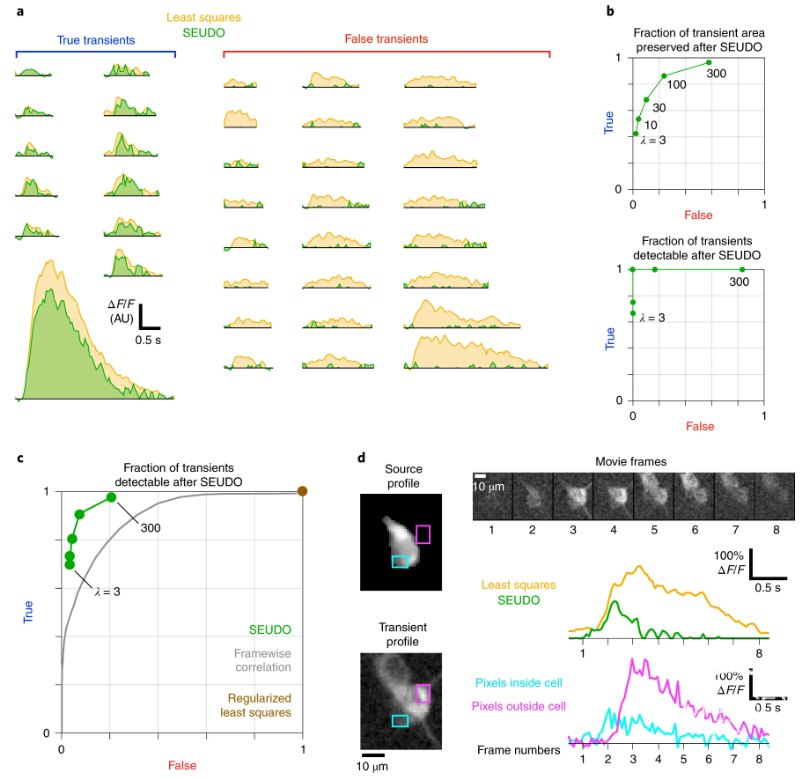
本文作者对基于受约束的非负矩阵因式分解(CNMF)算法或Suite2P算法识别的Ca2+ transient时间序列进行了人工检验,发现被检验的所有数据集广泛存在15-20%的识别错误。造成这些识别错误的原因可能源于细胞堆叠程度大、信号源形状不规则或是光学性质不佳。
进一步的统计计算显示被识别的时间序列与源信号整体变化的相关系数,以及二维Ljung-Box分位数检验可以用作区分正确与错误识别的Ca2+ transient序列的区分指标。基于这两个指标,作者们开发了一个“未知列表对象离散仿真(SEUDO)”的模型,用以消除现有算法的错误结果。使用SEUDO对一个来源于老鼠海马区CA1的Ca2+ transient数据集进行修正,结果发现在合适的参数条件下,超过90%的错误识别会被SEUDO剔除,而90%以上的正确识别则会被保留,证明了此模型的有效性。
本文中讨论的自动算法错误识别Ca2+ transient在当下的研究过程中是普遍存在却又经常被忽视的难题。本文作者提出的评估指标和据此开发的SEUDO模型将启发领域内的研究者对算法的错误有更进一步的认识,文中提供的正算法错误的方法,也将使今后的钙成像数据分析更趋于准确。
★

实验室简介:David Tank实验室
普林斯顿神经科学研究所David Tank实验室长期致力于使用在体电生理、显微成像技术研究短时程记忆相关神经环路中的持续性神经活动,以及提出描述该活动的数学模型。其过往的研究包括金鱼和斑马鱼脑干中控制眼球活动的神经积分器环路,以及小鼠脑中与识别空间地标相关的控制头部朝向的神经环路。该实验室还开发了大量在体检测神经活动化学信号、电信号的工具,包括双光子扫描显微镜以及钙离子浓度示踪剂。
Johns Hopkins大学生物工程系Adam Charles实验室成立于2020年,该实验室研究方向主要包括使用机器学习等工具开发算法用以分析和解读脑内记录的多光子成像和电生理数据,并利用高维数据集建立用以解释大脑工作机制的数学模型,如循环神经网络等。
★
文章链接 :
https://doi.org/10.1016/j.neuron.2021.11.027
Abstract
Population recordings of calcium activity are a major source of insight into neural function. Large datasets require automated processing, but this can introduce errors that are difficult to detect. Here we show that popular time course-estimation algorithms often contain substantial misattribution errors affecting 10–20% of transients. Misattribution, in which fluorescence is ascribed to the wrong cell, arises when overlapping cells and processes are imperfectly defined or not identified. To diagnose misattribution, we develop metrics and visualization tools for evaluating large datasets. To correct time courses, we introduce a robust estimator that explicitly accounts for contaminating signals. In one hippocampal dataset, removing contamination reduced the number of place cells by 15%, and 19% of place fields shifted by over 10 cm. Our methods are compatible with other cell-finding techniques, empowering users to diagnose and correct a potentially widespread problem that could alter scientific conclusions.
在招岗位
2022 RECRUIT /
招募编译团队及审稿团队
岗位职责:撰写、审阅神经科学各领域的文献导读、领域速报。
岗位要求:神经科学领域四年级以上的博士生、博士后以及青年科研工作者。
AiBrain作者团队由海内外知名高校博士生、博士后,及已成立实验室的PI们组成;加入AiBrain,可以体验专业的投审稿系统、高效温馨的团队合作、丰富的文章栏目,以及有竞争力的丰厚报酬;能力突出者可以作为领域/栏目负责人,并配有岗位津贴。
欢迎有意者投递简历及个人作品!

微信号:AiBrainzhushou
邮箱:ai_brain@163.com


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享




