作者:Candy 复旦大学
中枢神经系统的巨噬细胞(CNS macrophage)种类多样,包括脑实质组织的小胶质细胞(microglia),中枢相关巨噬细胞(CNS-associated macrophages,CAMs)等。其中,CAMs包括位于脑膜(meninges)、脉络丛(choroid plexus, CP),和血管周围的巨噬细胞。它们是中枢神经系统先天免疫系统的一部分,在发育、组织稳态和免疫诱导中发挥重要作用,并起着第一道防线的作用1。然而,它们也参与肿瘤生长和转移的病理过程,因而人们对CAMs群体越来越感兴趣,但要实现它们的治疗潜力,就需要充分地了解其起源及其内稳态机制。
不同种类的巨噬细胞的起源不同。已有研究指出血管周围巨噬细胞和脑膜巨噬细胞来自于卵黄囊中的红髓样祖细胞 (Erythromyeloid progenitors, EMPs),且具有自我更新的能力2。有研究发现在小鼠胚胎8.5天(embryonic day (E)),EMPs出现在胎膜的卵黄囊血岛(extra-embryonic yolk sac blood islands),进而通过未成熟的A1祖细胞分化为A2前巨噬细胞祖细胞3;在E9.5,这些A2祖细胞开始迁移并定居在大脑,逐渐发育成熟2。在E9.0,在胎膜的卵黄囊血岛,一类巨噬细胞不经过单核细胞中间阶段,直接发育成熟。这些巨噬细胞是小胶质细胞的主要来源,因此小胶质细胞是中枢神经系统的常驻巨噬细胞4。直到成年期,小胶质细胞和CAMs因其分布和表达的基因图谱不同而区分开。然而关于CAMs和小胶质细胞之间的个体发育发生关系仍不清楚。
2022年4月20日来自德国弗莱堡大学的Takahiro Masuda(第一作者),和日本九州大学Katrin Kierdorf和Marco Prinz(通讯作者)研究团队在国际顶级期刊《Nature》(IF=49.962)发表研究性论文,文中全面描述了血管周围和脑膜的巨噬细胞以及小胶质细胞在发育过程中的区域分布、动力学、基因表达谱和命运图谱,并阐明在特定的时间点和不同的解剖位点驱动不同种类巨噬细胞定居的分子机制。


Prof. Dr. Marco Prinz
Marco Prinz教授目前担任德国弗莱堡大学医院神经病理学研究所所长。2020年Prinz教授因其在神经免疫学领域的杰出工作而荣获德国研究基金会戈特弗里德·威廉·莱布尼茨奖(Gottfried Wilhelm Leibniz Prize of the German Research Foundation),该奖项被认为是德国最重要的研究经费奖。2021年Prinz教授因其突出的科学研究贡献当选为德国国家科学院院士。
Marco Prinz教授团队研究方向涵盖小胶质细胞、神经科学、免疫系统、中枢神经系统和细胞生物学等多个领域。目前该团队研究重点在于健康和疾病期间的大脑特异性免疫功能(自身免疫性和神经退行性中枢神经系统疾病)和大脑小胶质细胞的命运。尤其是小胶质细胞的起源和功能是他们研究小组特别感兴趣的研究方向,并发表了一系列颇具影响力文章。其科研成果多篇文章发表在国际顶级期刊 Nature, Immunity, Annual Review of Immunology, Cell Metabalism, Nature Neuroscience等。
Prinz教授团队的工作使人们对大脑中的免疫反应有了全新的认识。德国研究基金会(German Research Foundation)高度称赞了他的工作:他的发现已经澄清了之前关于大脑中免疫细胞在不同细胞类型和信号通路方向上异质性的观点。他的研究为中枢神经系统炎症和神经退行性疾病的新治疗方法指明了方向。特别是,他的研究指出小胶质细胞与阿尔茨海默病、抑郁症等疾病的发生有密切关联,表明了小胶质细胞可能在未来的脑肿瘤治疗中发挥核心作用。
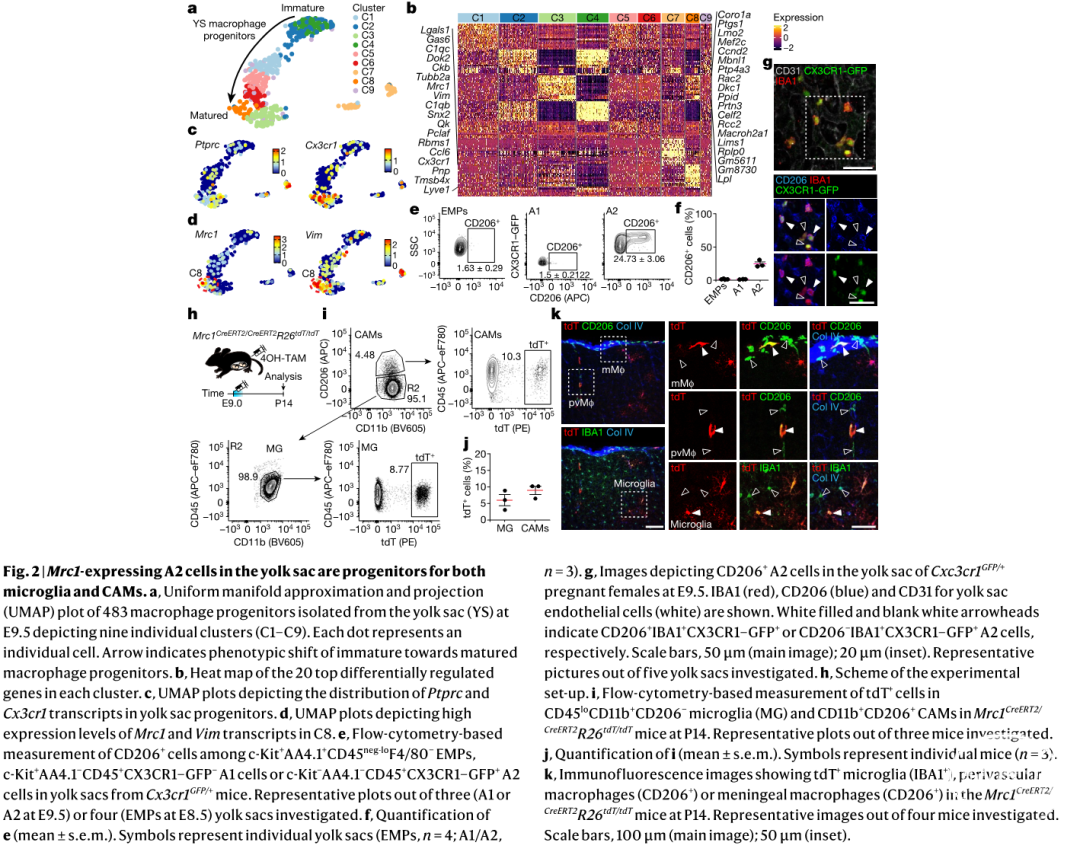
一、卵黄囊中表达Mrc1的A2祖细胞是小胶质细胞和CAMs的祖细胞
卵黄囊(yolk sac)是发育中的胚胎中第一个被检测到并包含在妊娠囊内的结构。妊娠囊是一个充满液体的囊,在子宫内发育并包围胚胎和卵黄囊。为了观察发育过程中CAMs和小胶质细胞的区域分布,作者首先利用Cx3cr1GFP/+转基因小鼠,分别观察不同时间点(胚胎时期E12.5, E14.5和出生后P3, P10, P21, P56),不同区域(脑实质、血管周围室和脑膜)的巨噬细胞。实验结果显示在不同时间点,不同种类的中枢巨噬细胞分布不同,这预示着它们可能由不同祖细胞发育而来;其次利用单细胞RNA测序(single-cell RNA sequencing,scRNA-seq),作者发现在A2前体巨噬细胞群体中有一个独特的Mrc1 (CD206)+亚群;进而作者构建Mrc1CreERT2转基因小鼠用于研究CAMs起源,虽然已有研究指出小胶质细胞和CAMs均起源于早期卵黄囊祖细胞2。然而,它们是否起源于一个共同的前体细胞,或者卵黄囊中是否已经存在不同的前体细胞依旧不清楚。为了解决这个问题,作者采用scRNA-seq技术分析卵黄囊中的髓系祖细胞谱系(c-Kitlo CD45+),并结合Mrc1CreERT2/CreERT2 R26tdT/tdT转基因小鼠进行谱系示踪,发现CAMs和小胶质细胞有一个共同的Mrc+卵黄囊前体细胞,在出生后的早期阶段逐渐分化并区分开来,且CAMs随着大脑发育的成熟而逐渐的特征化,分化为不同的亚群。
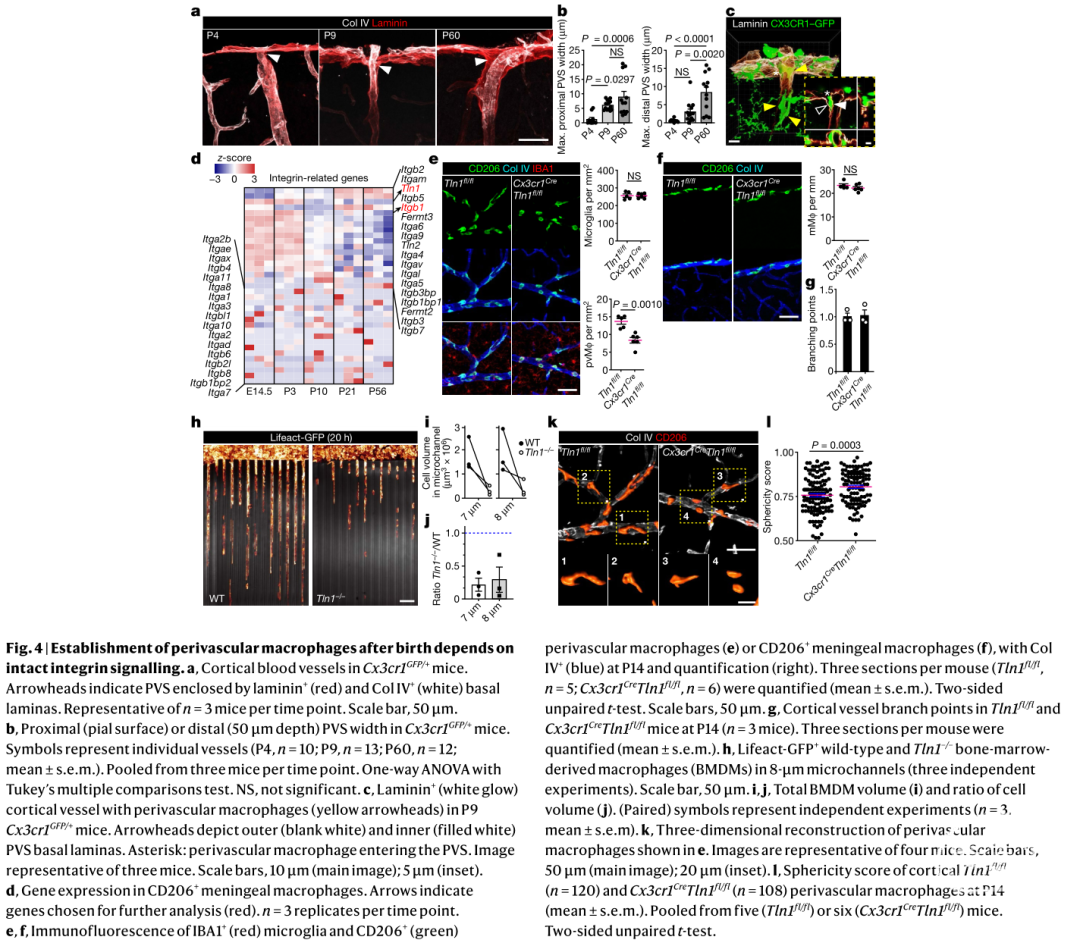
二、血管巨噬细胞生态位的占据依赖于整合素信号
中枢神经系统依靠复杂的血管网络滋养生息,其中包括动脉、小动脉、毛细血管、静脉和小静脉5,作者通过共标GFP+ 和CD206+细胞的方法,发现血管周围巨噬细胞呈区域特异性分布,其中大部分巨噬细胞分布在动脉和小动脉周围,少数巨噬细胞分布在静脉和小静脉;而毛细血管周围几乎没有巨噬细胞存在,对于人类胎儿发育过程,也是如此。由此可见,在出生后的小鼠和人类皮层中,血管周围巨噬细胞优先定位于动脉和小动脉的血管周围。
作者使用高分辨率共聚焦和电子显微镜,观察到血管巨噬细胞随着胚胎的发育而逐渐迁移到血管周围生态位,随后细胞数量的不断增加。黏附受体(如整合素)与细胞外环境的相互作用可以介导细胞有序的运动6。为了探讨巨噬细胞生态位占据的分子机制,作者观察了P3时期血管周围巨噬细胞发育,其特点是Tln1(Talin-1)和整合素亚基β 1(Itgb1)等基因的高表达。Talin-1是一种胞质接头蛋白,控制整合素介导的信号通路的激活7。一方面作者使用Cx3cr1Cre/+ Tln1fl/fl转基因小鼠,观察到Tln1缺陷的巨噬细胞形态发生变化,相比于对照组变得更圆,且巨噬细胞在向与血管周围空间直径相似的体外微通道迁移时受损。另一方面,作者使用VavCre/+ Itgb1fl/fl转基因小鼠(所有造血细胞缺乏Itgb1),观察到血管周围巨噬细胞、小胶质细胞和脑膜巨噬细胞数量的变化,细胞的迁移能力并不受影响。总的来说,这些结果表明血管周围巨噬细胞在发育中生态位的占据依赖于整合素信号。
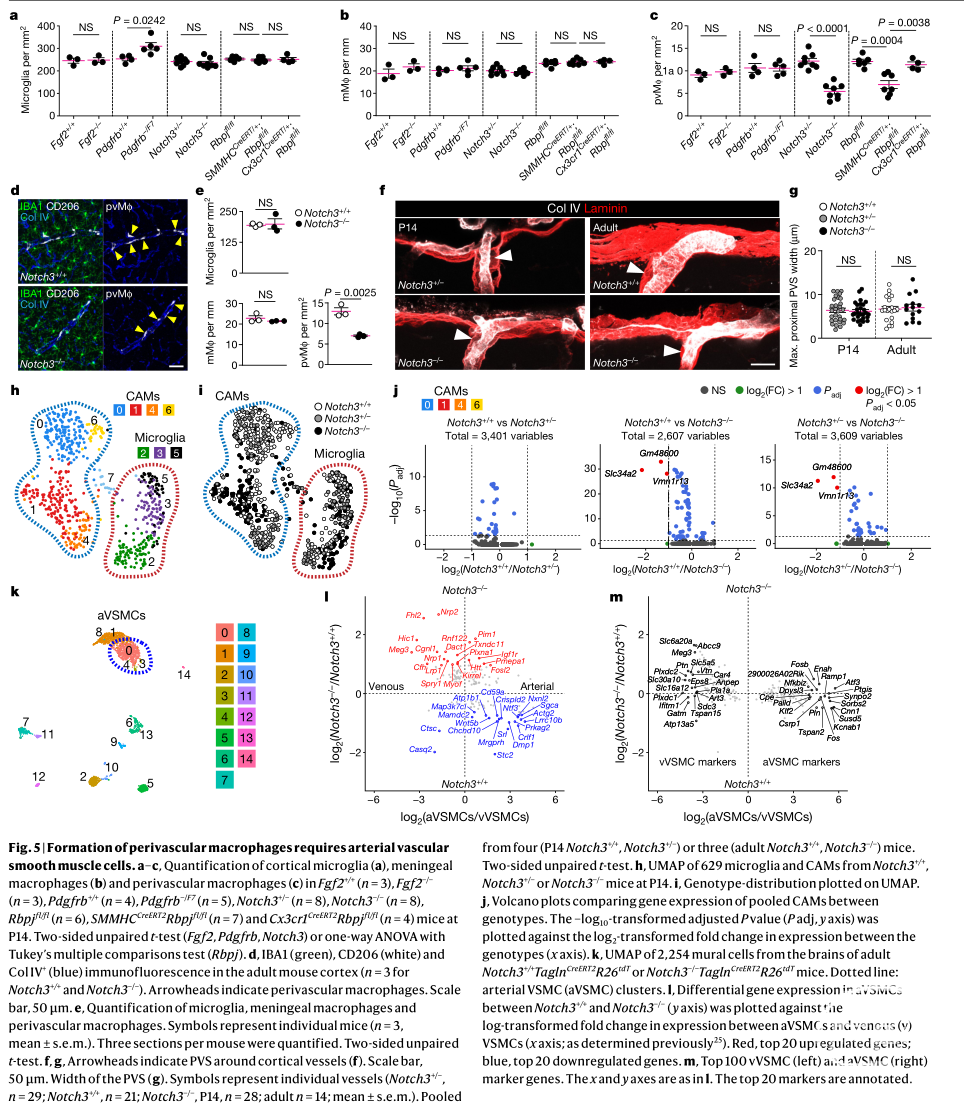
三、血管周围巨噬细胞的形成需要动脉血管平滑肌细胞的作用
大脑的脉管系统是一个复杂的结构,由多种细胞类型组成,包括内皮细胞、星形胶质细胞和壁细胞(如周细胞或血管平滑肌细胞)8。由于血管周围巨噬细胞主要分布在含有平滑肌细胞的动脉和小动脉的间隙,动脉平滑肌细胞在确定血管周围巨噬细胞的合理分布方面具有一定的功能作用9。
为了检测在发育过程中哪些细胞类型有助于血管周围巨噬细胞的生长,首先作者使用成纤维生长因子(fibroblast growth factor 2, Fgf2)敲除转基因小鼠(Fgf2−/−)(Fagf2-/-小鼠在产后早期阶段,阻断了星形胶质细胞的分化),发现在P14 Fagf2-/-小鼠大脑中的血管周围巨噬细胞、小胶质细胞和脑膜巨噬细胞的数量及分布不受到影响;其次,作者使用血小板源性生长因子受体β突变小鼠(Pdgfrb-/F7)(Pdgfrb-/F7小鼠引起周细胞生长缺陷),结果显示Pdgfrb-/F7小鼠大脑中仅小胶质细胞的密度有所增加,其他细胞均无影响;然后作者使用携带Rbpj基因(免疫球蛋白kappa J区(RBPJ)是Notch通路的主要下游转录因子)floxed转基因小鼠研究Notch信号的细胞类型特异性作用,包括SMMHCCreERT2::Rbpj fl/fl 转基因小鼠(血管平滑肌细胞特异性敲除Rbpj信号分子)和Cx3cr1CreERT2::Rbpjfl/fl转基因小鼠(小胶质细胞特异性的敲除Rbpj信号分子),实验结果均显示血管周围巨噬细胞数量减少,而其他细胞不受影响。观察到notch3信号对细胞数量的影响,作者于是继续探究哪些notch3相关信号调节了血管周围巨噬细胞的形成,实验结果显示Notch3信号影响管平滑肌细胞中的功能,而血管平滑肌细胞中的功能对于血管周围巨噬细胞的建立是必需的,因此血管周围巨噬细胞的形成需要动脉血管平滑肌细胞的作用,且与Notch3信号途径有关。
总结
本文,作者使用谱系追踪系统、单细胞图谱和细胞特异性突变技术,发现只有脑膜巨噬细胞和小胶质细胞有一个共同的产前前体细胞。相反,血管周围巨噬细胞仅在出生后以整合素依赖性的方式起源于妊娠期脑膜巨噬前体细胞。血管周围巨噬细胞的形成需要动脉血管平滑肌细胞的协助。总之,本文揭示了中枢神经系统中巨噬细胞亚群建立的精确的时间过程和发育过程。

点评
本文揭示了CAMs亚群的个体发生轨迹、区域分布、动力学和基因表达谱,以及细胞间通信关键分子机制。但由于CAMs在中枢神经系统发育、稳定状态和在疾病中的行为和功能仍然不明确,因此,此项研究开发了Mrc1的小鼠工具,专门针对CAMs开展研究,这将有助于阐明CAMs的更多生物学功能。此项研究为更好地理解中枢神经系统CAMs的发展和与CAMs是相关疾病的治疗开辟新的途径。
文献PMID:
35444273
文献DOI:
10.1038/s41586-022-04596-2
Abstract:
All tissue-resident macrophages of the central nervous system (CNS)—including parenchymal microglia, as well as CNS-associated macrophages (CAMs) such as meningeal and perivascular macrophages—are part of the CNS endogenous innate immune system that acts as the first line of defence during infections or trauma. It has been suggested that microglia and all subsets of CAMs are derived from prenatal cellular sources in the yolk sac that were defined as early erythromyeloid progenitors. However, the precise ontogenetic relationships, the underlying transcriptional programs and the molecular signals that drive the development of distinct CAM subsets in situ are poorly understood. Here we show, using fate-mapping systems, single-cell profiling and cell-specific mutants, that only meningeal macrophages and microglia share a common prenatal progenitor. By contrast, perivascular macrophages originate from perinatal meningeal macrophages only after birth in an integrin-dependent manner. The establishment of perivascular macrophages critically requires the presence of arterial vascular smooth muscle cells. Together, our data reveal a precisely timed process in distinct anatomical niches for the establishment of macrophage subsets in the CNS.
参考文献:
1. Kierdorf, K., Masuda, T., Jordão, M. J. C. & Prinz, M. Macrophages at CNS interfaces: ontogeny and function in health and disease. Nature reviews. Neuroscience 20, 547–562 (2019).
2. Goldmann, T. et al. Origin, fate and dynamics of macrophages at central nervous system interfaces. Nature immunology 17, 797–805 (2016).
3. Kierdorf, K. et al. Microglia emerge from erythromyeloid precursors via Pu.1- and Irf8-dependent pathways. Nature neuroscience 16, 273–80 (2013).
4. Hoeffel, G. et al. C-Myb(+) erythro-myeloid progenitor-derived fetal monocytes give rise to adult tissue-resident macrophages. Immunity 42, 665–78 (2015).
5. Zhao, Z., Nelson, A. R., Betsholtz, C. & Zlokovic, B. V. Establishment and Dysfunction of the Blood-Brain Barrier. Cell 163, 1064–1078 (2015).
6. Michael, M. & Parsons, M. New perspectives on integrin-dependent adhesions. Current opinion in cell biology 63, 31–37 (2020).
7. Calderwood, D. A., Campbell, I. D. & Critchley, D. R. Talins and kindlins: partners in integrin-mediated adhesion. Nature reviews. Molecular cell biology 14, 503–17 (2013).
8. Mastorakos, P. & McGavern, D. The anatomy and immunology of vasculature in the central nervous system. Science immunology 4, (2019).
9. Daneman, R., Zhou, L., Kebede, A. A. & Barres, B. A. Pericytes are required for blood-brain barrier integrity during embryogenesis. Nature 468, 562–6 (2010).

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享




