作者:蝴蝶 北京大学博士后
阿尔茨海默病(Alzheimer’s disease, AD)是一种常见的进行性神经退行性疾病,其发病率随年龄增长逐渐上升。AD是导致痴呆的主要原因,并正迅速成为本世纪最昂贵、最致命和负担最重的疾病之一[1],已成为威胁人类,尤其是老年人健康的一个主要病症。AD的特征是神经元的丢失和错误折叠蛋白的积累[2],淀粉样蛋白-β寡聚体的形成可能导致AD发病,触发tau神经纤维缠结和氧化应激的级联反应[3]。尽管有大量关于错误折叠蛋白形成的机制,但AD细胞层面功能异常的核心机制,目前还不清楚。
体细胞突变发生在健康的人类组织中,包括有丝分裂后的神经元在衰老过程中累积突变,被称为基因组衰老(genosenium)。对体细胞突变特征的分析可以确定致病因素,比如阳光下紫外线照射导致的癌症,烟草相关的多环芳烃在肺癌中的作用等。在人类神经元中,突变特征分析显示,体细胞单核苷酸变异(somatic single-nucleotide variants, sSNVs)由多种诱因引起,如DNA核苷酸氧化[4]。AD患者氧化应激增加、核苷酸受损,但这些受损的核苷酸在多大程度上能被DNA修复过程消除,以及是否会导致持久的DNA突变,对基因组结构或转录产生永久性影响,目前尚不清楚。
2022年4月20日,波士顿儿童医院Michael A. Lodato课题组、Eunjung Alice Lee课题组和Christopher A. Walsh课题组合作在Nature杂志发表提为“Somatic genomic changes in single Alzheimer’s disease neurons”的研究成果,分析来自AD患者和正常对照组319个神经元的单细胞全基因组测序(scWGS)数据,比较了与AD相关的体细胞突变的数量、基因组位置和种类。

研究人员首先分别从受AD疾病影响最关键的两个脑区——海马和前额叶皮层(prefrontal cortex, PFC),分离出锥体神经元,进行单细胞全基因组测序(single-cell whole-genome sequencing, scWGS)。作者发现,与对照个体相比,AD患者的海马CA1和PFC明显sSNVs累积增加。作者观察到8例AD患者中有7例的sSNVs显著增加,AD患者中sSNV计数最高的几个基因组来自于海马。该结果表明,AD患者的神经元包含了数百个额外的sSNVs,已经远超出自然衰老过程的累积,AD疾病过程产生的基因组损伤水平,相当于超过十年正常的sSNVs累积。

图1. 单细胞全基因组测序(scWGS)实验流程图[5]
作者进一步检测单个神经元核苷酸氧化损伤程度,免疫荧光结果显示,AD患者神经元的细胞氧化状态和DNA损伤的生物标志物——8-氧鸟嘌呤(8-oxoguanine, 8-oxoG),显著高于正常对照组,表明AD患者神经元氧化损伤。结合突变特征分析,说明AD患者神经元活性氧增加、DNA氧化损伤可能是sSNVs过量累积的原因。GO分析也发现,AD患者中参与神经元功能的基因富含sSNVs。
体细胞突变或单链损伤可通过多种机制导致神经元功能障碍或缺失,包括转录直接损伤、蛋白质稳定性的改变,或新抗原的产生。在蛋白编码基因中,AD神经元比对照组具有更多的非同义突变,可能损害敏感基因,或产生新抗原,从而引发T淋巴细胞活化、免疫攻击和随后的细胞损伤,进而引起神经元功能障碍。并且,随着体细胞突变的累积,同一基因中外显子突变导致神经元功能失调的可能性呈指数增长。此外,DNA修复中的多重缺陷会导致神经元功能障碍和退化,这一发现也强调了基因组损伤的显著影响。
总之,研究人员发现AD患者脑内兴奋性神经元积累的基因组损伤,包括单链DNA损伤和双链突变,其水平远超过衰老本身造成的影响。该研究阐明AD患者体细胞单核苷酸变异的特征,未来将进一步揭示DNA损伤和突变,以及其他类型的体细胞改变,如结构变异、逆转录等,对AD的影响,为AD发病机制研究和早期干预提供了新线索和新思路。
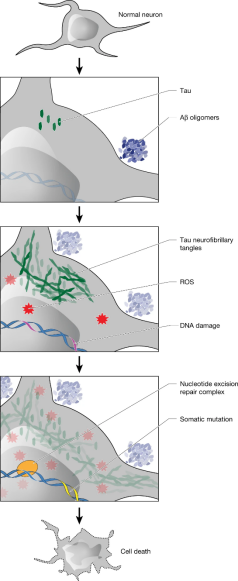
图2. 体细胞突变对AD发病的作用模型图[5]
文章链接:
https://www.nature.com/articles/s41586-022-04640-1
参考文献:
[1] Scheltens, P. et al. Alzheimer's disease. Lancet (London, England) 397, 1577-1590, doi:10.1016/s0140-6736(20)32205-4 (2021).
[2]Hyman, B. T. et al. National Institute on Aging-Alzheimer's Association guidelines for the neuropathologic assessment of Alzheimer's disease. Alzheimer's & dementia : the journal of the Alzheimer's Association 8, 1-13, doi:10.1016/j.jalz.2011.10.007 (2012).
[3]Selkoe, D. J. & Hardy, J. The amyloid hypothesis of Alzheimer's disease at 25 years. EMBO molecular medicine 8, 595-608, doi:10.15252/emmm.201606210 (2016).
[4]Lodato, M. A. et al. Aging and neurodegeneration are associated with increased mutations in single human neurons. Science (New York, N.Y.) 359, 555-559, doi:10.1126/science.aao4426 (2018).
[5]Miller, M. B. et al. Somatic genomic changes in single Alzheimer's disease neurons. Nature 604, 714-722, doi:10.1038/s41586-022-04640-1 (2022).

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享




