
病例概述
接诊一例来自江西的4岁男性患儿(身高:110cm,体重:18.0kg),主诉:走路不稳20余天,头痛、呕吐12天,进行性加重。我院急诊头颅CT示:后颅窝占位,团块状稍高密度影含散在钙化,梗阻性脑积水伴室旁水肿。鉴于患儿病情危重,急行右侧脑室-腹腔分流术缓解颅压, 术后患儿状态明显改善,查体:神清语利,自主体位,生长发育正常,神经系统查体阴性;行头颅MRI检查示:第四脑室占位,伴出血坏死灶、囊性变,髓母细胞瘤?室管膜瘤?(图1)。

图1 头颅CT示:后颅窝占位,团块状稍高密度影含散在钙化,梗阻性脑积水伴室旁水肿;头部MRI示:第四脑室占位,伴出血坏死灶、囊性变,髓母细胞瘤?室管膜瘤?
患儿后颅窝占位,手术指征明确,根据影像特征(稍高密度、散在钙化),首先考虑髓母细胞瘤,完善术前检查,于2021年10月22日脑干功能监测下行后正中开颅肿瘤切除术。术中见肿瘤位于四脑室内,色灰红、质软、烂鱼肉样,瘤内见出血坏死灶,血供丰富,大小约3.5X4.5X5.5mm,瘤体与小脑蚓部边界欠清,与双侧小脑半球粘连紧密,脑干背侧与肿瘤腹侧存在光滑界面,仅右侧桥臂部分粘连,肿瘤整体摘除,导水管下口开放良好,手术顺利,术中出血约200ml,输注红细胞一单位,血浆100ml,术毕安返ICU监护(图2)。

图2 A. 瘤体与小脑蚓部边界欠清,与双侧小脑半球粘连紧密。B. 肿瘤色灰红、质软、烂鱼肉样,瘤内见出血坏死灶,血供丰富。C. 肿瘤整体摘除,导水管下口开放,脑干保护完好。

图3 术后当晚头颅CT及术后一周头颅MRI显示肿瘤切除满意。
术后患儿状态好,神清语利、正确对答、遵嘱活动,未见新增神经系统阳性体征。术后当晚CT及术后一周MRI均显示肿瘤切除满意(图3)。病理回报示:胚胎性肿瘤,可见灶片状分布的原始神经上皮细胞、中间分化的神经细胞及分化较成熟的节细胞,伴神经毡形成,符合节细胞神经母细胞瘤(WHO Ⅳ级);免疫组化:GFAP(+),Olig-2(散在少量+),Ki-67(局部50%),EMA(偶+),L1CAM(神经毡+),H3K27me3(部分+),Syn(+),Fli-1(散在少量+),CD99(±),NeuN(散在+),INI-1(+),BRG-1(+),LIN28(-);基因检测:50种基因编码区功能性变异,两个基因突变频率最高(SLC18B1突变频率45.3%,SMARCA4突变频率40.1%)。术后恢复好,KPS评分:90分,术后三周顺利出院,继续后续治疗。
治疗体会
本例影像学提示后颅窝占位,稍高密度团块影、内含散在钙化,应该是典型髓母细胞瘤表现,最终病理回报节细胞神经母细胞瘤,确实出人意料。
中枢神经系统节细胞神经母细胞瘤(CNS ganglioneuroblastoma)属罕见胚胎性肿瘤,由分化成熟的肿瘤性神经节细胞和原始神经母细胞组成,具有良性神经节神经瘤和恶性神经母细胞瘤的双重特征[1]。旧版CNS肿瘤分类中(2016,WHO),胚胎性肿瘤包括髓母细胞瘤、胚胎性肿瘤伴多层菊形团(C19MC、NOS )、髓上皮瘤、CNS神经母细胞瘤、CNS节细胞神经母细胞瘤、CNS胚胎性肿瘤NOS、AT/RT、CNS胚胎性肿瘤伴横纹肌样特征[2](注:胚胎性肿瘤依据组织病理特征许多应归为原始神经外胚层肿瘤(PNET),该命名2016版予以取消)。新版CNS肿瘤分类(2021,WHO)强调了分子变异在肿瘤分类中的重要性。由于CNS节细胞神经母细胞瘤极为罕见,目前未发现特有的分子特征,因此归为其它类型CNS胚胎性肿瘤中的CNS胚胎性肿瘤[3]。
表1 1968年至今公开报道的9例节细胞神经母细胞瘤汇总[1, 6-13]
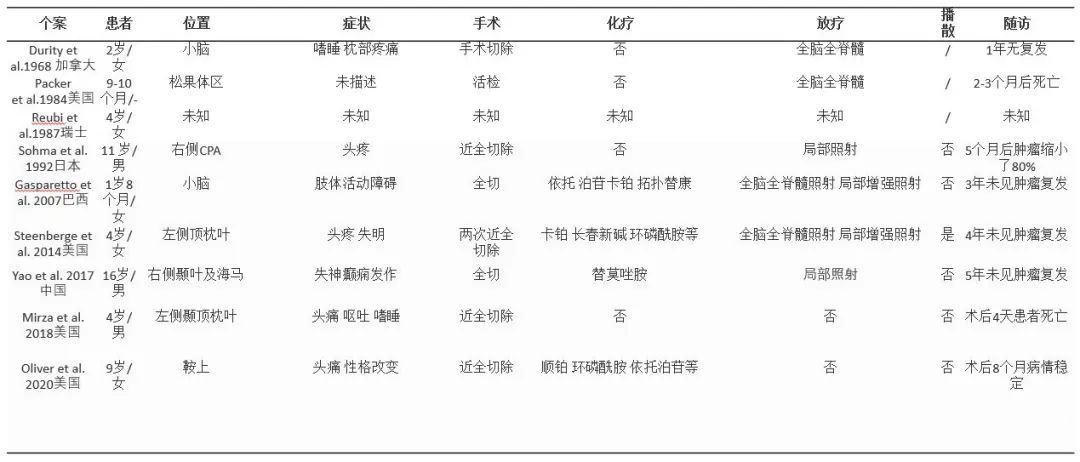
节细胞神经母细胞瘤分为中枢性和外周性[4],90%发生在儿童,后者可涉及纵隔、腹膜后及肾上腺[5],但前者预后更差[6]。CNS节细胞神经母细胞瘤极为罕见,1968年至今全球公开报道仅9例(表1),临床特点是起病急、病程短、进展快、婴幼儿预后差,年龄、手术切除程度、放化疗是否及时是影响预后的直接相关因素。因此,对于儿童及青少年,在保证安全的前提下全切肿瘤,术后尽早综合治疗,对改善预后帮助极大。我科今年收治两例节细胞神经母细胞瘤(本例及病例分享21,年龄分别为4岁及11岁),手术顺利,肿瘤全切,术后恢复好并迅速转入放化疗,目前为止,疗效满意。
本例基因检测提示SLC18B1、SMARCA4突变频率高:SLC18B1是囊状氨类转运蛋白家族中最新发现的基因,予以敲除可抑制肥大细胞分泌[14];SMARCA4突变在肺小细胞癌、胸部肉瘤、子宫肉瘤等多有报道[15-17]。二者在节细胞神经母细胞瘤中是否是关键基因,相关分子机制值得进一步研究。
参考文献





