病史简介
患者,女,34岁,因“头晕头痛1周,伴恶心呕吐1天,”入院。
患者一星期前无明显诱因下出现头晕头痛,呈钝痛,伴乏力,无恶心呕吐,无视物模糊,无肢体抽搐。1天前上述症状加重,伴恶心呕吐,呕吐物为内容物。遂前往当地医院就诊,头颅CT提示:左侧脑室后角区占位。建议上级医院就诊。患者及家属为求进一步治疗来我院,急诊拟“颅内占位性病变”收入住院。我院头颅磁共振提示:左侧脑室后角区不均匀长T1、长T2信号影,最大截面约54mm*38mm,内见多发混杂信号影,增强扫描呈花环样强化,强化较明显,呈不均匀强化,部分信号较低,边缘较清晰,左侧脑室受压、扩张,中线右移。左侧脑室后角区占位,首先考虑胶质瘤(图1)。
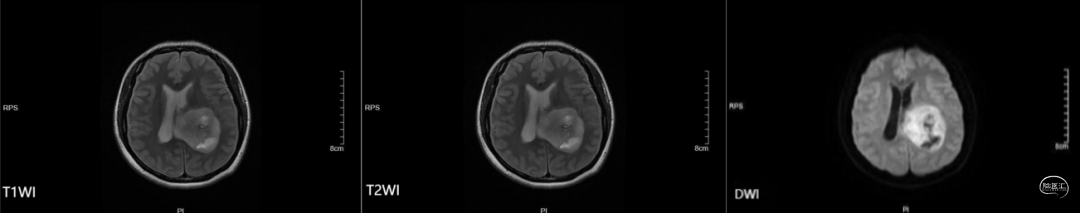
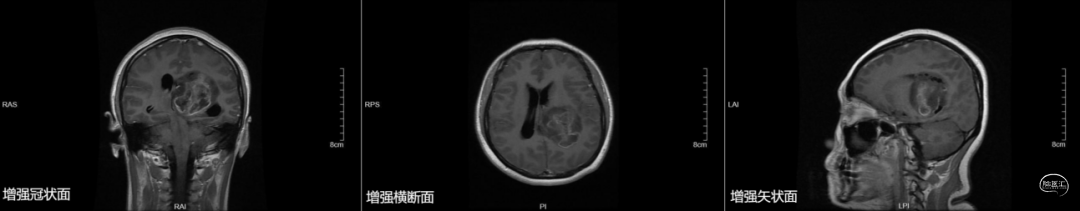
图1. 术前MRI,左侧脑室后角区不均匀长T1、长T2信号影,增强扫描呈花环样强化,强化较明显,呈不均匀强化,左侧脑室受压、扩张,中线右移。
入院后完善相关检查,行脑干病损切除术。皮层下约2cm可见肿瘤,灰色样,质地软,边界不清,血供丰富,先在瘤内切除肿瘤减压,后探查肿瘤边界,肿瘤主要位于侧脑室后角区,部分肿瘤累及丘脑,后沿肿瘤边界小心分离肿瘤与脑组织,最后全切肿瘤。病理诊断
组织学:肿瘤细胞弥漫浸润性生长,细胞密度较高,多形性,细胞胞浆丰富,核透亮,核分裂12个/10HPF,可见灶性肿瘤坏死,未见明确微血管增生(图2)。
免疫组化化学染色:GFAP +,Nestin +,Olig-2 +,NF 见阳性纤维,Syn +,NeuN -,IDH1(H09) -,ATRX存在,BRAF(VE1) -,CD34 血管+,H3 K27M +,H3K27me3 缺失,Ki-67 55%,P53 +(图3)。
分子检测结果:IDH1/2基因 野生型,TERT基因启动子野生型,H3F3A K27M突变,HIST1H3B基因 野生型。
最终诊断:弥漫中线胶质瘤,H3 K27M突变型,CNS WHO 4级。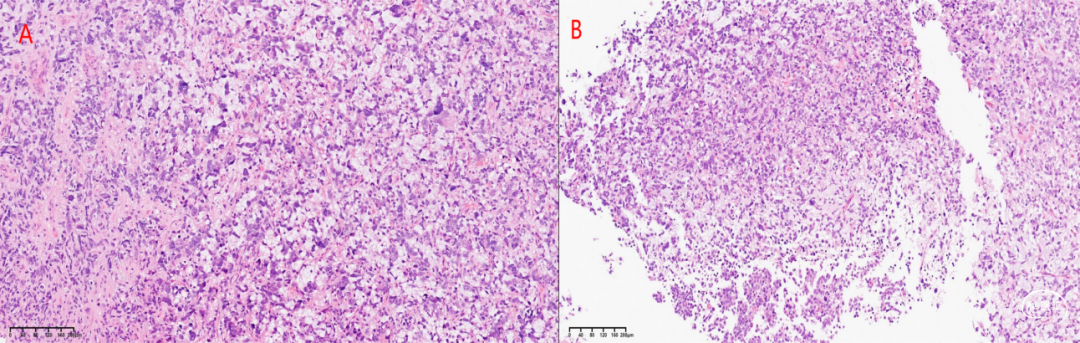
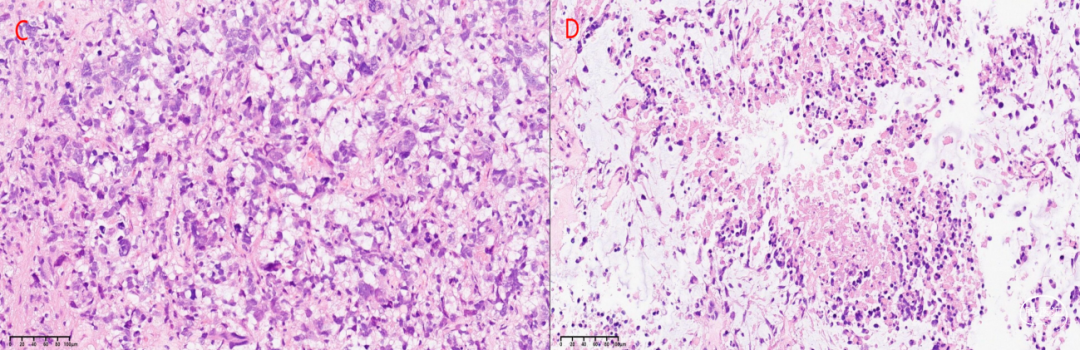
图2. 低倍镜下,肿瘤呈浸润性生长,细胞密度较高(A,B),高倍镜下肿瘤细胞细胞核多形性,胞浆丰富,核透亮,核分裂易见(C),局灶可见肿瘤坏死(D)。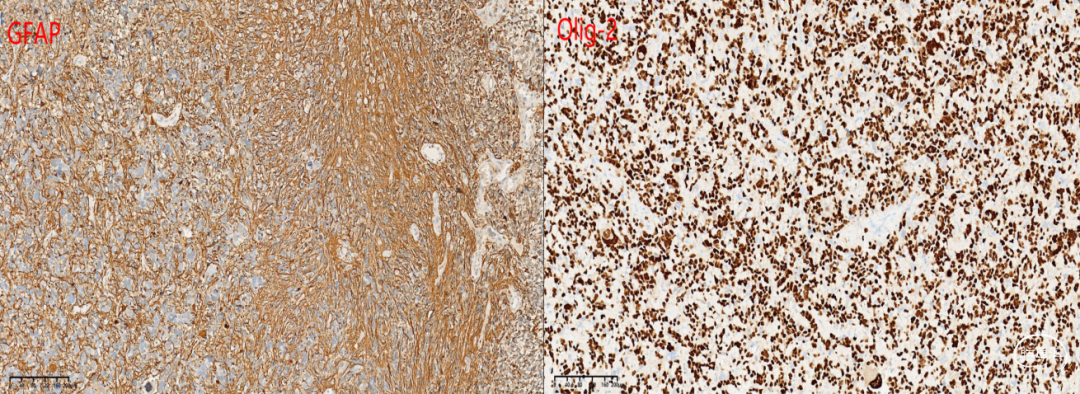
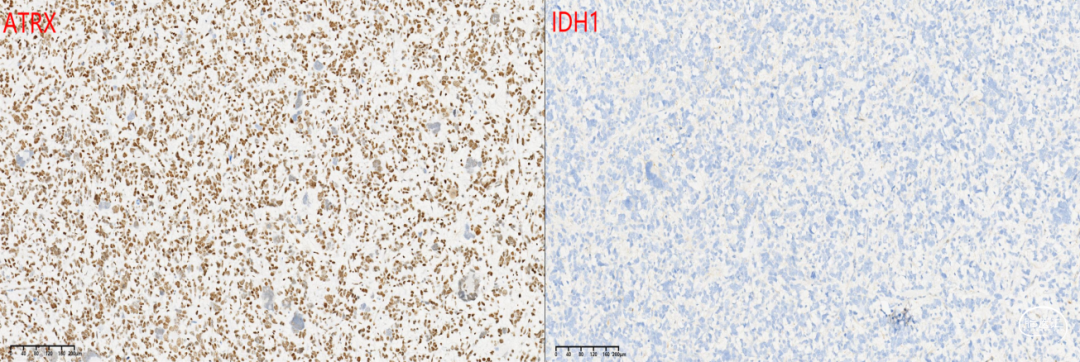
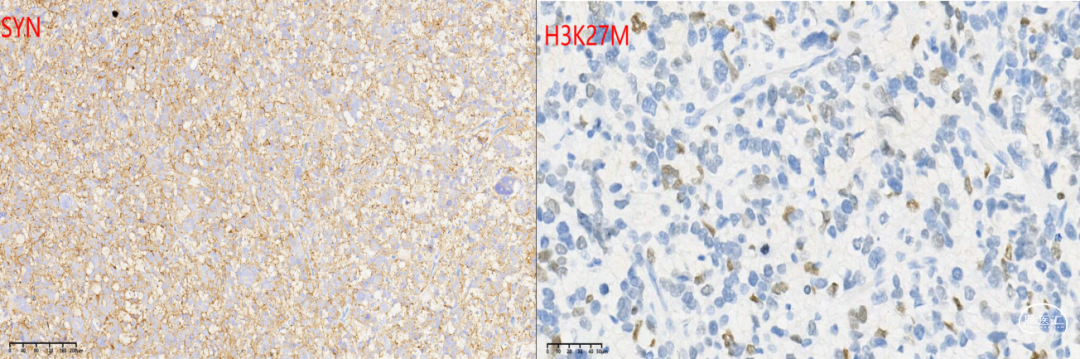
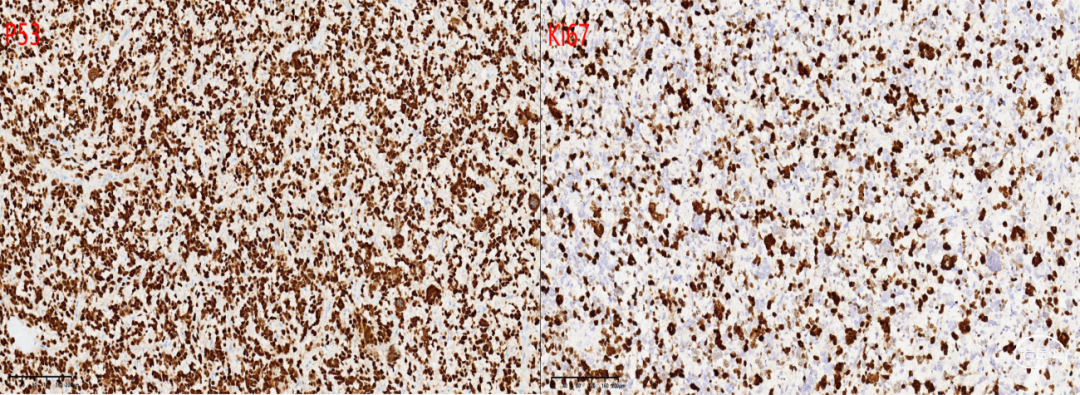
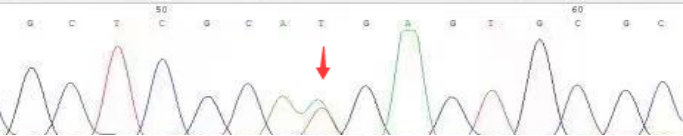
图3. 免疫组化结果:肿瘤细胞表达GFAP核Olig-2,ATRX存在,IDH1阴性,SYN阳性,H3K27M散在阳性,P53弥漫阳性,KI-67 高达55%;Sanger测序显示H3F3A K27M突变。讨论
弥漫性中线胶质瘤(diffuse midline glioma,DMG),H3 K27M突变型,是依据特定的分子改变H3 K27M,及在中线弥漫性生长,而不仅仅根据形态学特征诊断的WHO 4级胶质瘤[1]。由于此肿瘤除了在组蛋白编码基因H3F3A、HIST1H3B和HIST1H3C出现K27M突变外,还可有K27I突变;及无K27位点突变,而出现EZHIP过表达,因此第五版CNS WHO将其改名为弥漫性中线胶质瘤(DMG),H3 K27改变型。它是一种预后较差的恶性肿瘤,目前2年生存率<10%。儿童DMG主要位于脑干或脑桥(后者也称为弥漫性内源性脑桥胶质瘤),或双侧丘脑,而青少年和成人的DMG主要位于单侧丘脑或脊髓。其他中线部位,如松果体区、下丘脑和小脑罕见。该肿瘤MRI上通常呈不对称肿块,可包裹基底动脉或突出到第四脑室,延伸到小脑、中脑。T1通常呈低信号或等信号,T2呈高信号,但FLAIR序列和增强扫描模式可有很大差异,可仅表现为点状强化,也可表现为大片状明显强化,而不少肿瘤无强化。患者的临床症状取决于肿瘤的大小和浸润程度,患者通常表现为脑积水、吞咽困难、言语不清、颅神经病变和头痛等。
该类胶质瘤有组蛋白H3 c.83A>T p.K28M(K27M)突变,或EZHIP过表达或EGFR突变,同时伴H3 P.K28me3(K27me3)缺失。组蛋白H3在弥漫性中线胶质瘤的发生中起着重要作用,其变异影响染色质变化和基因表达谱,激活特定基因的转录和翻译。K27在组蛋白H3中是一个关键残基,也是翻译后组蛋白修饰的对象,它可以同时甲基化和乙酰化,其甲基化则与染色质和基因表达的抑制性标志物有关,而乙酰化可诱导转录活性。H3F3A K27M突变导致组蛋白修饰即H3 K27的三甲基化(H3K27me3)发生异常,促使H3K27me3表达含量明显减少,表明H3 K27M突变可引起H3低甲基化,从而干扰染色质功能,促进肿瘤的发生。因此可以联合检测H3 K27M和H3 K27me3表达,来辅助诊断弥漫性中线胶质瘤,但H3 K27me3抗体本身并不特异,在一些间变性室管膜瘤和恶性外周神经鞘膜瘤,也可以观察到H3K27me3的表达缺失[2-3]。值得一提的是H3 p.K28(K27)突变也可发生在其他脑肿瘤,如室管膜瘤、毛细胞型星形细胞瘤和神经节神经胶质瘤[4-7],但其突变频率较低并且与预后的关系目前尚不清楚。
DMG是基于分子生物学改变的依据而诊断的肿瘤。组织学上,H3 K27突变的弥漫中线胶质瘤具有广泛的形态学表现,细胞通常较小呈单形性,也可呈多形性,可有星型细胞样、少突胶质细胞样、巨细胞样、未分化细胞及上皮样细胞等分化形态。在多数病例中可见核分裂像,也可见微血管增生和坏死,但这些并不是诊断所必要的,也不是独立的生存预测因子。在EGFR突变型DMG中,经常出现有丝分裂活性,但坏死或微血管增生罕见。所以即使没有核分裂象、微血管增生和坏死,也是4级胶质瘤。在免疫表型上,肿瘤细胞通常表达Olig2、MAP2和S-100蛋白,GFAP的表达不恒定。EGFR突变亚型通常表达GFAP,但Olig2和SOX10可阴性。突触素SYN可以有局灶性表达,NeuN在少数有神经元分化的细胞表达。虽然H3 p.K28I(K27I)突变或EZHIP过表达的弥漫中线胶质瘤未观察到H3 p.K28M(K27M)染色,但这些病例可以通过细胞核H3 p.K28me3(K27me3)免疫染色缺失来识别,需要通过分子分析进一步评估。大约50%的病例显示p53阳性,15%的病例显示ATRX表达缺失。
DMG预后差,2年生存率<10%。由于肿瘤的位置,手术选择有限。H3.1或H3.2 p.K28M(K27M)突变或EZHIP过表达的DMGs患者的总生存期(16个月)比H3.3 p.K28M(K27M)突变的DMGs患者(11个月)稍长。年龄(<3岁或>10岁)、较长的症状潜伏期(>24周)和诊断时的系统性治疗是较长的生存的预测因素。TP53突变已被证明与放疗耐受相关。EGFR突变的儿童双侧丘脑胶质瘤的中位生存期为10-14个月,大多数儿童在2年内死于这种疾病。参考文献
1. Louis DN, et al. The 2016 world health organization classification of tumors of the V600E mutations in paediatric midline grade I ganglioglioma. Brain Pathol 28:103–111.
2. Capper D, et al. DNA methylation-based classification of central nervous system tumours. Nature. 2018;555:469–474. doi: 10.1038/nature26000.
3. Enomoto T., Aoki M., Hamasaki M., Abe H., Nonaka M., Inoue T., Nabeshima K. Midline Glioma in Adults: Clinicopathological, Genetic, and Epigenetic Analysis. Neurol. Med.-Chir. 2020;60:136–146. doi: 10.2176/nmc.oa.2019-0168.
4. Pratt D, Natarajan SK, Banda A, Giannini C, Vats P, Koschmann C, Mody R, Chinnaiyan A, Venneti S (2018) Circumscribed/non-diffuse histology confers a better prognosis in H3K27M-mutant gliomas. Acta Neuropathol 135:299–301.
5. Bayliss J, Mukherjee P, Lu C, Jain SU, Chung C, Martinez D, Sabari B, Margol AS, Panwalkar P, Parolia A et al (2016) Lowered H3K27me3 and DNA hypomethylation define poorly prognostic pediatric posterior fossa ependymomas. Sci Transl Med 8:366ra161.
6. Bechet D, Gielen GG, Korshunov A, Pfister SM, Rousso C, Faury D, Fiset PO, Benlimane N, Lewis PW, Lu C et al (2014) Specific detection of methionine 27 mutation in histone 3 variants (H3K27M) in fixed tissue from high-grade astrocytomas. Acta Neuropathol 128:733–741.
7. Sturm D, et al. Hotspot mutations in H3F3A and IDH1 define distinct epigenetic and biological subgroups of glioblastoma. Cancer Cell. 2012;22:425–437. doi: 10.1016/j.ccr.2012.08.024.
(本文由浙二神外周刊原创,浙江大学医学院附属第二医院病理科刘子瑜主治医师整理,许晶虹副主任医师审校,张建民主任终审。)
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。














