引用本文:中华医学会神经外科学分会脑血管病学组, 中国医师协会神经外科医师分会脑血管外科学组. 原发性脑干出血诊治中国神经外科专家共识 [J] . 中华医学杂志, 2022, 102(15) : 1068-1075. DOI: 10.3760/cma.j.cn112137-20211228-02913.
通信作者:张建民,浙江大学医学院附属第二医院神经外科,杭州310009,Email:zjm135@zju.edu.cn;康德智,福建医科大学附属第一医院神经外科,福州350005,Email:kdz99988@sina.com.
原发性脑干出血(PBSH)是脑出血最致命的亚型,起病急骤,致残、致死率极高,对现存治疗手段构成挑战。由于缺乏相关循证医学研究,国内外均没有相关的专家共识和指南。本文汇聚国内医学会和医师协会两大脑血管外科学组专家及所在单位的经验,达成以下中国专家共识。从危险因素、流行病学、发病机制、诊断与评估、治疗、预后、预防和干预等角度展开,并对不同治疗手段进行了分类阐述,旨在为大家对PBSH提供临床诊治参考和建议。
原发性脑干出血(PBSH)是脑出血最致命的亚型,起病急骤,致残、致死率极高,对现存治疗手段构成挑战。由于缺乏相关循证医学研究,国内外均没有相关的专家共识和指南。本文汇聚国内医学会和医师协会两大脑血管外科学组专家及所在单位的经验,达成以下中国专家共识。从危险因素、流行病学、发病机制、诊断与评估、治疗、预后、预防和干预等角度展开,并对不同治疗手段进行了分类阐述,旨在为大家对PBSH提供临床诊治参考和建议。
原发性脑干出血(primary brainstem hemorrhage,PBSH)是指排除了外伤、血管畸形、肿瘤等可溯源继发性因素的自发性脑干出血。在无法溯源的PBSH中,多数伴发高血压病,在国内常称为高血压性脑干出血(hypertensive brainstem hemorrhage,HBSH),是高血压脑出血的最致命亚型。血肿通过对脑干神经核团、传导束、网状上行激活系统等重要结构造成破坏、挤压,迅速引发一系列严重症状。通常起病急,致残、致死率极高,对现存所有治疗手段构成挑战。由于高血压脑出血的发病情况及治疗理念不同,国外发达国家很少对高血压脑出血进行积极手术干预,特别是对PBSH的手术治疗列于手术禁忌之列。虽然国内许多单位已开展PBSH的手术治疗,但缺乏规范的循证医学研究。因此,目前国内外均没有PBSH相关的专家共识和指南。随着医学影像、评估方法和微创技术的不断发展,传统观念不断受到挑战。本文汇聚国内医学会和医师协会两大脑血管外科学组专家及所在单位的经验,同时综合国内外相关研究成果,达成以下中国专家共识,旨在为大家提供PBSH临床诊治的参考和建议。
PBSH是高血压性脑出血最严重的亚型,占所有高血压性脑出血的6%~10%[1-2],最常见部位发生在桥脑。责任血管位于脑干内部、邻近的小脑或丘脑,溢出的血液在脑干间质内扩展或由邻近丘脑、小脑向脑干内扩展并形成血肿,还可累及脑室系统[1-2]。损伤类型包括原发性损伤、继发性损伤及脑脊液循环梗阻所致急性颅内压增高引起的损伤。因受损结构特殊,残存功能有限。此外,重症管理不当及手术造成的医源性损伤也不容忽视。
由于出血量、累及部位、基础疾病、重症管理与操作水平的差异,PBSH预后可能大相径庭。适当的血肿分型可对治疗方案选择、预后判断带来方便,但目前缺乏统一标准,不利于规范化精准施治。其次,因多数患者病情危重、预后差,临床常用的改良Rankin量表(modified Rankin scale,mRS)、格拉斯哥结局量表(Glasgow outcome scale,GOS)、日常生活活动能力评定量表(activities of daily living,ADL)等评分方法对该病预后评估的区分度不高,难以对疗效作精细化评价,不利于现有方案的优胜劣汰。
受技术限制及文化传统影响,国外PBSH外科研究较少;国内学界相对更早开展内外科探索,显微镜或内镜下血肿清除与穿刺抽吸引流是常见的手术方式[3-6]。尤其近年立体定向精准抽吸技术的发展,在改善预后、减少重症监护室(intensive care unit,ICU)住院时间、降低医疗费用和技术可复制性等方面,显示出综合优势并积累了相当数量的病例[7]。但因立体定向设备在基层医院尚未普及,各种简易定位技术仍被大量采用,加上手术准入制度不完善,操作规范未统一,虽然手术例数庞大,却较难提供高质量的临床试验数据。
另一方面,随着重症监护治疗技术的进步,患者在ICU存活时间延长,如果不能有效改善预后,必然导致初期治疗与后期康复的社会支出大幅增加并衍生社会伦理方面的系列问题,成为困扰医、患、医保等多方面的社会难题。因此,建立一套符合国情的诊疗规范,存在多方面的现实需求。
中年男性、头大颈短腹圆、肥胖的高血压患者占多数,服药依从性差,生活欠节制;长期亚健康状态、社会竞争压力大、过度劳累可能是发病的诱因[8]。使用抗凝、抗血小板药物,以及肝肾功能不全,糖尿病、高脂血症等代谢性疾病和淀粉样变性等基础疾病对病情恶化起促进作用[9]。
最新全球疾病负担研究(Global burden of disease study,GBD)显示,我国总体卒中终生发病风险为39.9%,位居全球首位。卒中患者平均发病年龄:发达国家约75岁,我国为65岁左右[10],而脑干出血更趋年轻化,国外报道多为40~60岁[11-12]。国内报告的一组患者,平均年龄为49.9岁,男性多于女性[6]。
PBSH是后果最严重的出血性卒中,占6%~10%,常见于脑桥[1-2],致死率高达47%~80%[13]。Huang等[14]在2017年报道,血肿体积>10 ml,发病24 h内格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分<5分的患者30 d病死率甚至高达100%。值得关注的是,国内有学者采用立体定向精准抽吸治疗的47例PBSH患者,血肿量为(10.7±5.1)ml,术前GCS为(4.3±1.0)分,30 d病死率仅为14.9%[6]。
与其他部位高血压性脑出血发病机制相似,PBSH责任血管多为基底动脉发出的穿通支,这些血管与载体动脉呈90°角,末端没有前端管径逐渐减小所提供的保护作用[15],直接承受载体动脉管腔传递的压力。糖尿病、高脂血症、脑血管淀粉样变性等所致的血管脆性增加也可能是血管破裂的易发因素;抗血小板及抗凝药物可能妨碍人体自身的凝血机制,加重出血进展。脑干血肿大多数起源于供应脑桥的基底动脉分支,起源于中脑或延髓血管相对少见[16-18]。
发生脑干出血后,伴随血肿增大、血肿腔静水压逐渐升高、责任血管断端回缩与微血栓形成,逐步形成一定耐压性。当血肿腔静水压与责任血管断端的耐压性足以对抗责任血管收缩压时,血肿扩展趋于停止并达成“稳态”。此时,原发性损伤不再进展。但是,血压超过正常值上限(140/90 mmHg,1 mmHg=0.133 kPa)或手术操作均可能破坏“稳态”致再出血,使原发性损伤进一步加重[19]。
稳态达成之前,脑损伤机制主要为血肿扩展过程中对脑实质包括神经纤维束和神经核团等产生的机械撕裂与挤压等原发性损伤。梗阻性脑积水可迅速增高颅内压(intracranial pressure,ICP),脑干出血向下扩展则可能压迫或破坏延髓,出现呼吸、循环障碍而危及生命;向上、向背侧扩展累及中脑被盖部网状激活系统可导致长期昏迷。
稳态达成后将出现细胞毒性水肿为主的继发性损伤,其确切机制仍不清楚。有研究证实红细胞崩解后,血红蛋白降解、铁离子释放,促发了一系列神经毒性反应[20]。CT和磁共振成像(MRI)增强扫描可发现血肿周边与远隔区域出现对比强化,表示血脑屏障被破坏[21-23],强化范围可反映继发性脑损伤的进展状况。由于红细胞崩解需要时间,在原发性损伤停止而红细胞崩解尚未大量启动前,存在手术干预的最佳时间窗,为个性化选择手术时机提供了依据。
起病急骤,发病后迅速出现以后组颅神经受损,感觉、运动、平衡、意识障碍以及生命体征紊乱为特征的临床症候群。但因出血量、出血位置不同,PBSH的临床表现也有所不同。出血量小的患者可意识清醒,伴有头晕、后组颅神经障碍或肢体无力等症状;出血量大的患者常出现昏迷、瞳孔缩小或不规则、呼吸紊乱及肢体瘫痪等临床表现。
上述症状常因早期昏迷而难以察觉,就诊时主要表现为较低的GCS评分、心律紊乱和呼吸功能障碍。
主要依据病史、体检及CT等影像学检查以明确,但需排除其他继发性因素。
1. 所有患者应尽快进行包括病史、一般体检、神经系统检查和血液化验等全面评估,尤其应关注高血压病史、口服抗凝抗血小板药物病史、血常规、凝血功能等结果。
2. GCS评分是最常用的评估量表。
3. 影像学评估:头颅CT是首选的筛查手段,可明确血肿位置、大小、累及范围、是否破入第四脑室及是否并发梗阻性脑积水等情况。根据CT所示,可对PBSH进行分类分型,包括Russel血肿分型[24]和脑干血肿浙二分型[6]等,指导预后评估及手术路径规划。尽管不同的分型系统有差别,但这些研究基本认为[24-28]:血肿体积超过4~5 ml或轴位横径20~27 mm以上、累及双侧的弥漫性出血、急性脑积水影像学征象与不良预后相关;单侧性出血则预后相对良好;发生在脑桥中央的大血肿,因累及网状激活系统和导致急性梗阻性脑积水,可引起患者迅速昏迷,甚至死亡。
CT增强与CT血管成像(CT angiography,CTA)有助于排查血管畸形或肿瘤性病变,拟行穿刺手术前应列为常规。MRI在判断出血时间方面比CT更优,但对于急性期脑出血,两者准确性基本一致[29]。若高度怀疑肿瘤卒中等继发性出血,且病情允许,可加做增强MRI扫描。
4.电生理评估:神经生理监测被认为是预测卒中后功能恢复的重要客观手段[30-31]。由于从头皮记录脑电图(electroencephalography,EEG)几乎不能检测到脑干的功能,其在脑干监测中的作用仍然是安慰患者亲属大于指导临床决策[32]。相比而言,脑干听觉诱发电位(brainstem auditory evoked potentials,BAEP)、运动诱发电位(motor evoked potentials,MEP)以及躯体感觉诱发电位(somatosensory evoked potentials,SSEP)等监测手段可以监测相关通路在脑干段功能的完整性。前两种为脑干手术中的标准监测工具,但也只能监测约20%的脑干功能[33]。
经颅电刺激(transcranial electrical stimulation,TES)通过记录肢体远端和头面部肌肉的MEP,可分别用于监测包括麻醉状态下的皮质脊髓和皮质延髓运动传导功能的完整性[33-35]。MEP被认为是监测运动通路完整性的“黄金标准”,而SSEP具有更好的特异性,研究认为将两者加权得出综合评分,比仅凭CT测量血肿体积能更有效地判断患者预后[36]。
1.血管性疾病:包括脑动脉瘤、血管畸形出血等。脑动脉瘤破裂出血,患者常有颈项强直,头颅CT检查可见蛛网膜下腔出血;头颅CT增强及CTA检查不仅便捷,还能提供重要的鉴别信息,应列为常规筛查项目;若高度怀疑血管性疾病,应进一步行脑数字减影血管造影(digital subtraction angiography,DSA)检查。
2.脑干海绵状血管瘤:脑干海绵状血管瘤破裂出血,血肿量少且多呈局限性,对脑干的原发性损害相对较轻。头颅CT可观察到高密度区域范围大,而临床症状相对较轻。头颅MRI检查可进一步明确诊断。
3.肿瘤卒中出血:出血一般与肿瘤混杂一处,边缘常不规则,症状相对较轻,头颅MRI检查可提供进一步诊断依据。
院前和急诊干预措施,除常规的瞳孔、GCS评分及生命体征监测外,还需特别关注气道通畅性、呼吸节律及高血压控制;如GCS≤8分,或常规吸氧不能维持正常血氧饱和度,或有呕吐、窒息风险时,应及时气管插管。气管插管、导尿管、鼻肠管等医源性刺激,可能导致血压异常升高,增加再出血风险,实施前后应全程做好镇静、镇痛及降压措施。
《高血压性脑出血中国多学科诊治指南》2020版认为,血压升高(>160 mmHg)有促进血肿扩大的风险,预防血肿扩大的措施主要是血压管理和止血药物使用[37]。PBSH患者血压常异常升高或剧烈波动,更需重视血压管理。发病6 h内接受早期强化降压(收缩压目标在1 h内<140 mmHg,持续7 d)有更好的功能结局且无害;有可能通过更强、更快地降压来限制血肿扩大以改善治疗效果[38-39]。急性期快速平稳降到140/90 mmHg以下的目标血压,符合相关指南精神[37,40],但具体目标值必须基于脑灌注压的目标而设定,尤其发病后或手术后6 h内的患者,需警惕高灌注引起的出血风险,避免臆测颅内高压而放任血压超过正常值上限。推荐将血压控制目标设定在130/80 mmHg左右,在临床实践中更容易达成控制到140/90 mmHg以下的目的。但在执行过程中,应加强对心、肾等其他脏器功能的监测。遵照药品说明书规范给药,有利于快速平稳降压,减少不良刺激,常用静脉降压药包括乌拉地尔、拉贝洛尔、尼卡地平等。
止血药物被认为是限制血肿扩大的另一手段,尤其对凝血功能异常的患者。氨甲环酸通过抗纤溶作用限制血肿扩大。STICH(Surgical Trial in Lobar Intracerebral Haemorrhage,STICH)Ⅱ研究纳入2 325例脑内出血(intracerebral hemorrhage,ICH)患者,比较氨甲环酸与安慰剂在ICH中的治疗作用,结果显示出血8 h内氨甲环酸治疗能够显著降低血肿扩大发生率及7 d病死率[37]。另外重组Ⅶa因子也可以降低再出血率[37]。但两者均未能改善预后和远期生存率,提示需要更加综合和精细的治疗策略。
对于服用抗凝抗血小板药物期间发生的PBSH,短期内血肿增大风险更高,且往往缺乏有效的逆转措施,预后更差。应实施更加严密的监测措施,并给予更加积极的降压治疗。对于口服华法林的患者,可给予维生素K纠正凝血功能障碍,并通过监测国际标准化比值(international normalized ratio,INR)水平评估治疗效果;肝素类制剂可通过鱼精蛋白逆转;新型口服抗凝药物在2 h内可口服活性炭吸附治疗,目前国内缺乏拮抗药物,建议静脉给予30~50 IU/kg凝血酶原复合物或50 IU/kg激活凝血酶原复合物治疗;口服抗血小板药物的患者切忌盲目给予血小板输注治疗,可能会导致病情加重[41-42]。
PBSH患者相对年轻,患者家属常有较强的救治意愿。但因内科治疗的总体预后不良,是否考虑终止医疗干预或采取更为积极的外科治疗是非常困难的选择,需综合评估患者病情、家庭状况及现实可及的医疗条件,建立底线思维后再慎重决策。
由于脑出血的病理生理学具有时间依赖性,理想情况下应尽快完成血肿清除以缓解占位效应及对周边脑实质的毒性作用。但早年一项大型幕上自发性出血的随机临床对照研究(randomized control trial,RCT),并未发现早期开颅手术(中位时间为30 h)比保守更好,甚至深部出血的疗效更差,从而反思了医源性损伤对预后的影响,并寄希望于侵袭性更小的内镜或立体定向手术[43]。此类研究常排除脑干出血,美国心脏病协会(America Heart Association,AHA)/美国卒中协会(America stroke association,ASA)指南不推荐甚至反对行脑干血肿清除术[40]。近年来,多项针对PBSH的研究结果表明微创手术较保守治疗能获得更好的预后[3,6,44],因此本共识仍然建议将外科干预纳入PBSH综合治疗决策并积极开展相关临床研究。
1.手术指征:血肿体积≥5 ml,GCS≤7分,或血肿体积3~5 ml,保守至起病72 h以上仍GCS≤5分,或并发急性脑积水,同时家属有强烈手术意愿者。其中年龄<65岁,偏侧出血患者,可能从手术中获益更多。累及双侧的弥漫性出血预后不佳,应充分告知家属。GCS 3分、生命体征不稳定,属于手术禁忌。
2.显微开颅血肿清除术:随着显微手术技术的进步,和对脑干安全进入区解剖认识的不断深入,脑干已不再是神经外科手术禁区,针对PBSH的显微手术也取得了一定的成效[3,45]。应根据血肿所在具体部位选择颅底手术入路,如中脑被盖区血肿可选择枕下经天幕入路,中脑外侧面血肿可选择颞下入路,脑桥腹外侧血肿可选择乙状窦后入路,脑桥、延髓背侧血肿可选择枕下正中入路[3,45]。但脑干血肿清除术建议由经验丰富的神经外科医生开展,并注意“脑干无牵拉、血肿轻吸引、责任血管弱电凝”等显微操作要点,以尽可能降低医源性损伤[46]。
3.立体定向抽吸术:穿刺类手术具有显著的微侵袭优势,能够有效降低医源性损伤水平,最早由日本的Takahama团队开展并取得成功[47]。Hara等[44]在37例原发性脑桥出血患者中开展对照研究,发现18例手术患者中72%获得显著临床改善,而保守治疗组仅有42%获得好转。国内最早报告采用立体定向抽吸联合尿激酶溶血引流治疗的一组高血压性脑出血病例中有3例脑干出血[5],其后的零星报道[48-51],显示该技术确有成效。2019年有学者基于立体定向手术计划系统的术前规划,确定最优穿刺路径,抽吸作业点、侧孔方位角及抽吸量,指导术中精准抽吸,术后无需常规使用尿激酶溶血,基本达到直视下清除效果,与保守治疗相比,立体定向手术能够明显改善患者30 d生存率(85.9%比50.0%)和90 d清醒率(39.0%比22.1%)[6]。近年来,基于简易定位原理的硬通道、软通道技术开始应用于脑出血手术中,但是否能够满足脑干手术的定位精度,目前尚缺乏循证医学证据,因此建议谨慎应用于PBSH的手术治疗中。
4.内镜下血肿清除术:目前,仅有个案报道应用内镜进行脑干血肿清除术。最早由日本的Takimoto等[52]报道采用神经内镜经导水管清除脑桥血肿。Liu等[53]则报道采用内镜下经鼻经斜坡入路治疗1例严重的PBSH,术后GCS评分由3分改善至11分。该入路主要适合清除脑干腹侧血肿,但术后面临脑脊液鼻漏和感染的风险,对其安全性和有效性的评价依赖进一步大样本的临床研究。
5.脑室外引流术:PBSH中高达39.5%的患者会并发脑室出血[54],血肿机械性压迫也可能引起四脑室堵塞,从而继发梗阻性脑积水,导致占位效应和ICP增高,危及患者生命。此时可采用脑室外引流术缓解脑积水,同时有助于引流血性脑脊液,促进脑室内血肿的廓清。
总体而言,PBSH的外科治疗应遵循以下原则:(1)手术有助于提高存活率和苏醒概率,但多数存活患者生活自理能力差,中长期所需康复与护理成本高,应客观知情告知;(2)由于血肿累及的结构特殊,对技术熟练程度、软硬件设备条件及围手术期管理均有较高要求。在做好生命体征支持的前提下,应尽早将患者转送至有条件的医院进行外科干预;(3)手术方式可结合实际情况,优先选择立体定向精准抽吸术;直视下容易暴露的血肿也可考虑选择颅底入路显微镜下血肿清除术。
PBSH发病初期以缓解血肿占位效应、减轻继发性损害和控制基础病为主。病情允许时进行各项神经康复评定,包括:意识状态、认知、言语、吞咽、感觉、肢体运动及平衡功能,以及神经影像、神经电生理、仪器步态分析等;制定个性化早期康复计划;对患者及陪护人员进行康复教育,督导执行康复训练计划。
促醒是PBSH昏迷患者最迫切的康复需求,药物促醒经验多来自脑外伤昏迷患者的治疗。金刚烷胺被观察到可能有效[55],但在稍早的一项双盲、随机对照临床研究中,并未对患者的意识恢复产生正面影响[56];其次,高压氧、针灸与中医中药也是常用的促醒手段。其他可供选择的措施还有[57-58]:(1)感觉刺激疗法(sensory stimulation program,SSP):包括特殊感觉(视、听、嗅、味)刺激和躯体感觉(温、痛、触、压)刺激。每种刺激的实施强度、频率和持续时间存在方法学差异。SSP作为治疗意识障碍的方法至今仍有争议,可能不足以恢复意识,但可能改善最小意识状态(minimally conscious state,MCS)患者的行为反应[59]。(2)神经刺激疗法:以非侵入性手段为主,包括右侧正中神经电刺激、重复经颅磁刺激、经颅直流电刺激和聚焦超声刺激等;侵入性刺激疗法包括高颈段脊髓电刺激(spinal cord stimulation,SCS)、迷走神经刺激(vagus nerve stimulation,VNS)和深部脑刺激(deep brain stimulation,DBS)等[58]。此类技术机制尚不明确,所用刺激参数、靶点选择未统一,但可作为探索的方向。(3)神经修复工程:神经干细胞、脑机接口是潜在的有效手段,但不具备现实推广条件;康复机器人、肢体康复辅助器具对恢复部分活动能力的患者有帮助。
一般认为发病后的3个月以内是“黄金”康复期,而直至发病4~6个月后仍是“有效”康复期。在多学科协作的卒中单元住院并接受早期康复治疗的患者比在标准病房或内科病房进行一般治疗的患者有更好的预后[60]。
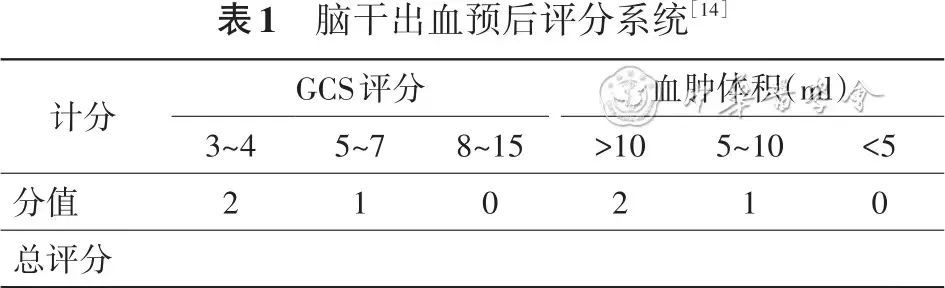
PBSH患者的30 d病死率在47%~80%,出血部位和出血量不同,病死率亦有差异[12-13]。存活患者中,绝大多数遗留严重神经功能障碍[61]。既往研究发现,原发性脑出血患者早期昏迷、呼吸机辅助通气、血肿量较大(>5 ml)及合并脑积水等均与患者不良预后相关[2,6,54,61]。2017年,Huang等[14]在Stroke杂志上发表新的脑干出血预后评分系统(表1),根据GCS评分和血肿量设定分值,总评分0、1、2、3和4的患者发病后30 d病死率分别为2.7%、31.6%、42.7%、81.8%和100%。
虽然微创手术治疗结合重症监护和康复治疗大幅提高了PBSH患者存活和苏醒概率,但存活者仅有少数能恢复生活自理,多数患者将长期处于失能状态。由于以往大规模RCT临床研究通常排除脑干出血,相关指南无法给出较高证据等级建议。未来也需要大样本随机临床试验来提供更高质量的证据。
节制不良嗜好、合理化调整饮食结构、控制体重、劳逸结合,定期检查“血压、血糖、血脂”,避免长期亚健康状态是预防PBSH的有效措施。密切监测“三高”重点人群的血压和基础病进展情况,一旦发现血压异常升高或出现前所未有的头部不适,应尽早干预,必要时联合用药将血压控制在140/90 mmHg甚至更低的正常范围内。
PBSH为排他性诊断,可归类于原发性/自发性脑出血。与其他部位脑出血相比,有更高的致死、致残率,且更易陷入社会伦理方面的困境。入院时临床和影像学评估是判断预后的主要依据。
保守治疗适用于轻症,但对多数重症患者价值有限。部分直视下清除与穿刺抽吸手术提高了重症患者存活和苏醒概率,缩短ICU住院时间,显示出费效比优势,但技术规范和准入制度亟待完善。神经重症监护和康复促醒为基础治疗,也是主要的成本支出项。存活患者中长期的康复护理是患者家庭和社会面临的又一难题。总之,脑干出血造成神经功能的损害严重且广泛,极不可能通过一种方案得到根本性改观,需要持之以恒地探索和多种技术的综合。因文化差异,无法照搬国外指南,需要我国医学及社会工作者更多关注并提出建议,以补充本共识的不足。
本共识仅代表参与编写讨论专家的观点,不具备法律效力。随着相关研究进展及循证医学证据不断增加,《原发性脑干出血诊治中国神经外科专家共识》也将不断修改和完善。
执笔:刘凤强、王勇杰(浙江大学医学院附属第二医院神经外科)
共识神经外科专家组名单(按姓氏汉语拼音排序):白杰(内蒙古医科大学附属医院神经外科);曹勇(首都医科大学附属北京天坛医院神经外科);常春超(西藏自治区第二人民医院神经外科);陈高(浙江大学医学院附属第二医院神经外科);程远(重庆医科大学附属第二医院神经外科);陈劲草(武汉大学中南医院神经外科);陈鑫璞(郑州大学第一附属医院神经外科);崔建忠(唐山市工人医院神经外科);丁伟(日照市中医院神经外科);丁新民(山西省人民医院神经外科);丰育功(青岛大学附属医院神经外科);郭庚(山西医科大学第一医院神经外科);郭英(中山大学附属第三医院神经外科);郭智霖(上海交通大学医学院附属第九人民医院神经外科);顾宇翔(复旦大学附属华山医院神经外科);何伟文(广州医科大学附属第二医院神经外科);洪波(海军军医大学附属长海医院神经外科);黄德俊(宁夏医科大学总医院神经外科);胡伟鹏(福建医科大学附属第二医院神经外科);蒋秋华(赣州市人民医院神经外科);姜维喜(中南大学湘雅医院神经外科);蒋晓帆(空军军医大学第一附属医院神经外科);蒋宇刚(中南大学湘雅第二医院神经外科);焦立群(首都医科大学宣武医院神经外科);康德智(福建医科大学附属第一医院神经外科);廖兴胜(广西医科大学第一附属医院神经外科);李钢(海南省第三人民医院神经外科);李刚(山东大学齐鲁医院神经外科);林元相(福建医科大学附属第一医院神经外科);刘兵(天津医科大学总医院神经外科);刘窗溪(贵州省人民医院神经外科);刘颉(庆阳市人民医院神经外科);刘翼(华西医院神经外科);龙江(昆明医科大学第一附属医院神经外科);毛颖(复旦大学附属华山医院神经外科);帕尔哈提·热西提(新疆维吾尔自治区人民医院神经外科);蒲军(昆明医科大学附属第二医院神经外科);齐铁伟(中山大学附属第一医院神经外科);史怀璋(哈尔滨医科大学附属第一医院神经外科);孙正辉(中国人民解放军总医院神经外科);唐晓平(川北医学院附属医院神经外科);田新华(厦门大学附属中山医院神经外科);佟小光(天津市环湖医院神经外科);佟志勇(中国医科大学附属第一医院神经外科);万登峰(江西省人民医院神经外科);王灯亮(福建医科大学附属第一医院神经外科);王红军(青海省交通医院神经外科);王进昆(昆明医科大学第一附属医院神经外科);王林(浙江大学医学院附属第二医院神经外科);王立群(河北医科大学第二医院神经外科);王茂德(西安交通大学第一附属医院神经外科);王嵘(首都医科大学附属北京天坛医院神经外科);王硕(首都医科大学附属北京天坛医院神经外科);王业忠(广州医科大学附属第二医院神经外科);王中(苏州大学附属第一医院神经外科);吴勤奋(新疆医科大学第二附属医院神经外科);吴伟(江苏省人民医院神经外科);线春明(青海省人民医院神经外科);向欣(贵州医科大学附属医院神经外科);谢万福(西安交通大学第一附属医院神经外科);许侃(吉林大学第一医院神经外科);许民辉(陆军军医大学大坪医院神经外科);杨继文(内蒙古医科大学附属医院神经外科);杨雷霆(广西医科大学第一附属医院神经外科);尹龙(天津市环湖医院神经外科);翟广(郑州大学第一附属医院神经外科);张东(首都医科大学附属北京天坛医院神经外科);张华楸(华中科技大学同济医学院附属同济医院神经外科);张瑞剑(内蒙古自治区人民医院神经外科);张晓华(上海交通大学医学院附属仁济医院神经外科);张扬(中国科学技术大学附属第一医院神经外科);詹仁雅(浙江大学医学院附属第一医院神经外科);赵兵(安徽医科大学第二附属医院神经外科);赵丛海(吉林大学中日联谊医院神经外科);赵冬(石河子大学医学院第一附属医院神经外科);张建民(浙江大学医学院附属第二医院神经外科);赵文元(武汉大学中南医院神经外科);朱巍(复旦大学附属华山医院神经外科)
利益冲突
所有作者均声明不存在利益冲突
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
主管:中国科学技术协会
主办:中华医学会
编辑:中华医学杂志编辑委员会
地址:100052,北京市西城区东河沿街69号正弘大厦
网址:http://www.nmjc.net.cn
总编辑:曹雪涛
编辑部主任:吕相征





