病例概述
2021年6月接诊一例来自河北邢台的5岁女性患儿(身高:113cm,体重:20kg)。主诉:口角右偏2月余,进行性加重。患儿2月前无明显诱因出现口角右侧歪斜,外院检查发现颅内占位,遂来我院就诊。门诊查体:神情、精神好,左侧鼻唇沟变浅、口角右偏,余未见明显神经系统阳性体征。头颅CT示左侧桥臂团块状混杂密度影,大小约37×21×20mm;头颅MRI示左侧桥臂可见片状长T1长T2信号影,含囊腔、边缘欠清晰,大小约27×26×19mm,明显强化(图1)。
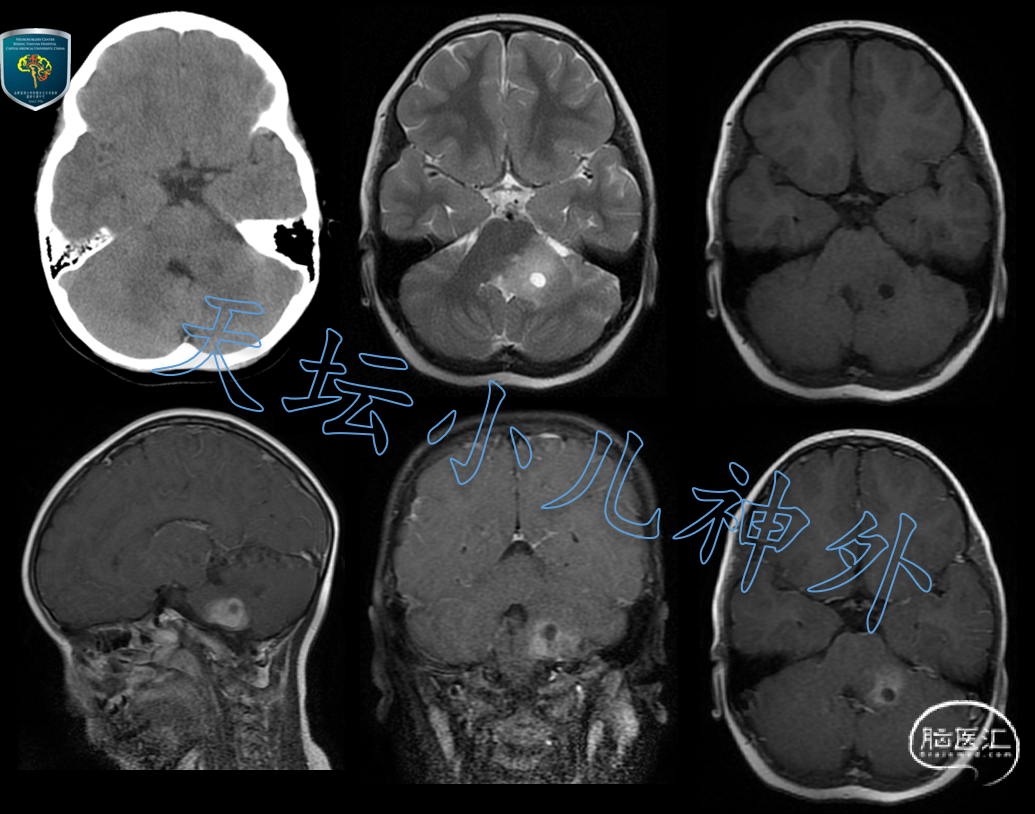
图1 头颅CT示左侧桥臂团块状混杂密度影,大小约37×21×20mm;头颅MRI示左侧桥臂可见片状长T1长T2信号影,含囊腔、边缘欠清晰,大小约27×26×19mm,明显强化,胶质瘤可能性大。
患儿左侧桥臂占位,胶质瘤可能性大,手术指征明确,完善术前检查,于2021年6月23日导航辅助、电生理监测下行后正中左拐开颅肿瘤切除术。导航精确定位后,经小脑皮层造瘘,见肿瘤位于左侧桥臂、小脑中脚,色灰黄、质软、血供中等、边界欠清晰,含小囊腔,黄色清亮囊液涌出,导航精确引导下,切除肿瘤大小2×2×2.5cm。手术操作要点是动作轻柔、避免暴力牵拉、尽量避免双极电凝使用、分块切除。肿瘤切除满意,电生理监测证实脑干功能保护完好(图2)。手术顺利,术中出血约300ml,输红细胞2单位,新鲜血浆200ml,术后安返ICU监护。
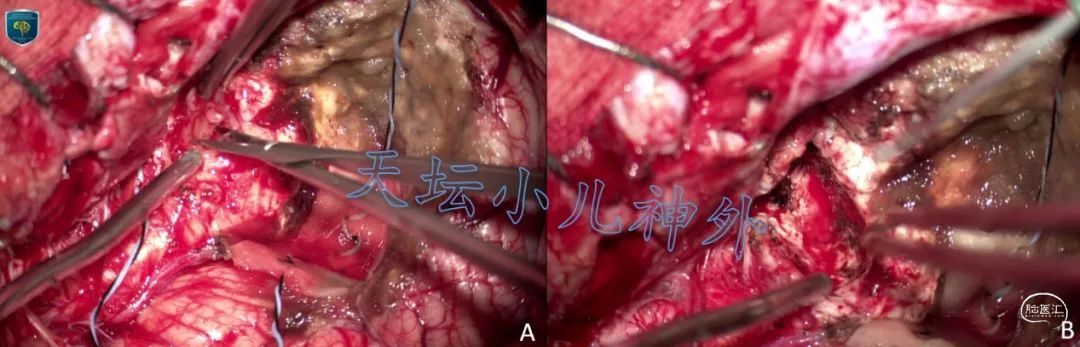
图2 A.暴露肿瘤,起源于左侧桥臂;B.肿瘤切除满意,脑干减压充分、保护完好。
术后患儿神情、状态好,保留气管插管,当晚及术后一周复查头颅CT显示肿瘤切除满意,后颅窝减压充分(图3)。术后病理:低级别胶质瘤,符合星形细胞瘤(WHO II级);免疫组化:GFAP(+),Olig-2(+),Ki-67<5%,H3K27M(-);基因检测:BRAF 基因突变,KIAA1549-BRAF融合。术后三周,患儿痰多、被动呛咳反射弱,行气管切开术。气切后,患儿痰易吸除,肺功能明显改善,术后第四周顺利出院,继续康复治疗。出院时神情、精神好,四肢肌力、肌张力正常,KPS评分70分。
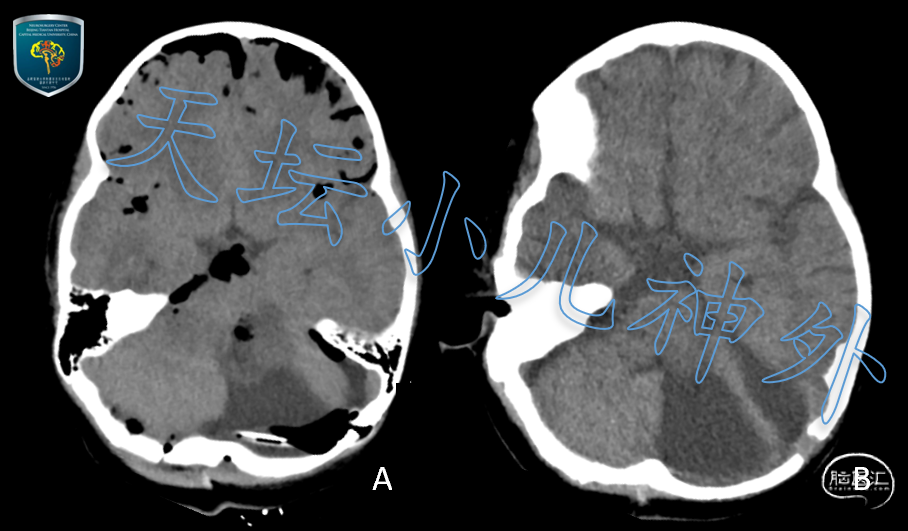
图3 A.术后当晚头CT;B.术后一周头颅CT均显示肿瘤切除满意,后颅窝减压充分
患儿出院回当地继续康复治疗,术后三个月门诊复查,恢复好、自主活动,气切套管已拔除,饮食吞咽恢复正常;复查头颅MRI是肿瘤切除满意(图4),随访中。
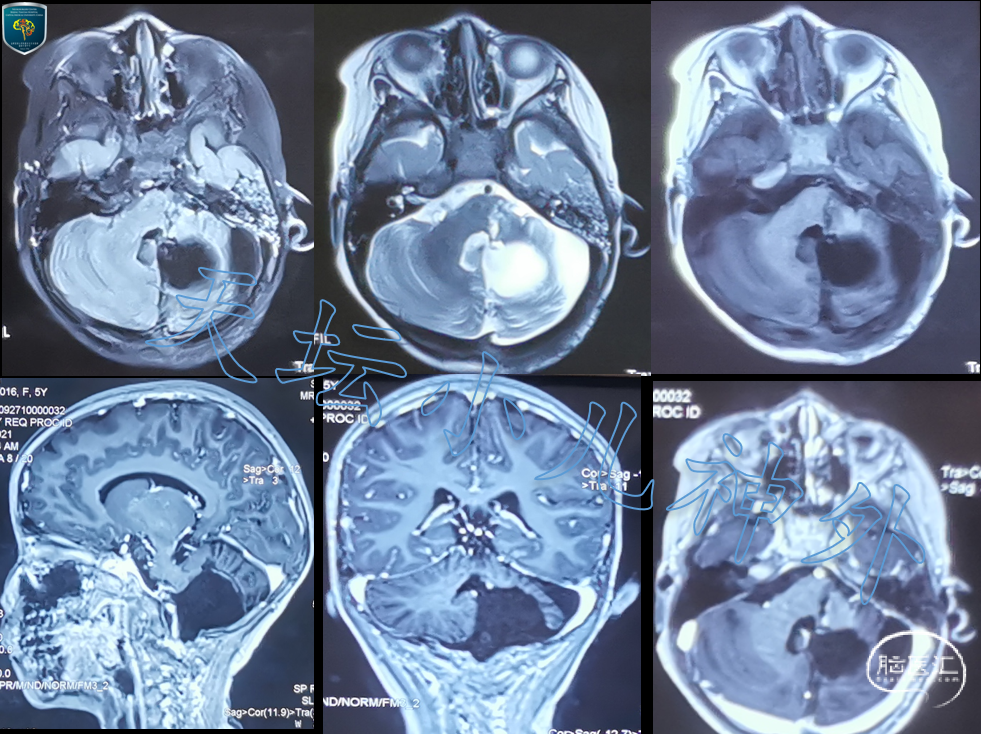
图4 术后三个月复查头颅MRI显示肿瘤切除满意,进一步随访中。
治疗体会
如前文多次提到,脑干胶质瘤(brainstem gliomas,BSG)儿童较常见(约占10-20%)[1],分为局灶性(约占20%,FBSG)和弥漫性内生型(约占80%,DIPG)两大类,本例属于局灶外生型,最大安全范围切除肿瘤,预后良好[2]。
本例肿瘤切除满意,但术后一度脑干功能(吞咽与呛咳功能)损伤明显,被迫行气管切开。出院后患儿积极康复,三个月后恢复之好出人意料。据此,再次说明了儿童神经系统自修复功能的强大,同时提升了医生与家长战胜病魔的信心与决心,令人欣慰。
中枢神经系统具有再生能力,自修复基础来源于神经元可塑性,即神经元回路在结构和功能水平上进行适应性变化,从分子、突触和细胞变化到更广泛的网络变化[3]。威廉·詹姆斯(William James)1890年在《心理学原理》中首次将“可塑性”一词用于行为学;波兰科学家Jerzy Konorski最早使用“神经元可塑性”这一术语[4,5];西班牙神经解剖学家Cajal在19世纪末提出神经元学说,将神经元描述为神经系统的基本单位,成为神经元可塑性概念的基础[6]。由于一些“教条”的神经病理学家坚持认为神经元不可再生,“神经元可塑性”这一术语曾引发激烈争论[7]。
关于儿童脑损伤,玛格丽特·肯纳德(Margaret Kennard)首先提出年龄可能对损伤后恢复产生影响,即肯纳德原则(Kennard principle),认为儿童发育中的大脑在受伤后能够进行重组和恢复[8];Berger[9]回顾了37名脑外伤儿童,发现这些儿童的功能恢复比成人更好、残疾更少。
美国佛罗里达大学杰克逊维尔健康中心的Beier等[10]曾报道2例儿童脑干出血的患者(5岁和14岁)奇迹般存活,仅有轻度神经功能损伤,据此推测儿童脑干具有强大的可塑性;加拿大MacLean等报道1例16岁儿童经眶脑干贯通伤成功存活,6个月后完全康复,再次证明了儿童脑干功能旺盛的自修复能力[11]。
目前,神经元可塑性已得到广泛认可,西班牙学者Maier等[12]制定了15个针对脑损伤修复的学习原则;据此,针对儿童脑干损伤的康复训练值得深入研究。
参考文献
[1] Ramos A, Hilario A, Lagares A, et al. Brainstem gliomas[J]. Semin Ultrasound CT MR, 2013, 34(2): 104-12.
[2] Green A L, Kieran M W. Pediatric brainstem gliomas: new understanding leads to potential new treatments for two very different tumors[J]. Curr Oncol Rep, 2015, 17(3): 436.
[3] Sophie Su Y, Veeravagu A, Grant G: Frontiers in Neuroscience Neuroplasticity after Traumatic Brain Injury, Laskowitz D, Grant G, editor, Translational Research in Traumatic Brain Injury, Boca Raton (FL): CRC Press/Taylor and Francis Group © 2016 by Taylor & Francis Group, LLC., 2016.
[4] Livingston R B. Brain mechanisms in conditioning and learning[C], 1966.
[5] Warren J. Synaptic Self: How Our Brains Become Who We Are[J]. Journal of the Royal Society of Medicine, 2002, 95(7): 373-374.
[6] Mateos-Aparicio P, Rodríguez-Moreno A. The Impact of Studying Brain Plasticity[J]. Front Cell Neurosci, 2019, 13: 66.
[7] Fuchs E, Flugge G. Adult neuroplasticity: more than 40 years of research[J]. Neural Plast, 2014, 2014: 541870.
[8] Kolb B, Gibb R. Brain plasticity and behaviour in the developing brain[J]. J Can Acad Child Adolesc Psychiatry, 2011, 20(4): 265-76.
[9] Berger M S, Pitts L H, Lovely M, et al. Outcome from severe head injury in children and adolescents[J]. J Neurosurg, 1985, 62(2): 194-9.
[10] Beier A D, Dirks P B. Pediatric brainstem hemorrhages after traumatic brain injury[J]. J Neurosurg Pediatr, 2014, 14(4): 421-4.
[11] Maclean M A, Mukhida K, Shankar J J S, et al. Complete recovery following transorbital penetrating head injury traversing the brainstem: case report[J]. J Neurosurg Pediatr, 2019: 1-5.
[12] Maier M, Ballester B R, Verschure P. Principles of Neurorehabilitation After Stroke Based on Motor Learning and Brain Plasticity Mechanisms[J]. Front Syst Neurosci, 2019, 13: 74.





