垂体泌乳素腺瘤(Prolactinoma, PRL瘤)是来源于颅内的神经内分泌腺体器官-垂体-的一种分泌泌乳素(Prolactin,PRL)的良性肿瘤,是功能性垂体腺瘤的一个亚组(这一类别还包括促肾上腺皮质激素腺瘤、生长激素腺瘤、促性腺激素腺瘤和促甲状腺素腺瘤),占垂体腺瘤的40%,占功能性垂体腺瘤的50%~60%,其在人群中的发病率高达70/100000,且多发生在年龄20~50岁的女性。
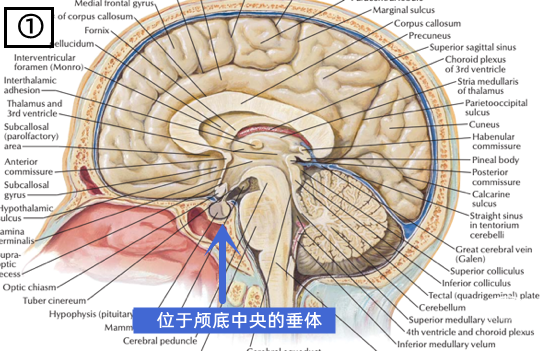
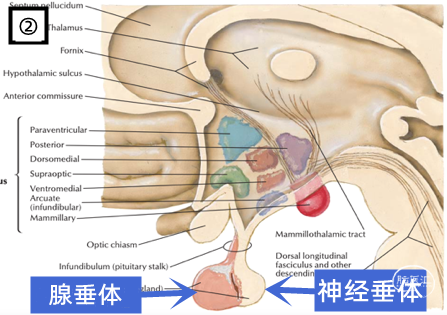
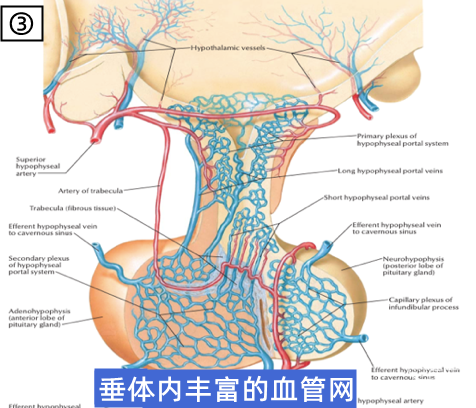
(上三图,①→②→③,从宏观到微观,展示了垂体这一脑内重要的神经内分泌器官的复杂结构,摘自《奈氏神经解剖图谱》。)
根据PRL瘤自身直径分类为:
1. 垂体微腺瘤:肿瘤直径≤1cm;
2. 垂体大腺瘤:4cm≥肿瘤直径>1cm;
3. 垂体巨腺瘤:肿瘤直径>4cm,鞍外侵犯,血清泌乳素水平>500ng/ml,常伴部分或全垂体功能低下。
根据肿瘤性质又分为:
1. 典型泌乳素腺瘤;
2. 非典型泌乳素腺瘤;
非典型垂体腺瘤指肿瘤有Ki67 指数>3%、非典型过度增生、或者核分裂。Tortosa and Webb发现220个不典型腺瘤的复发率是57.1%,Ki67 指数越高复发风险越高,Ki67 指数<3%提示预后良好。Ki67 指数>5%应该联合放疗。
3. 侵袭性泌乳素瘤(Aggressive prolactinoma, APRL)。
APRL是侵袭性垂体肿瘤的一个亚组(占所有垂体瘤的10%),其定义为:基于放射影像学和/或组织学特征的侵袭性,与典型腺瘤相比具有较高的增殖性特征,对标准药物/方案迅速产生耐药性,且早期复发风险增加。APRL诊断条件:1)血泌乳素水平超过1000ng/ml;2) 根据Knosp等的分类,侵犯海绵窦空间对应于III级或IV级。
APRL的特征及治疗管理见下方表格。

PRL瘤生长主要引起两大类症状:
1. 肿瘤压迫性症状(肿瘤压迫垂体及周围结构):
头痛、垂体功能低下(儿童或青少年可表现为发育迟滞)、视力视野障碍、颅神经麻痹、尿崩症等;
2. 高泌乳素症状:
性腺功能减退症状:泌乳(男性还可表现为乳房发育)、低生育力、性欲减退(男性表现为阳痿、少精症、勃起障碍)、月经紊乱、毛发脱落;
骨质疏松及相关骨折;部分患者可能无症状。
正常PRL水平女性高于男性,一般低于25μg/L(或ng/ml),药物如利培酮、胃复安可升高PRL达200μg/L以上,如达到250μg/L以上就要考虑PRL瘤的存在,达到500μg/L则通常提示PRL巨腺瘤的存在。在巨腺瘤中多见垂体功能低下,1项研究发现垂体激素缺乏最常见的是促性腺激素(71.8%),其次是生长激素(41%)、促甲状腺激素(25.6%)、促肾上腺皮质激素(23.1%)。
PRL瘤的四线治疗
PRL瘤的诊断同任何其它疾病一样,是一种排他性诊断,须经神经外科有相关丰富经验的专科医师确定,其诊断一旦确立,则根据PRL瘤的大小和产生的症状,以及治疗进程,可能需要多种治疗方式结合。
PRL瘤治疗目的在于:1.恢复正常的PRL血清水平,控制相关临床症状;2.减少肿瘤体积,降低视野缺损、颅神经功能障碍以及垂体功能不全;3.保护正常垂体功能;4.预防复发或者进展;5.改善生活质量。
PRL瘤的治疗是阶梯性的,现就其四线治疗方案略做简介。
一. PRL瘤的一线治疗——多巴胺受体激动剂。
PRL瘤的一线治疗是药物治疗——多巴胺受体激动剂(Dopamine Agonist, DA)。DA活性抑制PRL基因表达和泌乳素细胞代谢,导致PRL合成和释放减少以及肿瘤缩小,恢复性腺功能;能使约90%垂体微腺瘤及85%垂体大泌乳素腺瘤患者血清泌乳素水平恢复正常,大约80%大泌乳素腺瘤直径至少缩小25%。泌乳素大腺瘤开始治疗后1或2周内可以观察到肿瘤的明显缩小,但有些病例治疗几个月也不会缩小。持续的肿瘤缩小发生在开始治疗后的几个月或甚至几年,因此,开始治疗后的2~3个月应及时复查MRI。有些病人DA治疗后即使泌乳素水平高于正常值的上限,垂体功能也能恢复正常。
对于症状轻微,如只存在轻度溢乳、月经周期规律且MRI扫描垂体正常或垂体微腺瘤,可予以临床观察,每6~12个月监测一次泌乳素水平。如果出现催乳素水平升高,或高泌乳素血症导致的症状进展,则需要复查垂体MRI并且需要开始治疗。
对于月经减少或闭经的女性,如果没有生育要求,可以考虑口服雌激素或雌激素加孕酮疗法。停经的女性可以进行雌激素治疗,但每年需要评估泌乳素水平。
最常用的DA是溴隐亭和卡麦角林。
![]()
溴隐亭
溴隐亭,半衰期短,需要每天给药2~3 次;通常起始剂量为0.62~1.25mg/d,每周增加1.25 mg,最大量可至30 mg/d。尽管溴隐亭治疗效果较为满意,但12%的患者不能耐受副作用,包括胃肠道症状(恶心、呕吐、便秘、反流、消化不良),神经系统症状(头痛、头晕、运动障碍、思维混乱),心血管症状(直立性低血压、晕厥)及其他副作用包括肌肉抽搐、精神错乱、口干舌燥。这些副作用均十分常见,且药物剂量增加或药物依从性降低时副作用更明显。20-30%d的PRL患者对溴隐亭有抵抗。发现药物抵抗或者明显不能耐受的副作用时需换用卡麦角林。
溴隐亭抵抗定义:当患者被以最大可耐受剂量或者每日15mg治疗,泌乳素水平仍不能达到正常,肿瘤体积减少未达50%。
![]()
卡麦角林
卡麦角林,半衰期长,每周只需要口服1~2次;通常是从每周0.25(半片)~0.5 mg开始,每周增加剂量,直到泌乳素水平达到正常。卡麦角林是治疗侵袭性垂体泌乳素大腺瘤的主要药物,对于溴隐亭抵抗的病人,仍能有效降低泌乳素水平和缩小肿瘤体积;且与溴隐亭相比,副作用更小。15%~20%病人,尤其是垂体大腺瘤病人,控制高泌乳素血症需要的剂量比传统剂量(≥2 mg/周)更高,可能需要≥3.5mg/周,有报道4.5mg每周治疗肿瘤囊性变的报道。高达83%的患者效果良好。10%的PRL患者对卡麦角林有抵抗。其副作用有:恶心(高达1/3的患者),直立性低血压(1/4),瓣膜和胸膜、腹膜后纤维化,成瘾和强迫行为,垂体卒中,鼻漏,视野障碍(视交叉下垂所致)等。
卡麦角林抵抗定义:在每周2mg的剂量时,泌乳素水平未达正常,肿瘤体积减少未达50%。
Tips: 多巴胺受体激动剂可以控制肿瘤生长,改善泌乳素水平,但是不能治愈肿瘤,部分患者需要终生服药,患者及主治医师需要权衡利弊、制定个体化治疗方案;随着手术技术的发展,对于不想终生服药的病人来说,手术也是一个合理的选择。
在年轻患者中对DA抵抗的垂体瘤病例与年龄、更高的泌乳素水平、肿瘤大小等相关。


上三图:垂体巨腺瘤使用DA后基本消失。
![]()
妊娠期间的用药
溴隐亭和卡麦角林均证实为妊娠期间安全有效的选择。妊娠期间使用这两种多巴胺受体激动剂与正常人比较并不增加流产、异位妊娠及胎儿畸形的风险。尽管如此,由于生育年龄垂体泌乳素腺瘤病人最重要的担心是多巴胺受体激动剂对胎儿生长的影响,通常建议服用药物的病人一旦确认怀孕立即停止服药,限制胎儿潜在接触药物时间只有3~4周。
如果肿瘤扩大导致头痛、视野缺损等相关症状,治疗方案多会重新定制。如果出现多巴胺受体治疗无效且视野缺损进行性加重等情况,可考虑经鼻垂体腺瘤切除术或引产。药物与手术治疗各有利弊,因人而异。
血泌乳素水平监测应在产后3个月进行,MRI检查应在泌乳结束后2周进行。
![]()
停药与复发
停药的安全性与停药的最佳时间尚有争议。
多巴胺受体激动剂停药应在持续用药至少2年,高泌乳素水平恢复正常,MRI未见肿瘤(或者肿瘤缩小≥50%,离视交叉≥5mm,没有侵犯海绵窦或其它重要区域),并需要提供临床和生化的随访(2011年欧洲内分泌协会和垂体瘤协会临床实践指南)。
多巴胺受体激动剂应逐渐减量。停药第一年应每隔3个月规律随访一次,以后5年内每年定期随访一次,随访内容包括血泌乳素水平和肿瘤复发情况。垂体泌乳素大腺瘤病人停药后6个月应进行MRI检查,且以后每年复查一次,因为大腺瘤病人复发风险更高。
有研究表明:在微腺瘤患者,停药后和经蝶术后长期缓解率分别是36%、83%;在大腺瘤患者,停药后和经蝶术后长期缓解率分别是28%、60%。经蝶显微镜和内镜手术效果相似。巨腺瘤的研究对比目前罕有报道。但在2021年Soner Cander 等总结了39例巨腺瘤患者的治疗后撰文指出:巨腺瘤患者PRL正常化在DA治疗中是69%,而手术治疗中仅8%(均为药物治疗失败后手术);肿瘤体积缓解率(即体积至少减少50%)在DA治疗是74.4%,在手术治疗是73.9%;所有手术作为一线治疗的患者均没有治愈的结果,均需要术后再服用DA;垂体功能恢复率无论是药物还是手术组均较低,需要激素替代治疗。
患者长期(长期目前被定义为:DA停药后或者术后至少1年)缓解率依肿瘤大小和治疗前泌乳素水平而异,有些患者需要终身服药。女性、微腺瘤(肿瘤大小是更高的变量)、治疗初始的血清泌乳素水平较低、治疗持续期间较长,所有这些有更高可能撤药成功。Colao 等证实在卡麦角林治疗的200个高泌乳素血症患者中,撤药后随访2-5年,用Cox回归分析表明在卡麦角林治疗期间肿瘤的最大直径是撤药后的最后随访中泌乳素水平的最好预测指标;在最大肿瘤直径每增加1mm高泌乳素血症复发的危险率是19%;在非肿瘤性高泌素血症患者、泌乳素微腺瘤患者、泌乳素大腺瘤患者中的高泌乳素血症复发率分别是24%、31%、36%;在复发的患者中,在撤药后第一年、第二年、第三年的复发率分别为56%、33%、11%,之后没有发现复发的;没有一个肿瘤患者发现有肿瘤复发或停药前的肿瘤增大的表现。
微腺瘤、鞍内腺瘤、Ki67 index<3%是提示预后良好的预测因素。
二.PRL瘤的二线治疗——手术治疗。
对于口服药效果不佳或者不愿长期服药的患者可选择手术治疗——开颅或者经鼻蝶手术(显微镜或内镜),手术也具有更佳的成本效益比,具体手术方式依个人经验而已。
PRL瘤手术适应症:
长期、大量的使用多巴胺受体激动剂可能会导致心脏瓣膜病、肿瘤纤维化(导致肿瘤切除不完全)等危害,因此对于不愿长期服药并有较强手术意愿的患者可以选择手术治疗;
对多巴胺受体激动剂抵抗或者不能耐受的PRL患者可选择手术治疗;
囊性肿瘤: 大多对多巴胺受体激动剂无效,多建议手术;
肿瘤占位效应导致颅神经麻痹、视野缺损,药物不能缓解;如出现肿瘤急性卒中可能需要急诊行视神经减压,保存视力视野;
部分巨大肿瘤缩小后出现脑脊液鼻漏,需行脑脊液漏修补术。
对于大的侵袭性PRL出现药物抵抗时可行减瘤手术,手术切除部分肿瘤同样有助于增加肿瘤对DA的敏感性,术后再行口服DA治疗;
经鼻蝶入路切除PRL瘤,能使80%左右微腺瘤病人血泌乳素水平正常,能使60%左右大腺瘤病人血泌乳素水平正常。对于垂体大腺瘤成功率主要取决于肿瘤大小和肿瘤侵犯程度。大泌乳素腺瘤治疗的目的是减瘤而非治愈。国内协和医院曾经报道一组184例男性患者PRL瘤术后回顾,认为:所有的微腺瘤、84.9%的大腺瘤、53.8%的巨腺瘤可以被完全切除,肿瘤增大全切可能性降低;同时对一些预后因素与预测结果做了统计学分析,结果如下图。

预后因素总结(上图译文)。

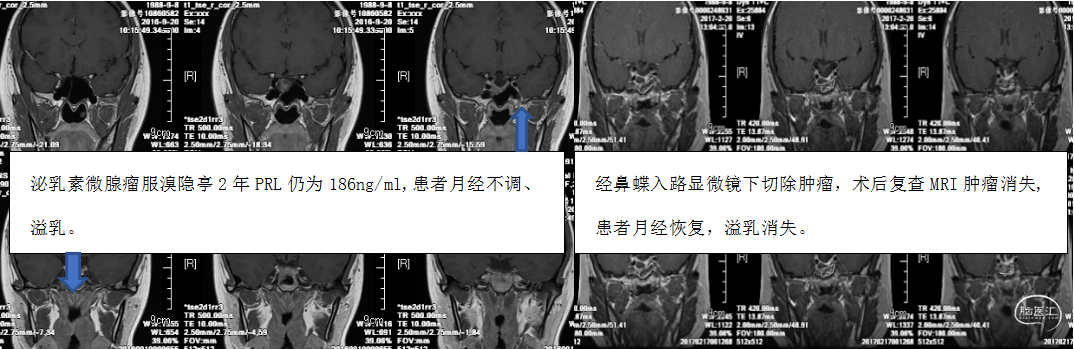
Kyung Rae Cho 等在对服用DA治疗后效果不佳的3例APRL患者行手术治疗后发现鞍上或者海绵窦旁仍有残留灶,无法达到生物学缓解,仍需长期服用DA治疗,并总结原因如下:1)尽管在MRI上没发现肿瘤,但是来自海绵窦或者其它区域的残余肿瘤仍在分泌泌乳素;2)在空蝶鞍形成过程中对下丘脑-垂体轴的损伤。对侵犯到海绵窦的肿瘤手术效果有限,需要联合放射治疗,鉴于放射治疗的副作用,这之前应尽量剂量调整或者换药。
三. PRL瘤的三线治疗——放射治疗。
由于正常垂体组织对放射线相对不敏感而垂体腺瘤大多对射线较为敏感,使得放疗可用于无法通过手术或多巴胺受体激动剂治疗的PRL高泌乳素血症,同时也适用于术后残留、术后复发、侵袭性生长的肿瘤以及特殊部位的肿瘤。放疗主要目的是控制肿瘤生长,其降低血清泌乳素水平的速度慢,且疗效差。
放疗的危害包括垂体机能减退、视神经的损伤、记忆障碍、严重神经功能损伤及继发性恶性肿瘤。有研究表明,伽玛刀对垂体微腺瘤治疗效果确切,伽玛刀治疗后每月应检查一次视力,术后早期视力下降多为水肿造成,可以用糖皮质激素、神经营养药物及脱水剂等保守治疗。
四.PRL瘤的四线治疗——替莫唑胺。
替莫唑胺(TMZ)是一种口服烷基化化疗药物,通常被推荐用于治疗脑癌,如胶质母细胞瘤,目前也被用于难治性垂体腺瘤或垂体癌的治疗。
国内协和医院提出了“难治性垂体腺瘤(refractory adenoma)”的概念并进行完善:1.可以是,也可以不是侵袭性或不典型垂体腺瘤;2.一次或多次手术后,肿瘤仍然复发,肿瘤包绕颈内动脉和神经,或肿瘤质地较韧,手术无法切除肿瘤; 3.对常规药物治疗和放疗均不敏感,甚至肿瘤生长速度加快;4.Ki67>10%。并将TMZ运用到其治疗中取得良好效果,如下图所示。

左两图:巨大侵袭性垂体泌乳素腺瘤包绕颈动脉、海绵窦,历经口服溴隐亭、手术切除、放疗,效果不佳;
右两图:最后加用TMZ治疗后肿瘤消失。
替莫唑胺用于APRL始于2006年,是唯一一种已确定有效治疗APRL的化疗药物,成功改善了无进展生存期(PFS)和总体生存期(OS)。一般认为耐受性良好(最常见的副作用是恶心、疲劳、不同类型的血细胞减少)。有研究表明其在APRL中的治疗效果如下:肿瘤减少76%,血清泌乳素水平降低75%,8%泌乳素恢复正常,受试者失败率为20.6%。反应率高于促肾上腺皮质激素腺瘤(60%)和生长激素腺瘤(26.7%)。

TMZ以口服制剂(胶囊)的形式使用,有不同的剂量,如20、100和250 mg。所有患者第一个周期给予TMZ的标准剂量为150 mg/m2体表面积(BSA),随后的周期给予200 mg/m2, 5/28方案。计算后得到的剂量被四舍五入到最接近的可能强度。累积剂量计算为给定患者接受TMZ的总剂量(每个周期内给药剂量的总和)。早期开始使用该药物有利于更高的反应可能性。
对于如何预测TMZ效果,免疫组化评价细胞周期标记物O6-甲基鸟嘌呤- DNA甲基转移酶(MGMT)是一个很有用的评价指标,具有低至中位MGMT免疫表达的功能性肿瘤患者更有可能对替莫唑胺产生反应。含有甲基化的MGMT基因启动子的患者对TMZ反应良好,正如在胶质瘤中反应良好一样。含有超级甲基化MGMT基因启动子的患者比肿瘤里面含有无甲基化MGMT基因启动子的患者有明显更长的生存时间。Widhalm 等分析了45个非功能性垂体腺瘤的MGMT免疫组化表达表明具有低MGMT表达的非功能性垂体腺瘤是TMZ治疗的潜在候选人,也有研究表明TMZ可用于对传统治疗抵抗的非典型垂体腺瘤。

上表说明MGMT并不是在垂体瘤中决定TMZ敏感性的唯一分子,但是对泌乳素瘤几乎均有效。
MSH6(negative)表达缺失也是TMZ抵抗的原因,保护MSH6功能就很重要。
五.PRL瘤的其它治疗。
在采用替莫唑胺干预后,最近的数据表明,可以选择生长抑素类似物(帕瑞肽pasireotide,可用于肢端肥大症、DA耐药的泌乳素腺瘤)、检查点抑制剂(伊匹单抗ipilimumab, 纳武单抗nivolumab)、酪氨酸激酶抑制剂(TKIs)(拉帕替尼lapatinib)和mTOR抑制剂(依维莫司everolimus)。新近发现ErbB通路与泌乳素瘤侵袭性和DA耐药相关;因此,针对ErbB1 -表皮生长因子受体(EGFR)的口服酪氨酸激酶抑制剂(TKI)拉帕替尼(lapatinib)的治疗正在评估中,已经纳入2a期临床试验。
综上述,PRL瘤的治疗需要综合治疗,尤其是APRL的治疗仍然具有挑战性,多模式治疗是必要的,将其纳入慢病管理,长期随诊及其重要。
参考文献:略。




