
文章来源:中国脑血管病杂志, 2021, 18(11):753-764.
作者:邱雪 薛素芳 宋海庆
基金项目:国家重点研发计划重大慢性非传染性疾病防控研究重点专项(2016YFC1300600);首都卫生发展科研专项(首发2020-2-2014)
通信作者:宋海庆,Email:songhq@ xwhosp.org
摘要:目的 分析急性缺血性卒中合并非瓣膜性心房颤动(NVAF)患者出院时口服抗凝药物使用情况及其影响因素。方法 连续回顾性纳入急性缺血性卒中合并心房颤动患者登记研究(NCT04080830)中2016 年1 月至2020 年12 月首都医科大学宣武医院神经内科收治的急性缺血性卒中合并NVAF 的住院患者702 例,CHA2 DS2 -VASc 评分[NVAF 卒中风险评分:C 为充血性心力衰竭,H 为高血压,A2 为年龄≥75 岁计2 分,D 为糖尿病,S2 为卒中或短暂性脑缺血发作计2 分,V 为血管性疾病,A 为年龄65 ~74 岁,Sc 为性别(女性)]≥2 分,收集患者的一般情况(性别、年龄、体质量指数)、既往史[下肢血管狭窄或闭塞、急性期下肢静脉血栓或肺栓塞、心功能不全、脑梗死和(或)短暂性脑缺血发作、肝病史和(或)肝功能异常]、心脑血管疾病危险因素(冠心病、高血压病、高脂血症、糖尿病、吸烟、饮酒)、相关实验室检查(血红蛋白≤90 g/ L、血肌酐≥200 μmol/ L 等)、量表评分[NVAF 卒中风险评分、出血风险评分、美国国立卫生研究院卒中量表(NIHSS)评分、改良Rankin 量表(mRS)评分]、出院时抗栓药物使用情况以及有无大面积脑梗死、梗死后出血转化、共存颅内外血管狭窄、急性期非主要出血、急性期大出血、医疗保险报销范围等。依据年份分层,即2016、2017、2018、2019、2020 年,对各年份急性缺血性卒中合并NVAF 患者出院时抗栓药物使用占比及趋势进行比较。根据新型口服抗凝药(NOACs)纳入医疗保险系统分为医保前(2016—2017 年)组与医保后(2018—2020 年)组,对相关数据进行对比分析。分析急性缺血性卒中合并NVAF 患者出院时抗凝药物使用情况及其变化趋势,并分析NOCAs 进入医疗保险系统后,对影响出院时口服抗凝药物使用情况的相关因素。比较不同抗凝药物出血事件发生率。医疗保险范围包括农村合作医疗报销、城镇医疗保险报销和职工医疗保险报销。抗栓治疗包括抗凝及抗血小板聚集治疗。CHA2 DS2 -VASc 评分≥2 分者均首选抗凝治疗,包括口服华法林、NOACs 及低分子肝素;对于应首选抗凝治疗,但因年龄>80 岁、出血风险高的患者,经与其沟通表示拒绝抗凝治疗或对抗凝药物过敏者则给予抗血小板聚集治疗,包括口服阿司匹林肠溶片、硫酸氢氯吡格雷片。经沟通拒绝抗栓治疗、对抗栓药物过敏、出院时仍有症状性出血转化、致命性出血等以上症状之一者,不予抗栓治疗。结果 (1)2016、2017、2018、2019、2020 年抗栓药物治疗使用占比分别为66. 1% (74 /112)、75. 3% (113 /150)、84. 9% (107 /126)、83. 9% (161 /192)、77. 9% (95 /122),不同年份急性缺血性卒中合并NVAF 患者出院时抗栓药物使用占比的差异有统计学意义(χ2 =29. 83,P <0. 05)。抗凝药物的使用率大幅度上升,从2016 年22. 3% (25 /112)至2018 年50. 0% (63 /126),之后趋于平稳;无抗栓药物使用占比呈下降趋势;抗血小板聚集药物的使用趋于平稳状态。(2)2016、2017、2018、2019、2020 年抗凝药物使用占比分别为22. 3% (25 /112)、40. 7% (61 /150)、50. 0% (63 /126)、47. 9% (92 /192)、44. 3% (54 /122),5 年间不同抗凝药物的使用的变化趋势有统计学意义(χ2 = 66. 87,P < 0. 05),2016 年至2018 年NOACs呈大幅上升,从2016 年的36. 0% (9 /25)至2018 年的88. 9% (56 /63),之后趋于平稳;低分子肝素及华法林的使用呈大幅下降,2018 年后均处于平稳状态。(3)2018 年NOACS 进入医疗保险,对比医疗保险前后抗栓占比差异有统计学意义(χ2 = 18. 37,P < 0. 01),抗凝药物从32. 8% (86 /262)提高到47.5% (209 /440);抗凝药物种类占比亦有统计学意义(χ2 = 62. 90,P < 0. 01),NOACS 在由39. 5%(34 /86)提高到83. 3% (174 /209)。(4)多因素Logistic 回归分析结果显示,年龄≥75 岁(OR =2.315,P <0.01)、共存颅内外血管狭窄(OR =1. 674,P =0. 016)、大面积梗死比例(OR = 1.914,P =0. 014)、梗死后出血转化(OR =3. 374,P <0. 01 )和急性期非主要出血(OR = 2. 872,P = 0. 020)是出院时使用抗凝药物的独立影响因素。3 种抗凝药物应用后的出血事件发生率均较低,且差异无统计学意义(P >0. 05)。结论 自2018 年NOACs 进入医疗保险后,NOACs 的应用可以明显提高急性缺血性卒中合并NVAF 患者出院时的抗凝药物使用率及NOACs 在抗凝药物中的占比。高龄、共存颅内外血管狭窄、大面积梗死比例、梗死后出血转化及急性期非主要出血是不利于出院时抗凝药物使用的主要因素,加强出院患者随访是将来提升急性缺血性卒中合并NVAF 患者的二级预防管理的重要因素。
心房颤动是卒中主要危险因素之一,与非心房颤动患者相比,心房颤动患者卒中总体发生风险可增高5 倍[1]。研究表明,抗凝治疗能降低心房颤动患者近70% 的卒中风险,降低25% 的全因死亡风险[2]。但在真实世界临床应用中,心房颤动患者抗凝药物使用存在严重不足[3]。孙艺红和胡大一[4]报道的非瓣膜病心房颤动患者全球抗凝注册研究中国亚组基线数据分析研究表明,全球仍有40%符合条件的患者并未充分使用口服抗凝药,尤其在我国,这个问题较为明显。一项来自我国2012—2013 年的登记研究结果显示,急性缺血性卒中合并非瓣膜性心房颤动(nonvalvular atrial fibrillation,NVAF)患者作为二级预防人群,其出院时使用抗凝药物(华法林)的比例仅为19. 8% [5]。医师对华法林高出血风险的担心及华法林治疗窗的限制、需定期监测及其与药物和食物相互的影响等,均使其依从性较差,而致使用率低[6]。近年来,有临床研究证据表明,非维生素K 拮抗剂口服抗凝药在预防NVAF 栓塞事件方面的安全性及药物动力学均优于华法林[7-10]。2018 年新型口服抗凝药(new oral anticoagulants,NOACs)开始进入我国医疗保险系统,但关于急性缺血性卒中患者出院时二级预防策略中抗凝药物使用情况和进入医疗保险系统前后的变化以及抗凝药物规范使用的影响因素的研究尚未见相关报道。因此,本研究通过分析2016—2020 年我院急性缺血性卒中合并NVAF 患者出院时抗凝治疗情况,旨在探讨NOACs对急性缺血性卒中合并NVAF 患者二级预防中抗凝治疗的变化及抗凝治疗的影响因素,以期为指导和优化NVAF 患者二级预防的抗凝管理提供参考。
1 对象与方法
1.1 对象
连续回顾性纳入急性缺血性卒中合并心房颤动患者登记研究(NCT04080830)中2016 年1 月1 日至2020 年12 月31 日首都医科大学宣武医院神经内科收治的急性缺血性卒中合并NVAF 的住院患者702 例,其中男430 例(61. 3%),女272 例(38. 7% );年龄46 ~ 98 岁,平均(72 ± 6);年龄≥75 岁者315 例(44. 9%);体质量指数18 ~27 kg/ m2,平均(25 ±4)kg/ m2;冠心病史301 例(42. 9%),高血压病史469 例(66.8%),高脂血症史341 例(48. 6% ),糖尿病史269 例(38. 3% ),下肢血管狭窄或闭塞史35 例(5. 0% ),脑梗死和(或)短暂性脑缺血发作史180 例(25. 6% ),吸烟史242 例(34. 5% ),饮酒史191 例(27. 2% ),肝病史和(或)肝功能异常史8 例(1.1%);2016年112例,2017年150例,2018年126例,2019 年192 例,2020 年122 例。本项研究方案经首都医科大学宣武医院伦理委员会审核通过(伦理号:临研审[2020]093 号),患者或及其家属签署了诊疗知情同意书。
纳入标准:(1)年龄≥18 岁;(2)首次确诊为急性缺血性卒中合并NVAF,并经头部CT 和(或)头部MRI 检查、心电图、24 h 动态心电图证实[11-12];(3)急性缺血性卒中发生在7 d 内;(4)资料完整;(5)CHA2 DS2 -VASc 评分[NVAF 卒中风险评分:C 为congestive heart failure(充血性心力衰竭),H 为hypertension(高血压),A2 为age≥75(doubled)(年龄≥75 岁计2 分),D 为diabetes mellitus(糖尿病),S2 为stroke(doubled)(卒中或短暂性脑缺血发作计2 分),V 为vascular disease(血管性疾病),A 为age65 ~74(年龄65 ~74 岁),Sc 为sex category(female)性别(女性)]≥2 分。排除标准:(1)非血管性病因导致的缺血性卒中,脑静脉或静脉窦血栓形成,脑部原发或转移性肿瘤;(2)风湿性心脏瓣膜病及其他瓣膜性心脏病、扩张型心肌病、心脏瓣膜置换术后;(3)可逆性病因引起的心房颤动,经治疗后心房颤动无反复;(4)妊娠、哺乳期女性。
2 研究方法及评价标准
1. 2. 1 研究方法:收集患者的一般情况(性别、年龄、体质量指数)、既往史[下肢血管狭窄或闭塞、急性期下肢静脉血栓或肺栓塞、心功能不全、脑梗死和(或)短暂性脑缺血发作、肝病史和(或)肝功能异常]、心脑血管疾病危险因素(冠心病、高血压病、高脂血症、糖尿病、吸烟、饮酒)、相关实验室检查(血红蛋白≤90 g/ L、血肌酐≥200 μmol/ L 等)、量表评分[NVAF 卒中风险评分、出血风险评分、美国国立卫生研究院卒中量表(NIHSS)评分、改良Rankin 量表(mRS)评分]、出院时抗栓药物使用情况以及有无大面积脑梗死、梗死后出血转化、共存颅内外血管狭窄、急性期非主要出血、急性期大出血、医疗保险报销范围等。
依据年份分层,即2016、2017、2018、2019、2020 年,对各年份急性缺血性卒中合并NVAF 患者出院时抗栓药物使用占比及趋势进行比较。根据NOACs 纳入医疗保险系统时间分为医保前(2016—2017 年)组与医保后(2018—2020 年)组,对相关数据进行对比分析。分析急性缺血性卒中合并NVAF 患者出院时抗凝药物使用情况及其变化趋势,并分析NOCAs进入医疗保险系统后,影响出院时口服抗凝药物使用情况的相关因素。比较不同抗凝药物出血事件发生率。
1.2.2 评价方法及标准:急性缺血性卒中的诊断依据《中国急性缺血性脑卒中诊治指南2018》[11],即急性起病,多数存在局灶性神经功能缺损(少数为全面性),影像学出现责任病灶,症状和(或)体征持续24 h 以上;排除非血管性病因;头部CT 和(或)MRI排除了脑出血。NVAF 的诊断依据文献[12]标准,即无风湿性二尖瓣狭窄、机械或生物瓣膜或修复术后的心房颤动。糖尿病的诊断依据《中国2 型糖尿病防治指南(2020 年版)》,即既往糖尿病史,空腹血糖≥7.0mmol/ L和(或)餐后2h血糖≥11.1mmol/ L[13]。高血压病的诊断依据《中国高血压防治指南(2018年修订版)》,即既往高血压病史,入院时正服用抗高血压药物;或入院后非同日3 次测量血压收缩压≥140 mmHg 和(或)舒张压≥90 mmHg[14]。冠心病的诊断依据文献[15]标准,即既往有明确的病史或有冠心病症状及典型心电图表现。心力衰竭的诊断依据《中国心力衰竭诊断和治疗指南2018》,既往有明确病史或入院后心脏彩色多普勒超声示射血分数< 50% [16]。吸烟定义为吸烟量≥1 支/ d,持续≥6 个月[17]。饮酒定义为男性饮用乙醇量≥40 g/ d,女性≥20 g/ d,或2 周内大量(乙醇量≥80 g/ d)饮酒,且持续≥5 年[18]。肝功能异常定义为丙氨酸转氨酶或天冬氨酸转氨酶超过正常值的3 倍[18]。
下肢动脉狭窄或闭塞的评估依据文献[19]标准,下肢动脉彩色多普勒示血管狭窄率≥50%或下肢动脉无血流信号分别为下肢动脉狭窄、闭塞。大面积脑梗死的评估标准为影像学示梗死灶为大脑半球病变,梗死最大直径> 5 cm,且同时累及2 个或以上脑叶,或病灶范围>同侧脑组织的2 /3[20]。
急性期大出血定义为在卒中发病1 个月内,符合以下任一项[21]:(1)血红蛋白下降> 20 g / L;(2)输注全血或浓缩红细胞成分血≥2 个单位;(3)关键部位出血(颅内、气道、胸腹腔、肌肉、关节腔内、心包等部位出血);(4)致命性出血定义为出血量大,可造成严重低血压或休克,甚至死亡,需要紧急救治;出血量少,但部位特殊,可致残或危及生命,如心脏压塞等[22]。急性期非主要出血定义为在卒中发病1 个月内,不符合大出血标准的其他出血,如黏膜、牙龈、尿道、胃肠道出血等[23]。共存颅内外血管狭窄是指影像学显示,颅内外动脉狭窄率≥50% [24]。急性期下肢静脉血栓是指在卒中1 个月内,下肢突发肿胀且静脉彩色多普勒超声示可见栓子[25]。梗死后出血转化定义为脑梗死后,首次头部CT 和(或)MRI 未发现出血,而再次头部CT 和(或)MRI 结果可见颅内出血,或根据首次头部CT 结果即可确定脑梗死[26]。
根据研究报道,年龄≥75 岁者NVAF 患病率可达10% ,建议将75 岁作为分组标准[27]。所以,本研究的年龄分界为75 岁。本研究中的医疗保险范围包括农村合作医疗报销、城镇医疗保险报销和职工医疗保险报销。
出院时,采用NIHSS 评价神经功能缺损严重程度,其总分0 ~ 42 分,分值越高提示梗死面积、出血转化风险越大,且预后不良[28];采用mRS 评分对临床结局进行评估,mRS 评分< 3 分为结局良好,3 ~5 分为残疾,6 分为死亡[29];采用CHA2 DS2 -VASc 评分评估心房颤动卒中风险,包括高血压、心力衰竭、糖尿病、女性、血管性疾病、年龄65 ~ 74 岁分别记1 分,年龄≥75 岁、卒中或短暂性脑缺血发作史分别记2 分,该评分总分为0 ~ 9 分,当评分≥2 分给予口服抗凝药物治疗[12];采用HAS-BLED 评分[出血风险评分:H 为hypertension(高血压),A 为abnormal renal and liver function (肝肾功能),S 为stroke(卒中),B 为bleeding(出血),L 为labile INRs(国际标准化比值不稳定),E 为elderly(年龄>65 岁),D 为drugs or alcohol(药物或酒精)]评价药物抗凝的出血风险,总分为0 ~ 9 分,包括血压、肝肾功能、年龄、出血史、药物等方面,评分0 ~ 2 分为较低的出血风险,评分≥ 3 分提示有极大的出血可能[30]。
1.3 抗栓治疗策略
本研究所指抗栓治疗包括抗凝及抗血小板聚集治疗。参照《中国心源性卒中防治指南(2019)》[31],凡CHA2 DS2 -VASc 评分≥2 分者均首选抗凝治疗,包括口服华法林(1 ~ 3 mg/ d,根据国际标准化比值调整剂量)、NOACs[利伐沙班20 mg/ d(体质量<50 kg 或年龄>75 岁者的剂量为15 mg/ d)、达比加群110 mg/次2次/ d]及低分子肝素(5 000 IU/12 h);对于应首选抗凝治疗,但因年龄> 80 岁、出血风险高的患者,经充分沟通表示拒绝抗凝治疗或对抗凝药物过敏者则给予抗血小板聚集治疗,包括口服阿司匹林肠溶片(100 mg/ d)、硫酸氢氯吡格雷片(75 mg/ d)。经沟通拒绝抗栓治疗、对抗栓药物过敏、出院时仍有症状性出血转化、致命性出血等以上症状之一者,不予抗栓治疗[26]。
1.4 统计学分析
采用SPSS 25. 0 统计软件对数据进行统计学分析。采用Kolmogorov-Smirnov 检验对计量资料进行正态性分析,符合正态分布的计量资料采用x- ± s 表示,非正态分布的计量资料采用中位数和四分位数[M(P25,P75 )]表示。计数资料采用例数和百分数[例(% )]表示,组间比较采用χ2 检验。正态分布的计量资料组间比较采用t 检验,多组比较采用F检验;非正态分布的计量资料组间比较采用Mann-Whitney U 检验,多组比较采用多因素方差分析。以出院时服用抗凝药物作为因变量,以单因素分析时P < 0. 05 的变量为自变量,进行多因素Logistic 回归分析。以P < 0. 05 为差异具有统计学意义。
2 结果
2. 1 急性缺血性卒中合并NVAF 患者总体情况
出院时,702 例急性缺血性卒中合并NVAF 患者的NIHSS 评分为0 ~ 42 分,中位评分4. 0(1.0,12.0)分;mRS 评分为0 ~ 5 分,中位评分3. 0(1.0,4.0)分;CHA2 DS2 -VASC 评分为2 ~ 10 分,中位评分6. 0(4.0,7.0)分;HAS-BLED 评分为1 ~ 6 分,平均(3. 1 ±1. 0)分。
出院时,702 例急性缺血性卒中合并NVAF 患者中,大面积脑梗死229 例(32. 6% ),急性期下肢静脉血栓或肺栓塞94 例(13. 4% ),心功能不全164 例(23. 4% ),梗死后出血转化158 例(22. 5% ),共存颅内外血管狭窄325 例(46. 3% ),急性期非主要出血70 例(10. 0% ),急性期大出血50 例(7. 1% );未使用抗栓治疗者152 例(21. 7% ),单纯使用抗血小板聚集治疗者255 例(36. 3% ),抗凝治疗为295 例(42. 0% )。在295 例抗凝治疗患者中,单纯抗凝284 例,抗凝联合抗血小板聚集治疗11 例;应用抗凝药物由多至少依次为NOACs[208 例(70.5% ),其中达比加群56 例、利伐沙班152 例]、低分子肝素[51 例(17. 3% )]、华法林[36 例(12. 2% )]。
2. 2 出院时不同年份抗栓药物使用占比及变化趋势
2016、2017、2018、2019、2020 年抗栓药物治疗使用占比分别为66. 1% (74 /112)、75. 3% (113 /150)、84. 9% (107 /126)、83. 9% (161 /192)、77. 9% (95 /122),不同年份急性缺血性卒中合并NVAF 患者出院时抗栓药物使用占比的差异有统计学意义(χ2 =29. 83,P < 0. 05)。出院时,抗凝药物使用趋势显示,2016—2018 年抗凝药物使用占比呈上升趋势,于2018 年达最高点[50. 0% (63 /126)],之后相对平稳;未使用抗栓药物的趋势显示,2016—2018 年未使用抗栓药物占比呈下降趋势,于2018 年达最低点[15. 1% (19 /126)],之后相对平稳;抗血小板聚集药物使用趋势显示,总体趋于平稳状态,于2016 年使用占比为最高点[43. 8% (49 /112)],2020 年使用占比为最低[33. 6% (41 /122)]。见图1。
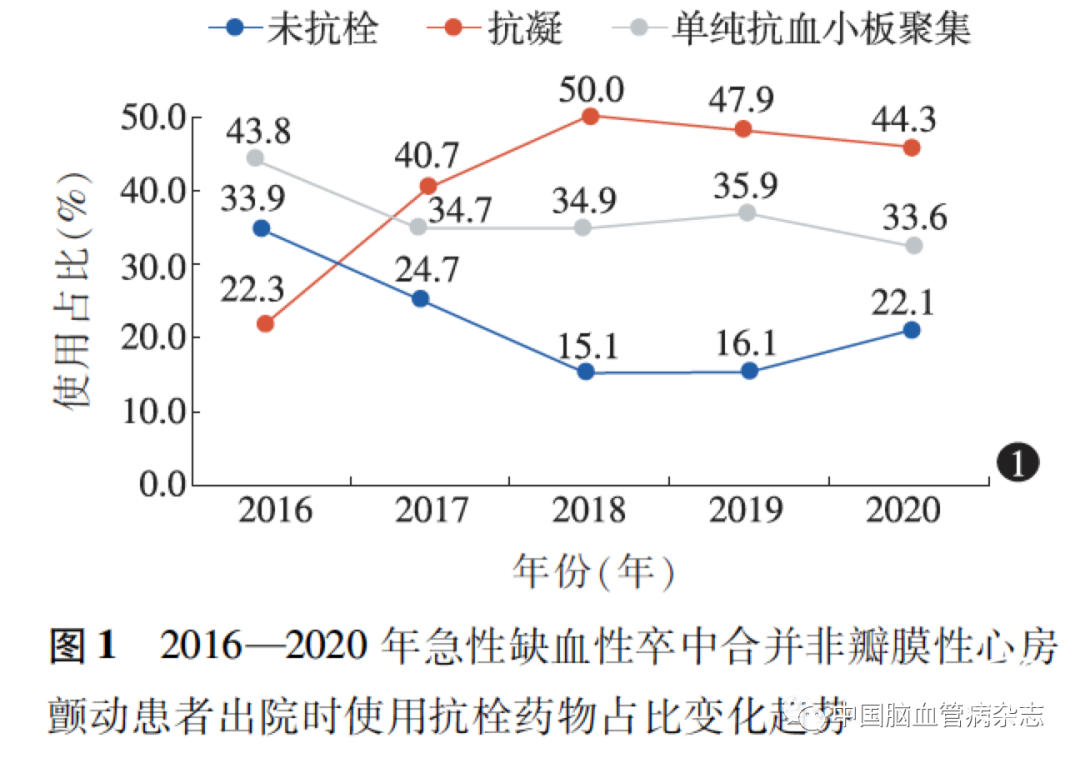
2. 3 纳入医疗保险系统前后抗栓药物使用占比比较
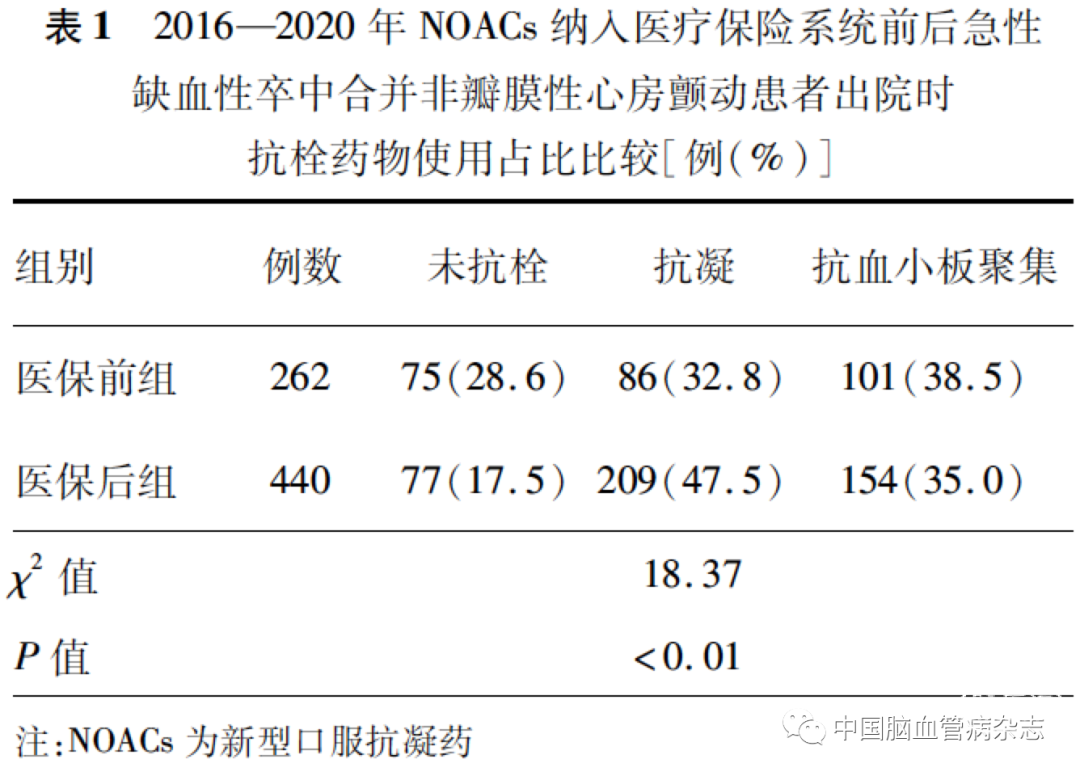
医保前组,抗血小板聚集治疗使用占比最高;医保后组,抗凝治疗使用占比最高。两组抗栓药物使用占比的差异有统计学意义(P <0. 01)。见表1。
2. 4 出院时不同年份不同抗凝药物种类使用占比及变化趋势
2016、2017、2018、2019、2020 年抗凝药物使用占比分别为22. 3% (25 /112 )、40. 7% (61 /150 )、50.0% (63 /126)、47. 9% (92 /192)、44. 3% (54 /122),不同年份急性缺血性卒中合并NVAF 患者出院时抗凝药物使用占比的差异有统计学意义(χ2 =66. 87,P <0. 05)。出院时,NOACs 的使用总体呈上升趋势,于2018 年达最高点[88. 9% (56 /63)];低分子肝素及华法林的使用总体均呈下降趋势,低分子肝素于2018 年达最低点[6. 3% (4 /63)],华法林于2020 年达最低点[1. 9% (1 /54)]。见图2。
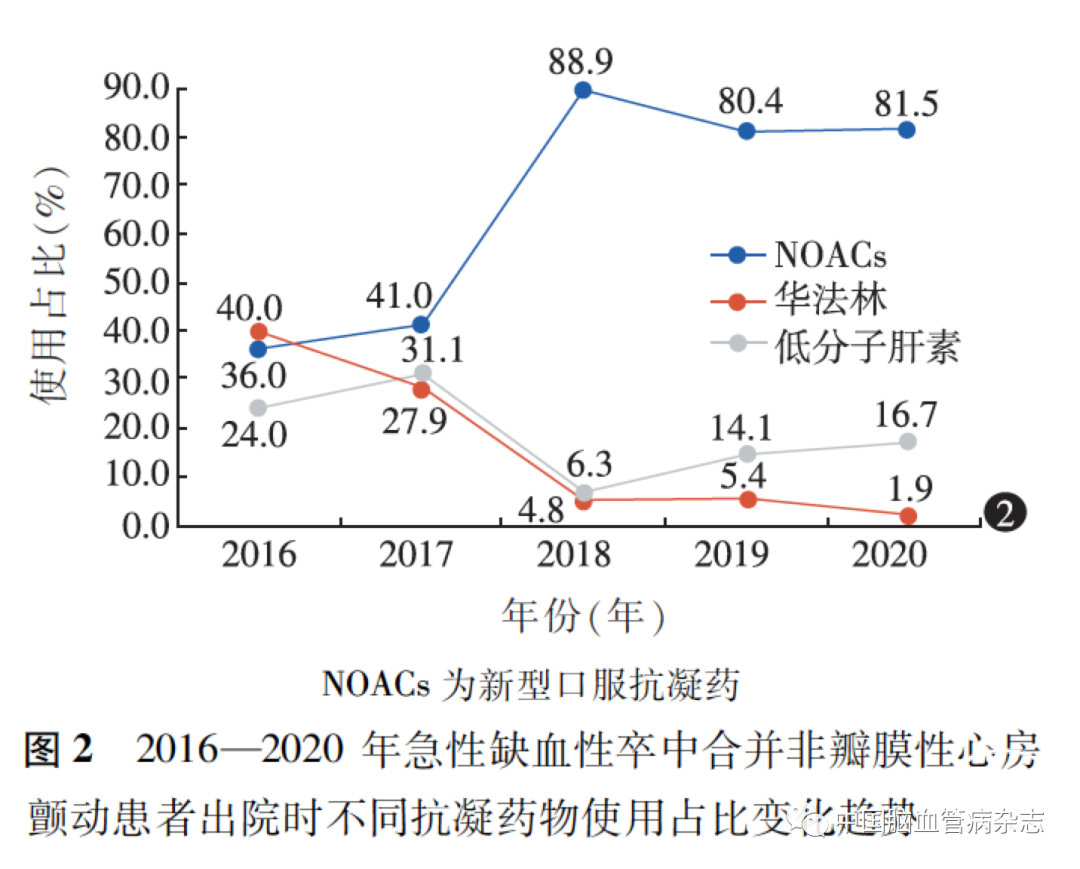
2. 5 纳入医疗保险系统前后抗凝药物使用情况比较
医保前组与医保后组,NOACs 的使用占比均为最高,两组抗凝药物使用占比的差异有统计学意义(P <0. 01)。见表2。

2. 6 纳入医疗保险系统后影响出院时口服抗凝药物使用的单因素分析
出院时,未口服抗凝药物者中年龄≥75 岁、大面积脑梗死、共存颅内外血管狭窄、梗死后出血转化、急性期大出血、急性期非主要出血的比例高于口服抗凝药物者,二者间差异均有统计学意义(均P <0. 01)。余变量间的差异均无统计学意义(均P >0.05)。见表3。
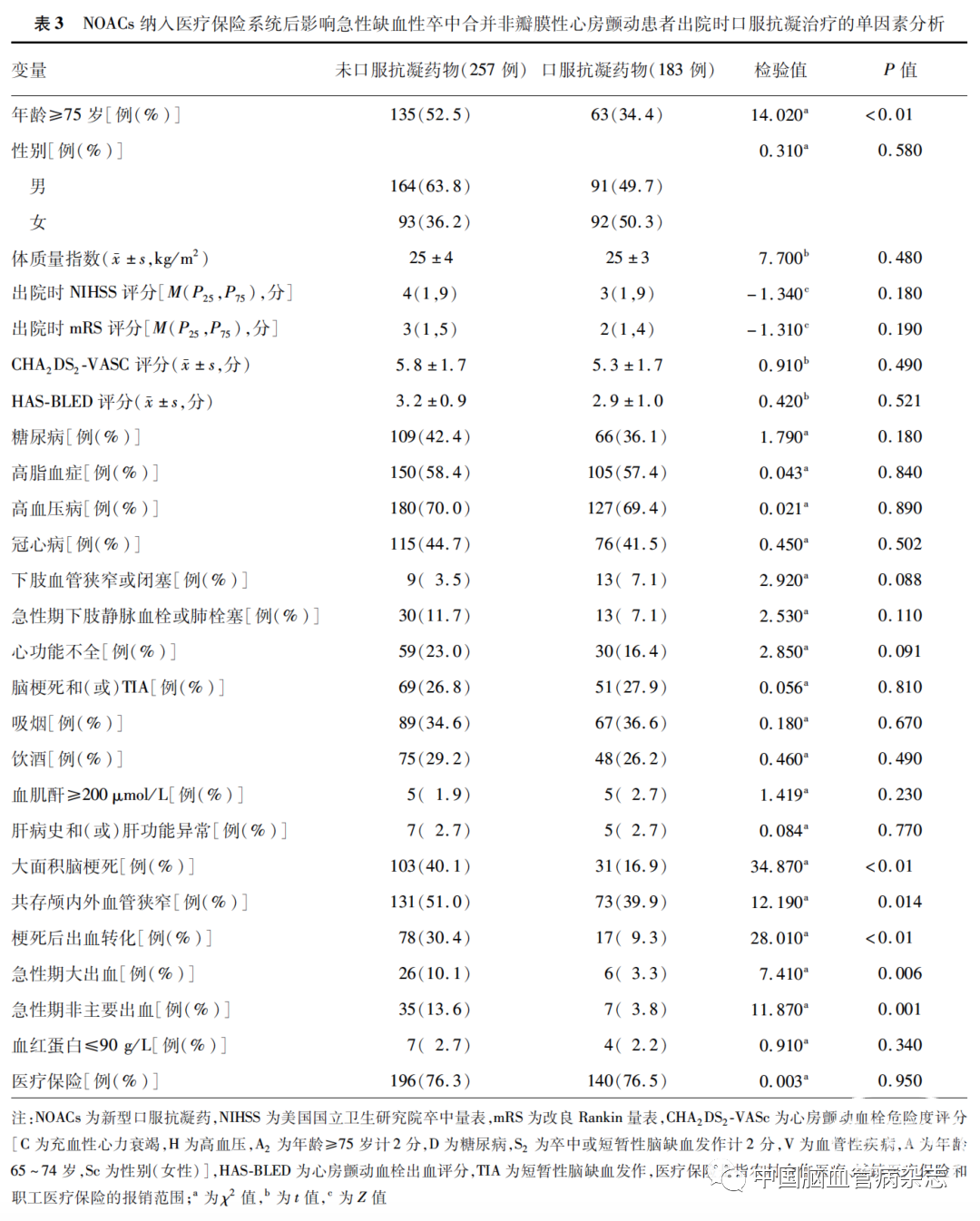
2. 7 NOACs 进入医疗保险系统后影响出院时口服抗凝治疗的多因素Logistic 回归分析
以出院时口服抗凝药物为因变量,以年龄≥75 岁、大面积脑梗死、共存颅内外血管狭窄、梗死后出血转化、急性期大出血、急性期非主要出血为自变量进行二元Logistic 回归分析,结果显示,年龄≥75 岁、共存颅内外血管狭窄、大面积脑梗死、梗死后出血转化和急性期非主要出血是影响口服抗凝药物使用的独立危险因素(均P < 0. 05),而急性期大出血与使用口服抗凝药物无关(P >0. 05)。见表4。
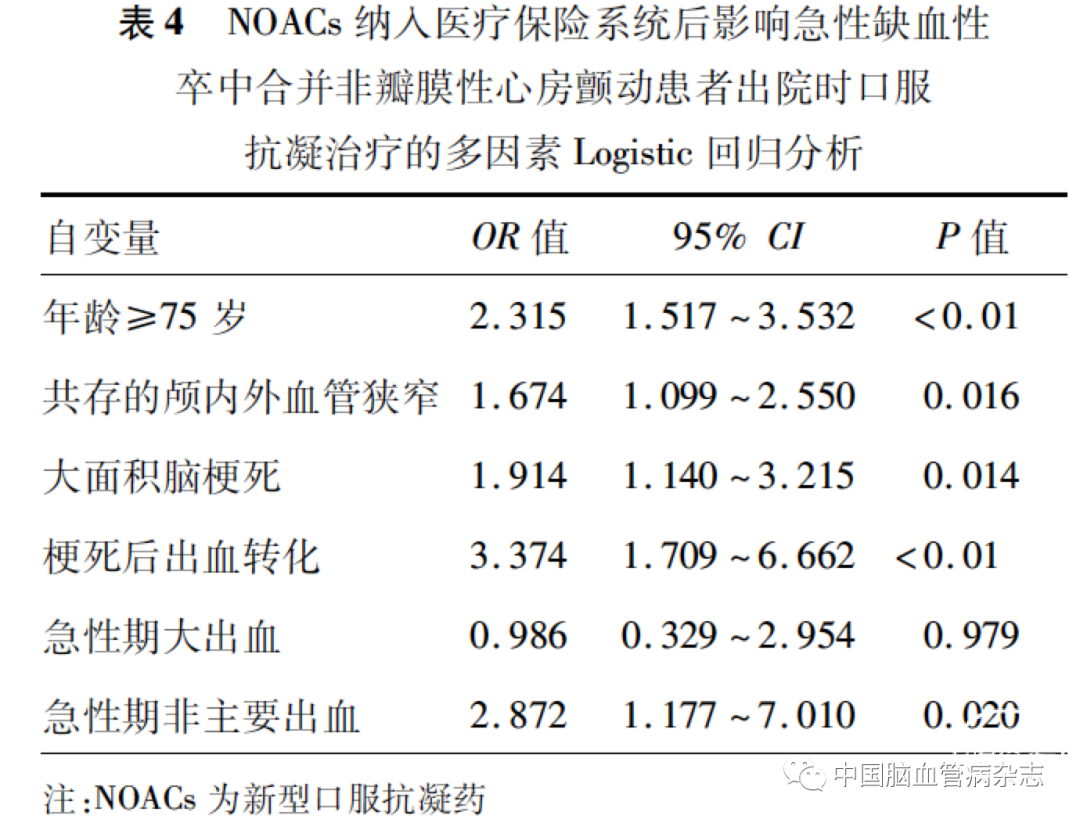
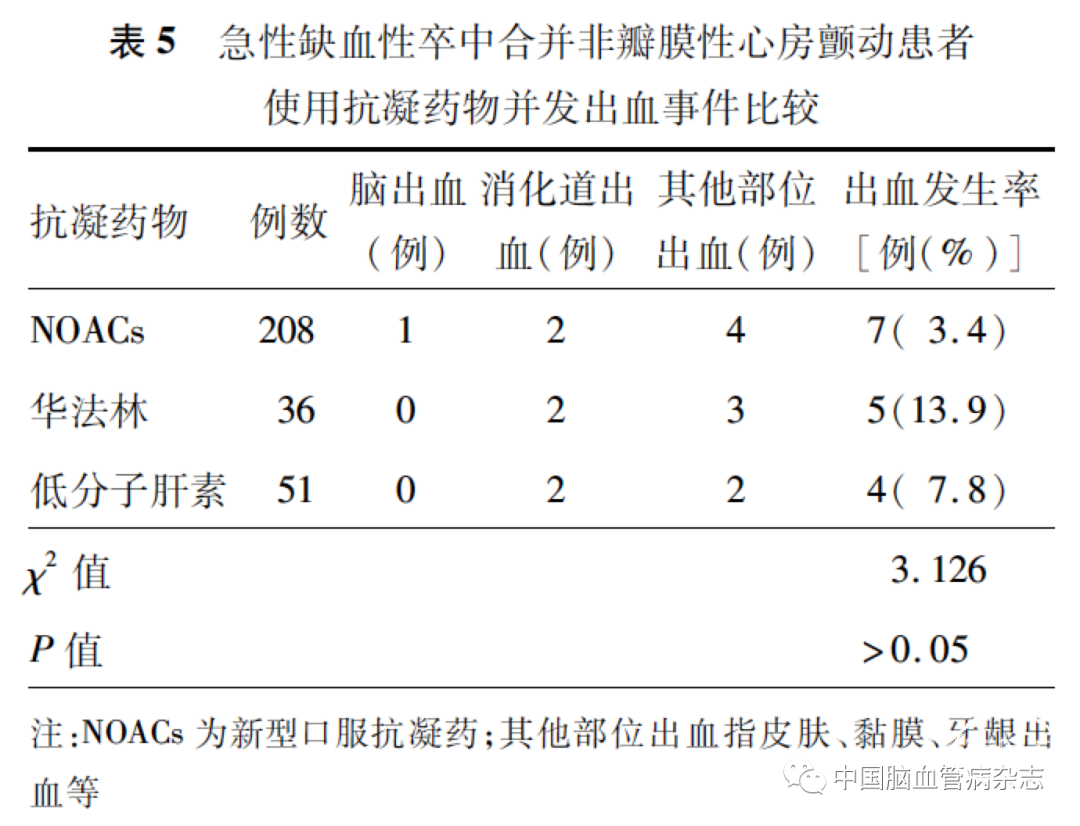
2. 8 不同抗凝药物出血事件发生率比较
2016—2020 年,使用NOACs、华法林和低分子肝素的出血事件发生率分别为3. 4% 、13. 9% 和7.8% ,3 种抗凝药物间出血发生率的差异无统计学意义(P > 0. 05)。见表5。使用NOACs 的患者中,仅1 例服用利伐沙班后出现严重脑出血事件,该患者为高龄,且合并感染、中度肾功能不全、低蛋白血症,同时应用胺碘酮,存在血压控制不良等多种因素。
3 讨论
既往研究显示,我国2012—2013 年急性缺血性卒中合并NVAF 的住院患者出院时使用抗凝药物(华法林)的比例仅为19. 8% [5]。华法林高出血风险以及使用上的不方便性是限制卒中合并NAVF 患者使用抗凝治疗的主要因素。多项研究结果表现,NOACs(达比加群、利伐沙班等)抗凝疗效明显优于或不低于华法林,且出血事件发生率较低、无需监测国际标准化比值[9,32],因而受到临床指南的推荐。2015 年NOACs 增加了适应证并开始在中国应用于心脑血管疾病的治疗,于2018 年进入中国医疗保险报销系统[33]。因此,本研究对急性缺血性卒中患者二级预防出院时抗凝药物实际使用情况进行分析。出院时不同年份抗栓药物使用变化趋势中,抗凝药物使用趋势显示,2016—2018 年抗凝药物使用占比呈上升趋势,由2016 年的22. 3% (25 /112)升至2018 年的50. 0% (63 /126),且达最高点,之后相对平稳。NOACs 纳入医疗保险系统前后,在抗凝药物使用种类中,NOACs 的使用占比均最高(医保前后组分别为39. 5% 、83. 3% ),而纳入医疗保险系统后,华法林及低分子肝素使用占比下降,两组抗凝药物使用占比的差异有统计学意义(P < 0. 01)。纳入医疗保险系统前后抗栓药物种类使用占比显示,医保后组抗凝治疗使用占比最高[47. 5% (209 /440)],与医保前组比较,差异有统计学意义(P <0.01)。本研究结果表明,NOACs 纳入医疗保险系统后提高缺血性卒中合并NVAF 患者出院时二级预防抗凝治疗的比例。且NOACs 使用上的便捷性及其安全性和有效性也获得了多项研究结果的支持[34-37]。
同时,本研究结果显示,2018、2019、2020 年出院时抗凝治疗比例未进一步提升,分别为50. 0% 、47. 9% 、44. 3% ,远低于以前2009—2011 年美国GWTG(get with the guidelines)-卒中项目中对心房颤动患者的报道,即因卒中入院前未曾接受抗凝治疗,出院时抗凝治疗比例为88% [38]。另外,本研究2016—2018 年出院时抗血小板聚集药物使用趋势显示,总体趋于平稳状态,于2016 年使用占比为最高点(43. 8% ),尽管2018 年较之前有所下降,但2018—2020 年未进一步下降,2020 年使用占比为最低,仍有33. 6%的患者在出院时使用抗血小板聚集药物。虽然有研究表明,对NVAF 患者的卒中预防,采用抗血小板聚集药物的作用有限[39],但对于影响二级预防抗凝治疗的因素尚未明确。本研究对NOACs 纳入医疗保险系统后出院时口服抗凝药物使用影响因素进行分析发现,未口服抗凝药物患者中年龄≥75 岁、大面积脑梗死、共存颅内外血管狭窄、梗死后出血转化、急性期大出血、急性期非主要出血的比例高于口服抗凝药物者(均P < 0. 01),进一步多因素分析显示,年龄≥75 岁、共存颅内外血管狭窄、大面积脑梗死、梗死后出血转化和急性期非主要出血是影响口服抗凝药物使用的独立危险因素(均P <0. 05)。
高龄是急性缺血性卒中合并NVAF 患者的重要特点,本研究急性缺血性卒中合并NVAF 患者的平均年龄为(72 ± 6)岁,与文献报道[40-41]一致。高龄(年龄≥75 岁)是导致患者抗凝不足的主要危险因素[42],本研究结果显示,NOACs 广泛应用于临床后,年龄≥75 岁是不利于二级预防患者出院时口服抗凝的主要因素之一。另有研究认为,高龄NVAF 患者抗凝较非抗凝能够获益[43],而使用NOACs 较华法林获益[44],并且老年NVAF 患者因卒中和出血的绝对风险更高,使用NOACs 较华法林的优势在老年人群中随年龄增长表现更为明显[45]。因此,在无其他影响抗凝因素的情况下,二级预防出院时口服抗凝治疗也可考虑应用于老年患者,尤其使用NOACs进行抗凝治疗,应是改善二级预防管理的重要途径之一。但鉴于老年患者容易合并肾功能下降,选择合理的药物剂量也是安全性管理的重要内容。
既往研究提示,缺血性卒中合并NVAF 患者常见伴动脉粥样硬化危险因素,同时伴颅内外血管狭窄的比例也较高[46]。本研究结果显示,702 例急性缺血性卒中合并NVAF 患者中,合并冠心病者301 例(42. 9% )、高血压病469 例(66. 8% )、高脂血症者341 例(48. 6% )、糖尿病269 例(38. 2% )、下肢动脉狭窄或闭塞者35 例(5. 0% )、共存颅内外血管狭窄325 例(46. 3% ),与既往研究报道的数据一致[47]。本研究发现,共存颅内外血管狭窄是不利于出院时口服抗凝治疗的因素之一,该类患者在临床中更倾向于应用抗血小板聚集治疗[48]。急性缺血性卒中合并NVAF 与责任血管动脉粥样硬化性狭窄的卒中机制在临床上难以绝对分辨,对此,尤其对于倾向于动脉粥样硬化发病机制的患者,二级预防究竟应使用抗血小板聚集还是抗凝药物仍有待进一步研究证实[49]。但是症状性颅内动脉疾病华法林-阿司匹林研究(warfarin-Aspirin symptomatic intracranialdisease study,WASID)表明,对于缺血性卒中合并颅内血管狭窄患者,华法林与阿司匹林对于缺血性卒中预防同样有效[50]。有研究建议对于合并NVAF的患者,不管是否合并责任血管动脉粥样硬化性狭窄,抗凝药物应作为长期二级预防治疗的选择[51-52]。因此,对于同时合并共存颅内外血管狭窄和NVAF的缺血性卒中患者,选择抗凝治疗而非抗血小板聚集治疗也是提升急性缺血性卒中合并NVAF 患者二级预防管理的重要因素之一。
本研究还发现,大面积脑梗死、梗死后出血转化和急性期非主要出血也是不利于急性缺血性卒中合并NVAF 患者出院时抗凝治疗的因素。大面积脑梗死易继发梗死后出血,梗死面积与出血性转化的发生率呈正相关[53],且常合并肺部感染、深静脉血栓、应激性溃疡甚至脑疝等多脏器受损,从而会影响抗凝药物的使用。有研究建议,对于大面积脑梗死患者,在发病2 周后可加用抗凝药物,但需依据临床风险评估和相关实验室检查结果,权衡利弊后进行决策[54]。缺血性卒中合并心房颤动的梗死后出血转化非常常见,脑梗死后出血转化与栓塞性质、大面积梗死、抗栓药物应用均有一定关系,一旦出现出血转化,临床医师更倾向于停用抗凝药物[55]。目前,关于出现梗死后出血转化如何平衡出血与卒中风险是治疗的难点。现有的观察性研究提示,抗凝可能并不影响少量出血转化患者的抗栓治疗[56],而对血肿型出血转化患者适当延迟抗凝12 d 也并未增加缺血性卒中的复发[57]。急性期非主要出血大多是胃液潜血阳性或便潜血阳性以及留置尿管相关的血尿[23]。因此,急性期非主要出血及梗死出血转化并不能成为使用抗凝药物的障碍,出院时需在医患充分沟通的前提下个体化选择,出院后定期随访,相关因素稳定或去除后及时给予抗凝治疗行二级预防,是提高缺血性卒中合并心房颤动二级预防管理的因素之一。
荟萃分析显示,急性缺血性卒中后< 48 h 使用低分子肝素、类肝素与症状性脑出血的风险增加相关,但未显著降低复发性缺血性卒中的风险[58]。另外关于急性缺血性卒中合并心房颤动患者早期复发和脑出血的研究表明,缺血性卒中合并心房颤动患者使用抗凝治疗可改善患者的生存状态,且口服抗凝药优于单纯低分子肝素或桥接治疗[59]。因此,在无其他临床应用适应证的前提下,对于急性期缺血性卒中合并NVAF 患者须用抗凝时,可首选口服抗凝治疗,而非单纯低分子肝素治疗或桥接治疗,也可能是提高急性缺血性卒中合并NVAF 患者二级预防管理的因素之一。
对比分析3 种抗凝药物应用后出血事件发生率发现,3 种抗凝药物出血事件发生率均较低,且差异无统计学意义(P > 0. 05),提示NOACs 在急性期应用的安全性相对可靠,而1 例服用利伐沙班出现严重脑出血事件的患者,考虑与其自身的高龄、合并感染、中度肾功能不全、低蛋白血症,同时应用胺碘酮,存在血压控制不良等多个高出血风险因素并存有关[60-62],在多个出血高危险因素并存时,应先积极控制纠正高风险,选择合适的剂量及抗凝时机、遵守个体化治疗的原则非常重要。
综上所述,自2018 年NOACs 进入医疗保险后,NOACs 的应用可提高急性缺血性卒中合并NVAF患者出院时的抗凝药物使用率及抗凝治疗中NOACs抗凝占比,在NOACs 广泛应用于临床后,高龄、共存颅内外血管狭窄、大面积梗死比例、梗死后出血转化、急性期非主要出血仍然是影响急性缺血性卒中合并NVAF 患者出院时抗凝的主要因素,加强栓塞性卒中专业知识培训以及加强出院患者随访是提升急性缺血性卒中合并NVAF 患者二级预防管理的重要途径。






