摘 要
背景
由于脑干海绵状血管畸形位于重要功能区且具有潜在的破坏性神经后果,其治疗引起了相当多的争论。
目前缺乏关于其治疗的一级证据 。
本文献综述的目的是探讨目前关于不同治疗方案的风险-效益概况。
方法
系统文献检索,用PRISMA算法在Pubmed数据库中检索相关关键词,查询发表于2010-2018年的文献 。
仅保留英文文献。去除仅讨论脊髓海绵状血管瘤及样本量少于30例的文章。
结果
共回顾了222篇文献,在剔除重复文献和摘要筛选后,28篇包括30例或以上的脑干海绵状血管瘤病例的临床论文被纳入研究。
一般的共识是,对于出现严重症状和/或多次出血或到达软脑膜表面的海绵状血管瘤,手术被认为是金标准,一些作者建议最佳时间是在卒中后的2-6周内。
对于多发的、没有累及软脑膜表面的深部海绵状血管瘤相关出血的患者,可以考虑立体定向放射手术。保守治疗通常仅在偶发患者作为一种考虑。其他类别的脑干海绵状血管瘤治疗方式仍存在争议 。
结论
由于其位置的重要性,脑干海绵状血管瘤治疗必须根据风险-效益概况进行平衡,并针对患者个人及其临床医生量身定制。
本综述提供了考虑所有治疗方案的综合参考,并为循证患者咨询提供了基础。
关键词
脑海绵状瘤、脑干海绵状瘤、海绵状畸形
![]()
引 言
海绵状血管畸形(Cerebral cavernous malformations (CCMs)),又称海绵状血管瘤、大脑血管瘤,是一种由单层内皮排列而成的透明血管窦通道组成的低流量血管畸x形[1–3]。其可以是先天性的,也可能是新生的,如继发于辐射暴露[4]。
CCMs的患病率估计为0.1%-0.4%[3,5–9]。多达1/3的患者有相关的发育性静脉异常
(developmental venous anomalies (DVAs))[7]。
本文的重点是关于脑干海绵血管瘤的临床治疗。
2.1海绵状血管瘤的表现及出血的危险因素
海绵状血管瘤可无症状或表现为神经系统临床特征。在一项涉及1620例CCMs患者的荟萃分析中指出28%是偶然发现,36%有症状性颅内出血,36%有癫痫发作或局灶性神经功能缺损[10]。
据估计,每年的出血风险为0.1%-2.5%/病变/年,0.25%–16.5%/人/年,但对于既往有出血的患者,这一风险明显更多(高达4.5-40%/年)[2,7,11,12]。
对于无颅内血肿或局灶性神经功能缺失的非脑干CCMs患者未治疗期间随访5年颅内血肿的发生率平均是3.8%(2.1-5.5);脑干CCMs则是8.0%(0.1-15.9)。
对于伴有颅内血肿或局灶性神经功能缺失的非脑干CCMs患者5年 出血风险是18.4%(13.3-23.5);脑干CCMs则是30.8%(26.3–35.2)。
然而,一些学者认为脑干CCMs会增加出血风险这一说法并不确切,因为其与其他疾病存在不同的病理生理,或因为脑干以外的类似病变常发生在非功能区,当出血时通常不伴有特殊临床症状。
其他可能的易出血风险包括:女性、年龄、周围水肿、体积大、发育异常的静脉畸形及高血压[1,8,9,12–18] 。
在卒中后的前2年出血的风险明显增高,这种现象被称为“出血聚集”[2,13,16,19]。多重性、妊娠和抗血小板、抗血栓药物的使用似乎不会增加出血的风险。
2.2脑干海绵状血管瘤
据估计,大约20%的CCMs位于脑干,尽管一些作者报道可能高达35% [2,6,13,20–24]。
众所周知,因为重要的位置及手术高风险,脑干CCMs的治疗很困难[4,11]。大部分的病变发生在桥脑(图1)。
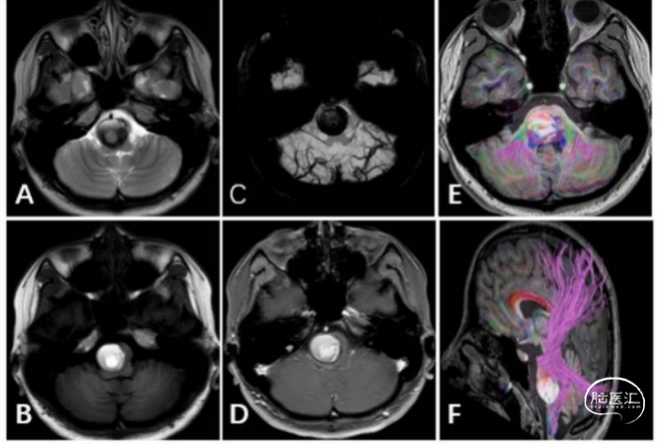
图1典型桥脑海绵状血管瘤影像。
A:T2WI病变呈等-高号为主,可见血管流空影;
B:TIWI病变呈等或高号为主;
C:SWI可见呈混杂信号,界限清晰;
D:病灶无 明显强化;
E/F:DTI可见脑干纤维束被推挤致两侧及背侧。
因病变位置不同其临床症状也多种多样。大脑CCMs多表现为癫痫、颅内血肿、头痛 、局灶神经功能障碍[14]。
然而,脑干CCMs常表现为颅神经缺损、感觉异常、头痛、肢体运动异常、复视、共济失调、眩晕等,并按频次递减顺序排列[4,8]。尽管神经功能缺损通常会自行改善,严重时也可能导致呼吸障碍及危及生命[13]。
虽然最近在动物模型中发现了新的分子靶点,这可能滋生新的治疗方法[28],但目前治疗脑干海绵状血管瘤的主要方法包括观察、显微手术和立体定向放射手术。
2.3目的
本文探讨了目前关于脑干海绵状血管瘤不同治疗方案的风险-收益概况的文献。研究对象为脑干海绵状瘤的成年患者,比较的干预措施为保守(监测)和积极(手术和放疗)。测量结果是相关致残率和死亡率。
资料与方法
在PubMed上进行文献检索。使用的搜索策略为(海绵状瘤或海绵状畸形)和(脑干或延髓或脑桥或中脑)。
出版日期从2010-2018年不等。对所有搜索结果的标题和摘要进行了回顾。
排除标准包括非英语文章、非人类研究、儿科研究、会议记录、聚焦于脊髓海绵状血管瘤的文章以及样本量少于30人的研究。
笔者还排除了基于技术的论文,如涉及尸体解剖的解剖学研究。包括所有可用的观察性研究和随机试验。
相关的元分析、指南和摘要也被包括在讨论中。通过回顾研究方法评估各研究的偏倚风险。
![]()
结 果
表1总结了三个关键的治疗方面。这些主要是基于案例系列和专家意见(4-5级证据)。
脑干CCMs的治疗主要取决于治疗的好处和风险之间平衡。
下面我们主要讨论手术和立体定向放射治疗。

表1从文献综述总结关键问题。*表示"有数字的地方"
4.1
手术
对于手术可及的有症状的CCMs,手术被认为是金标准[2]。手术的目的是完全切除病变,同时保留关键的神经结构。
此外,应尝试保留任何相关发育性静脉畸形,因为它们的牺牲可能导致静脉性梗死,造成严重的后果[18,31-33]。 然而,对于脑干CCMs手术指征缺乏一致意见。
由于术后早期的高死亡率和致残率,可能只有在第2次症状性出血后才进行脑干CCMs手术切除是合理的,因为其可能有更侵袭性的过程。单次出血后进行手术的适应症不推荐用于无症状病例[13,26]。一些作者建议切除最近第一次大出血侵及软脑膜表面伴有症状的CCMs[31]。
一些作者主张所有脑干CCMs的手术指征是相同的:急性病变外出血、外生性(毗邻软脑膜表面)病变、重复出血和临床恶化、或出血引起占位效应[4]。
毗邻软脑膜及室管膜表面的病变通常不需要经过正常脑干组织可直接到达。关于出血后最佳手术时机的证据有限,一些人认为是亚急性期(发作后2-6周)。
在此期间,多数患者神经功能稳定,血肿开始液化,有利于切除,并且避免扩大处理周围脑组织。主要目的是根治性切除病变,因为部分切除与残留病变持续复发出血相关[26,31,34]。
Gross等人对1390例患者的系统回顾中,不完全切除导致62%(103例中65例)的再出血率,总死亡率为1.5%[35]。
相关发育性静脉异常在不同比例的研究中也有报道。多数研究使用术前成像来量化发育性静脉异常的存在;然而有些结果是基于术中观察。
多数研究表明,在近一半的脑干CCMs病例中,手术与术后早期的高致残率相关。然而,这些症状在随访时大多逐渐缓解。与术前相比,多数患者的随访结果都有所改善。
确定的不利因素包括病变体积大、术前状态差、后组颅神经受损、术前出血复发和手术时机[34,36]。
围手术期并发症包括新的或恶化的局灶性神经功能缺失(如颅神经损伤)、需要气切、胃造口术、脑脊液漏以及死亡[35,37]。
一些作者倾向于使用图像引导、血管造影和术中神经生理监测(如感觉和运动诱发电位)来帮助识别安全区,以及在切除过程中避免关键结构[26,31,38]。
然而,目前还没有直接、客观的研究支持它们的疗效。
4.2.22
立体定向放射外科
立体定向放射手术有时被考虑用于脑干、基底节和丘脑海绵状血管瘤患者的治疗,因为深部位置与手术风险高相关[8,21]。
SRS的适应证和疗效仍然存在争议[2,39-41]。
放疗被认为诱导血管玻璃化和增厚,导致血栓闭塞反应[11]。
然而,与动静脉畸形不同的是,CCMs在血管造影上是隐匿性的,而且与手术不同,通常需要时间才能看到治疗的最终效果。
在回顾的研究中,SRS治疗后年出血率显著降低,永久性不良反应也少见。Lu等人[45]的四项研究支持与手术相比,SRS治疗后再出血率较低,且不良反应较轻。
其包括FND,脑积水,再出血,侧支水肿,囊肿形成和疼痛感异常。根据Poorthuis等人对涉及3424名患者的63个队列的大脑海绵状血管瘤(不限于脑干海绵状血管瘤)的荟萃分析,他们得出结论,神经外科切除无论大脑或脑干海绵状血管瘤的近期出血风险更低 。
然而,近期治疗的患者出现不良结果的风险也较高[46]。肥大性橄榄性
(Hypertrophic olivary degeneration,HOD)
是一种(可能被低估的)现象,在脑干的齿状-红橄榄状通路受到损伤后很少发生。有报道称立体定向放射治疗术后和手术后出现HOD[33,47]。
然而,确切的发病率尚不清楚。典型症状包括腭肌阵挛、眼球震颤和视震荡。
讨 论
熟练的手术,病人的选择,外科医生的专业知识和良好的解剖学理解是优化结果的必要条件[31,34,41],术前良好的功能状态和孤立性出血也是良好的预后因素[47]。另一项对242例患者的回顾性研究表明,DVA的存在和不完全切除是术后出血的危险因素。作者也提出了长期预后的独立不利因素:年龄增加、多处出血、腹侧病变和术前状态差。一项研究表明,病变位于桥脑有助于获得良好的 结果[48]。
在随访方面没有明确的共识或证据,一些国家取决于保险、患者偏好以及神经和/或神经外科医生的执业标准。
然而,有些人建议对保守治疗的病例每年进行随访。其他作者认为,它不能提供进一步恶化可能性的信息[23,26,44]。
从表1可以看出,SRS很可能导致较低的致残率和死亡率,但不能有效地降低再出血率。然而,必须记住的是,许多研究都是病例系列研究,因此在患者选择上可能存在偏差。
在文献综述的基础上,提出了BSCM管理计划流程图(图2)。必须指出的是,它主要是由观察性研究和专家意见支持的,而不是高质量的基于证据的建议。

图2基于文献推荐的脑干海绵状畸形治疗流程图[2,26,40,44]
5.1局限性
这些研究中的大部分数据都是回顾性收集的。而且许多是单中心研究并且结果不具有均质性。
另外,外科医生往往有不同的专业知识和经验,因此,即使是类似的病变,他们的手术方法也可能不同。由于病例的稀缺性,大多数研究跨越数年,技术进步不断改变,结果的潜在差异进一步被混淆。
对于我们纳入的研究中SRS治疗的患者,平均边缘剂量也是可变的,可能导致一个异质性的患者组。剂量分布还取决于给药系统(如:伽玛刀或直线加速器,LINAC),并可能影响治疗的成功。
5.2启示及未来的研究方向
一种类似于动静脉畸形的分级系统已被提出对脑干海绵状瘤进行分类,以预测治疗结果(表2)。
更高的分数预计会带来更差的结果。需要指出的是本研究中的DVAs包括术中及影像学发现的DVAs。
因此,在术前影像学无DVAs证据的病例中,术前可能无法确定完整的分级。该分级系统尚未在更大规模的临床研究中得到验证,但它已经纳入了观察性研究中的一些关键预后因素。
一旦得到验证,它将有助于更好地指导患者和治疗医生在个别病例的治疗选择的风险和好处。

表2Garcia等人提出的分级系统(39)DVA,发育性静脉异常
到目前为止,还没有关于这个主题的大规模随机对照试验。由于患者的差异性,这类研究会很难进行。但是将结果的不同度量标准标准化将是有用的(如局限性部分所述)。
此外,最近的一项研究表明,使用抗血栓治疗比不使用抗血栓治疗[19]与颅内出血或脑海绵状血管畸形的局灶性神经缺陷的风险更低相关。
在这项研究中,脑干海绵状血管瘤只占大约10%的样本量。这值得进一步研究。

结 论
曾经被认为是“禁区”的脑干CCMs由于其危险的位置是极具挑战性的病变治疗。然而,这些部位的出血可能导致潜在的严重后遗症。因此,治疗必须平衡风险-效益概况和量身定制的患者和他们的治疗医生。
该文章回顾了近期显微外科及放射外科治疗脑干海绵状血管瘤的预后,它为治疗医生在考虑治疗方案和咨询病人时提供了全面的参考。
这表明,通过仔细选择病人,专业的外科医生和适当的设备,显微手术可以在许多情况下提供良好的结果。另一方面,SRS也为禁忌症患者提供了一种安全的替代方法。





