《Acta Neurochirurgica (Wien)》 2021年11月24日在线发表挪威University of Bergen的Aril Løge Håvik , Ove Bruland , Hrvoje Miletic ,等撰写的《散发性前庭神经鞘瘤与恶性转变相关的基因改变。Genetic alterations associated with malignant transformation of sporadic vestibular schwannoma》(doi: 10.1007/s00701-021-05062-0.)。

![]()
导言
前庭耳蜗神经恶性周围神经鞘膜瘤(Malignant peripheral nerve sheath tumor of the vestibulocochlear nerve,VN-MPNST)极为罕见,预后不良。人们对其潜在的遗传学,特别是恶性转变过程所知甚少。关于这一转变是否由电离辐射引发的争论正在进行中。本文分析比较了2例放射治疗后VN-MPNST和1例自发转变( undergoing spontaneous transformation)的VN-MPNST。
恶性周围神经鞘瘤(MPNST)是由雪旺细胞或软组织周围神经的其他部位引起的软组织肉瘤。大约50 - 60%的MPNST与神经纤维瘤病1型肿瘤综合征相关,大约10%被认为是辐射诱发的。前庭耳蜗神经恶性周围神经鞘膜瘤(VN-MPNST)极为罕见,且预后不良。Carlson等人估计,每100万人每年的发病率为0.017例,每1041例前庭神经鞘瘤(VS)中约有1例VN-MPNST。据我们所知,仅对两例颅神经MPNST进行过一项基因研究,因此有必要更好地了解这种疾病。
伽玛刀放射外科治疗(GKRS)是一种常用来治疗VS的电离辐射(IR) 。关于电离辐射(IR)是否可能诱发恶性转变存在争议。先前的研究发现了辐射诱发恶性肿瘤的独特突变特征。像伽马射线这样的电离辐射(IR)可以直接电离DNA分子,或者间接产生自由基,从而导致所有类型的DNA突变。
为了评估GKRS是否诱发了特征性的基因组事件,我们将一例自发VN-MPNST的基因组与两例先前接受过照射的VN-MPNST的基因组进行了比较。据我们所知,这是第一个关于VS恶性转变遗传学的研究。
为了阐明这一过程,我们提出了一个组织学上良性VS及其恶性后代的基因组分析。全基因组DNA未阵列和全外显子组测序用于分析肿瘤特异性突变。
![]()
方法
对3例患者的4处肿瘤(未接受过放射治疗的[radiation-naïve]前庭神经鞘瘤[VS]前且有(VN-MPNST)恶性转变后以及2例放疗后VN-MPNST)进行DNA全基因组微阵列(DNA whole-genome microarray)和全外显子组测序(whole-exome sequencing)检测所谓的肿瘤特异性突变。利用MuSiCa对突变特征进行了表征( Mutational signatures were characterized using MuSiCa)。
![]()
病例报告
第一例患者于2010年因组织学上良性VS (VS1)而手术,经历了自发恶性转变,并于2014年因VN-MPNST (VNMPNST1)而手术。两次手术的活检经组织学检查证实,如前所述。复发肿瘤HMB45和melanA阴性。病人仍然活着,而且情况良好。
第二例患者是一名63岁的女性,1999年出现18个月的左侧进行性听力丧失史,MRI显示左侧桥小脑角肿瘤(图1a)。无NF2家族史或特征。随访扫描显示肿瘤生长,并于2002年接受GKRS治疗。直到2007年肿瘤保持稳定,体积略有增加。2015年,患者出现2个月的不稳加重、左侧面部麻木无力和复视。MRI显示肿瘤生长(25mm),患者接受乙状窦后入路全切除术(图1b)。组织学检查显示过多细胞的肿瘤(hypercellular tumor),具有适度的核多形性和适度的有丝分裂活性(moderate nuclear pleomorphism and moderate mitotic activity)。肿瘤S100、EMA、Desmin、Actin均阴性。Ki-67指数约为10 - 30%。肿瘤被诊断为MPNST (VN-MPNST2)(图1c, d)。术后10天,患者出院至神经康复中心,伴面神经瘫痪和舌咽神经麻痹。一年后,她死于该疾病。
第三例患者是一名当时63岁的女性,此前有囊性肾病和肾癌病史(cystic kidney disease and renal cancer),为此她接受了捐肾,并正在服用免疫抑制药物。她于2005年出现3个月的不稳和右侧听力丧失。MRI显示右侧桥小脑角有一个对比增强的肿瘤(图1e)。在随访期间肿瘤显示生长,并于2007年接受GKRS治疗。2014年肿瘤保持稳定,体积有所减小。患者于2016年再次出现严重不稳、恶心、头痛。MRI显示一个40毫米的肿瘤伴颞骨破坏(图1f)。入院时,她卧床不起,吞咽困难,并报告在几周内体重减轻了3.4公斤。她接受了乙状窦后入路开颅术。由于小脑肿胀和肿瘤和小脑弥漫性出血,切除术被终止。术后CT显示蛛网膜下腔出血伴脑室扩大及脑积水。接受外引流,将患者转到重症监护室。患者没有恢复自主呼吸,意识逐渐下降,术后16天死亡。组织学检查显示肿瘤组织,细胞密度高。肿瘤细胞具有细长的多形性细胞核,并在纤维状和部分黏液样基质中排列成片状。观察到有有丝分裂活性,每10倍高倍镜视野( HPF)下有4个有丝分裂。免疫组化显示肿瘤细胞S100、细胞角蛋白AE1/ AE3和EMA灶性阳性,而GFAP阴性(Histological examination demonstrated tumor tissue with high cell density. Tumor cells had elongated, pleomorphic nuclei and were arranged in sheets in a fibrillary and partly myxoid matrix. Mitotic activity was observed and 4 mitoses per 10 HPF were counted. Immunohistochemistry demonstrated focal positivity of tumor cells for S100, cytokeratin AE1/ AE3 and EMA, whereas GFAP was negative)。根据组织学和免疫组织化学检查,诊断为MPNST (VN-MPNST3)(图1g, h)。
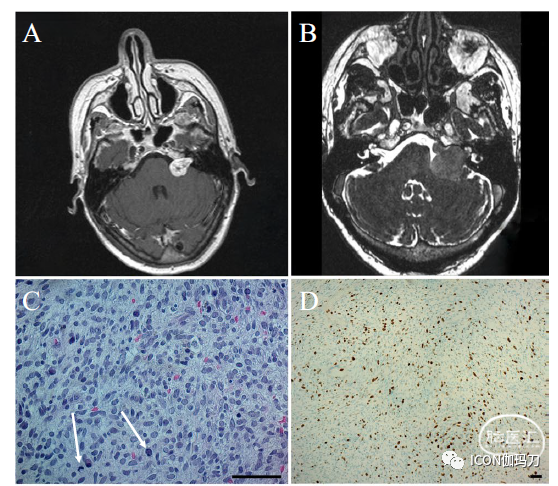
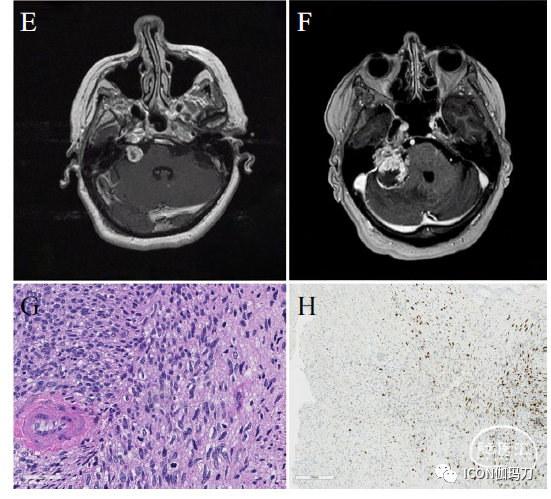
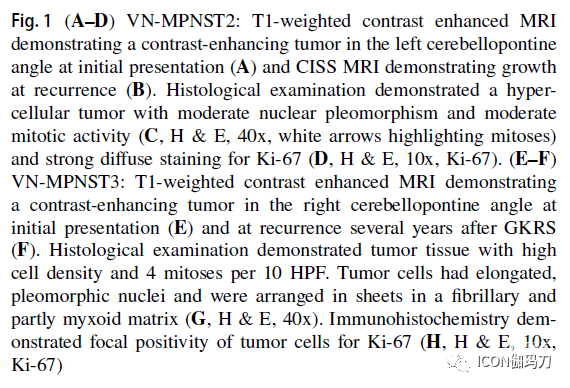
图1 (A-D) VN-MPNST2:初始表现时T1加权增强MRI显示左侧桥小脑角呈对比强化的肿瘤(A), CISS MRI显示复发时呈现生长(B)。组织学检查显示为富细胞的肿瘤,具有中度核多形性和中度有丝分裂活性(C, H &E, 40x,白色箭头突出有丝分裂)和Ki-67强弥漫染色(D, H &E, 10倍,Ki - 67)。(E-F) VN-MPNST3: 在初次表现时(E)和GKRS治疗后数年复发时(F)T1加权增强MRI显示右侧桥小脑角肿瘤。组织学检查显示肿瘤组织细胞密度高,每10 HPF有4个核分裂。肿瘤细胞具有细长的多形性细胞核,并在纤维状和部分黏液样基质中排列成片状(G, H &E, 40 x)。免疫组织化学显示肿瘤细胞局部阳性Ki-67 (H, H &E, 10倍,Ki - 67)。
![]()
结果
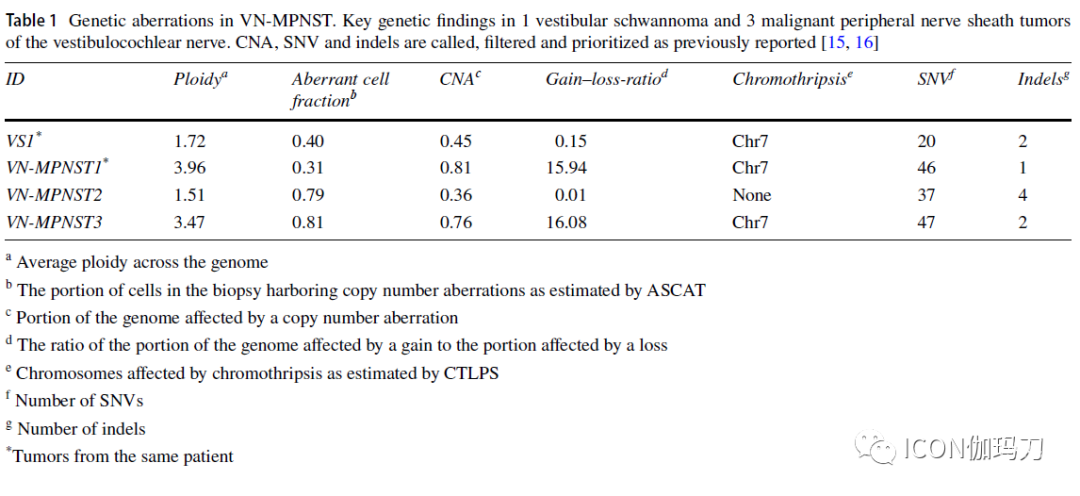
肿瘤基因组以拷贝数畸变为主,36-81%的基因组受影响(The tumor genomes were characterized spandominantly by copy-number aberrations with 36-81% of the genome affected)。甚至VS基因组也严重异常( Even the VS genome was grossly aberrated)。自发恶性转变的特征是近全基因组翻倍、NF2突变消失以及三个癌症相关基因(GNAQ、FOXO4和PDGFRB)的新突变(The spontaneous malignant transformation was characterized by a near-total whole-genome doubling, disappearance of NF2 mutation and new mutations in three cancer-related genes [GNAQ, FOXO4 and PDGFRB])。所有肿瘤均纯合缺失肿瘤抑制因子CDKN2A(All tumors had homozygous loss of the tumor supspanssor CDKN2A. Neither mutational signature nor copy number profile was associated with ionizing radiation )。突变信号和拷贝数都与电离辐射无关(copy number profile was associated with ionizing radiation)。
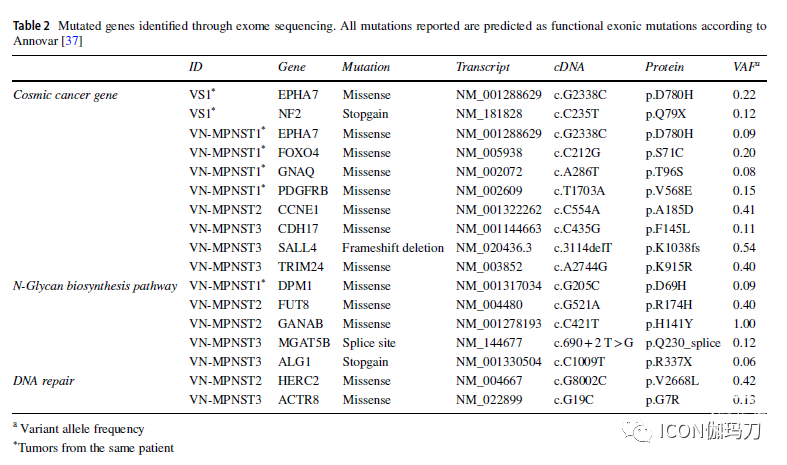
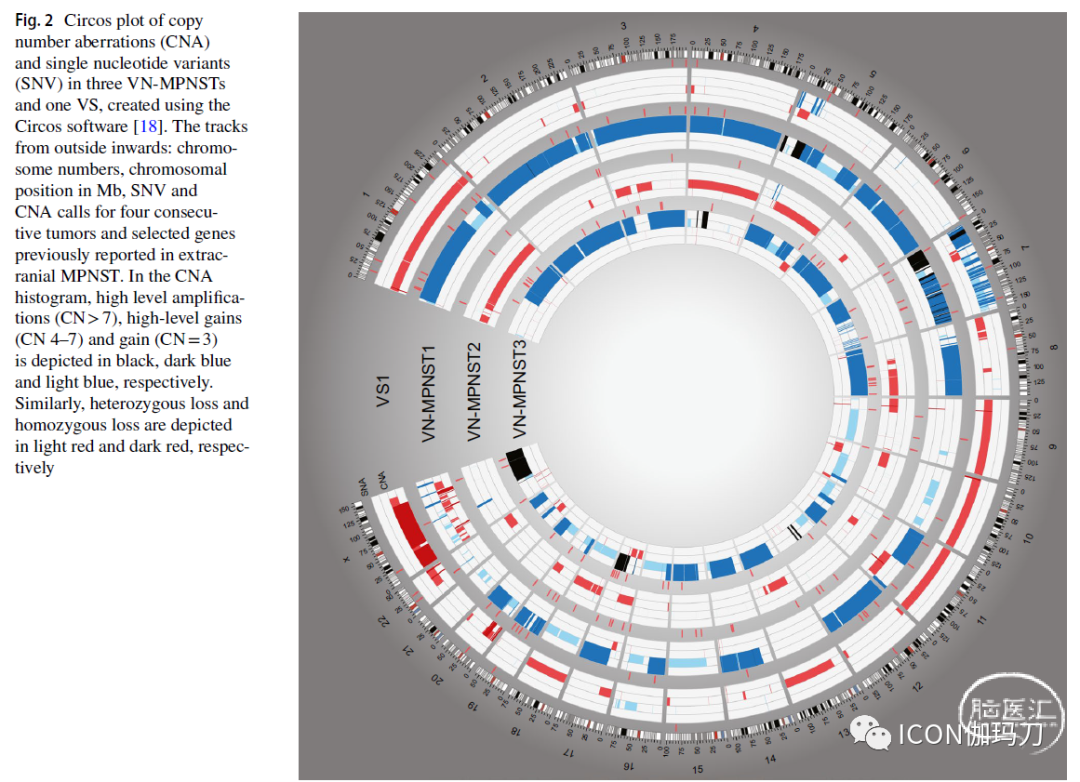
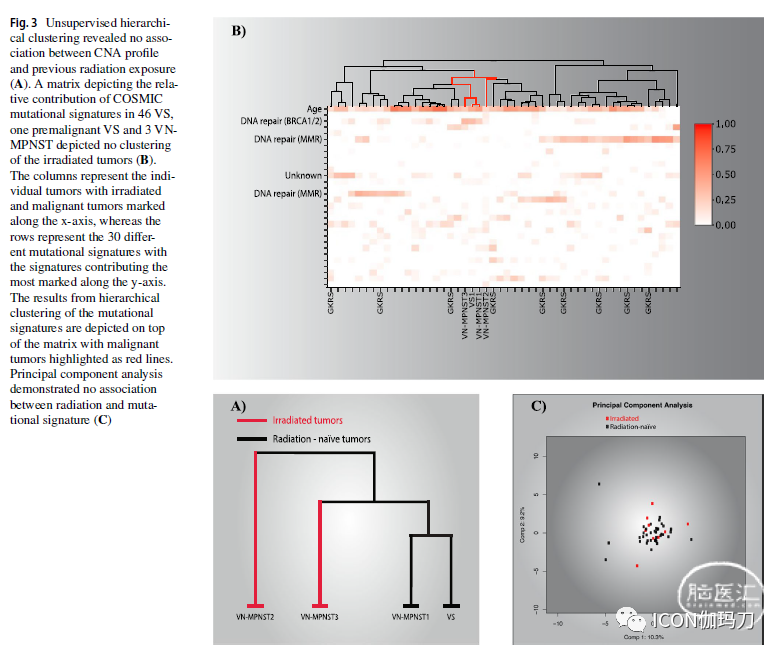
![]()
结论
本病例中VN-MPNST基因组具有大拷贝数畸变和CDKN2A纯合子缺失的特征(The VN-MPNST genome in our cases is characterized by large copy-number aberrations and homozygous deletion of CDKN2A)。我们的研究表明,具有基因改变的VS与对应的恶性VN-MPNST相似,表明存在癌前VS(a VS with genetic alterations similar to its malignant counterpart, suggesting the existence of spanmalignant VS),没有与电离辐射相关的一致的突变特征( No consistent mutational signature was associated with ionizing radiation.)。
VN-MPNST是一种基因组严重畸变的恶性肿瘤,其特征是大量的CNAs和相对少量的小突变,这与之前关于颅外MPNST的研究一致。我们的研究表明,良性VS与恶性VS具有相似的基因改变,提示存在癌前VS。在自发恶性转变过程中,肿瘤经历了近全基因组倍增,并获得了癌症相关基因的新突变( In the process of spontaneous malignant transformation, the tumor undergoes a near whole-genome doubling as well as acquires new mutations in cancer-related genes)。没有与GKRS治疗相关的突变特征。然而,一例接受过照射的肿瘤在DNA修复所必需的基因(a gene essential to DNA repair)HERC2中有一个错义突变(one irradiated tumor harbored a missense mutation in HERC2)。




