doi:10.3969/j.issn.1672-5921.2020.03.010
作者单位:100053 北京,首都医科大学宣武医院神经内科
通信作者:宋海庆Email:songhq@xwhosp.org
2019年爆发于中国的2019冠状病毒病(cornavirus diseases 2019, COVID-19),在全球引起广泛关注。根据现有研究报道及既往文献回顾,COVID-19与脑血管病之间存在密切的关系。患有心脑血管病的患者在使用特定种类的降压药物时,可能加重对组织的损伤,使此类人群更加易感;而脑血管病同时也是COVID-19的一个重要并发症,其原因有待进一步研究证实。
01
流行病学概述
中国湖北省卫生健康委员会于2019年12月31日首次报道了一系列原因不明的肺炎病例[1]。在进一步的病原学研究中,研究人员在患者气道上皮细胞分离出一种可引起严重肺炎的新型冠状病毒,最初普遍称其为2019-新型冠状病毒(2019 novel coronavirus, 2019-nCoV)后因与严重急性呼吸系统综合征冠状病毒(severe acuterespiratory syndrome coronavirus,SARS-CoV)同属于β属B亚群[2],而被国际病毒委员会命名为SARS-CoV-2。
随后,COVID-19陆续出现在全国各地以及世界其他国家和地区,截止至2020年2月14日24时,SARS-CoV-2已经导致全国累计66 492人确诊感染, 1 523人死亡[3]。
近几十年来,另外两种新型冠状病毒已经成为全球主要的流行病[4]:2003年,SARS-CoV蔓延至37个国家,造成8000多人患病,近800人死亡;2012年,中东呼吸系统综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)蔓延至27个国家,感染患者2494人,迄今为止,全球已有858人死亡。
基于目前的研究,SARS-CoV-2肺炎院内死亡比例为11%,院内出现急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)的患者比例达17%,急性肺损伤为8%,急性肾损伤为3%,感染性休克为4%[5]。由此可见,SARS-CoV-2感染所致疾病具有传播能力强、致死率相对高的特点,应积极探 究其与各个临床学科之间的潜在联系,引起各学科的重视。
02
人群易感性
SARS-CoV-2和SARS-CoV都属于冠状病毒大家族的成员,该家族还包括引起中东呼吸系统综合征的MERS-CoV,故而为了解此新发的冠状病毒,可部分参照前两者的诊疗经验,以求迅速控制疫情。
虽然现阶段认为SARS-CoV-2的易感人群同SARS-CoV和MERS-CoV一样,属于全人群易感,但 在SARS-CoV-2感染的99例患者中观察到[5],由于X染色体和性激素的保护,受感染的男性患者多于女性。此外,大约一半受SARS-CoV-2感染的患者 患有慢性基础疾病,主要是心血管和脑血管疾病以及糖尿病。
现阶段关于SARS-CoV-2的临床病例资料仍较为局限,但SARS-CoV和MERS-CoV合并心脑血管疾病的研究却早有涉及。基于2003年北京市1291例SARS患者的病例资料发现,既往有心脑血管基础疾病的SARS患者死亡的相对危险是无基础 疾病患者的1.83倍,由此可见,心脑血管基础疾病是死亡的重要危险因素之一[6] 。一项关于MERS-CoV的荟萃分析表明,在感染了MERS-CoV的患者中,糖尿病和高血压病是普遍存在的慢性疾病,大约占50%,心脏疾病和肥胖分别占30%和16%,且患有潜在慢性疾病的患者发生严重MERS-CoV并发症的风险增加[7] 。
因此,既往患有脑血管疾病的患者较其他患者面临着更高的并发症和死亡风险。及时关注此类人群并及时诊治,对于改善其预后尤为重要。
03
SARS-CoV-2的细胞受体
病毒通过受体与靶细胞结合是感染的关键早期步骤。将SARS-CoV-2的全基因组序列与上述所提 两种病毒基因序列对比显示,此病毒与SARS-CoV有79%的相似度,与MERS-CoV有50%的相似度[8]。Li等[9]报道的一项针报道的一项针对SARS-CoV进入细胞受体方式的研究发现,SARS-CoV可通过细胞上的血 管紧张素转换酶Ⅱ(angiotensin converting enzymeⅡ,ACE2)受体感染目标细胞(如图1左上所示)。ACE2是一种金属蛋白酶[8],在人体被SARS-CoV-2感染及后续发病的整个过程中有着重要作用。而针对SARS-CoV-2的感染性研究证实,SARS-CoV-2能够通过ACE2受体进入其他所有表达ACE2的受体细胞中,而无法进入不表达ACE2的受体细胞,这表明ACE2可能同样是SARS-CoV-2的细胞受体[10]。最新的关于SARS-CoV-2结构的研究发现,该病毒对 人ACE2有着高亲和力,可高达SARS-CoV的10~20倍[11]。这也进一步阐明了SARS-CoV-2在人与人之间迅速传播的原因。
根据以上关于SARS-CoV-2进入人体机制的研究明确了SARS-CoV-2感染正常细胞的方式,故COVID-19可能是由病毒通过ACE2进入人体细胞引起,从而产生一系列病理生理学反应[12]。以上结论有助于研究人员加强对SARS-CoV-2的认识,了解 其侵入特点,为进一步的治疗提供依据。
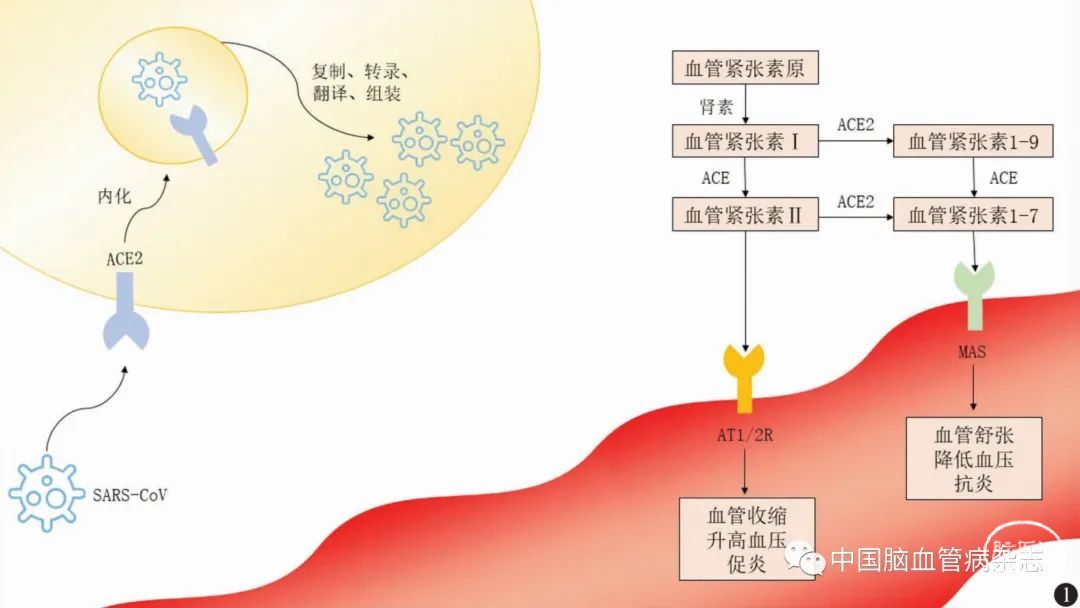
SARS-CoV 为严重急性呼吸系统综合征冠状病毒;ACE 为血管紧张素转换酶;ACE2 为血管紧张素转换酶Ⅱ;AT1/2R 为血管紧张素Ⅱ1/2型 受体;MAS 为 G 蛋白偶联受体 Mas
图 1 SARS-CoV 感染受体细胞模式图(左上图文)及 ACE2 在肾素鄄血管紧张素鄄醛固酮系统中的调控作用(右下图文)
04
SARS-CoV-2与神经系统疾病的可能联系
中枢神经系统是一个复杂的系统,对于整个人体各系统起着重要的调控作用,但其对大多数感染并不具有免疫功能,尤其是对病毒感染。近年来,多种冠状病毒被发现其不仅有感染呼吸系统的能力, 而且具有神经侵袭性。现有的相关研究主要针对SARS-CoV。首次怀疑SARS-CoV具有神经侵袭性是2004年Lau 等[13]在1例SARS患者脑脊液中发现病毒RNA 。1年后,Xu 等[14] 从1例患者的脑组织中分离出病毒,且神经病理学表现为神经细胞受损,而该患者表现出神经系统症状,此观点得以证实。后续对实验小鼠进行小剂量SARS-CoV颅内接种实验,可观察到广泛的神经元感染[15] 。因此,SARS-CoV具有神经侵袭性和嗜神经性,可能与神经系统疾病的发展有关[16],神经元则是SARS-CoV高度易 感的靶细胞。
首例对于新型冠状病毒肺炎的病理解剖结果显示,COVID-19的病理特征与SARS-CoV感染中的特征非常相似[17]。所以SARS-CoV-2与神经系统疾病可能存在潜在的联系,但仍需进一步的病理学研究 来证实。
05
SARS-CoV-2与脑血管病
COVID-19不仅可以导致一系列严重的呼吸系统相关损伤,更具有可引发患者机体多变的病理生理学机制。作为与其病理生理学反应相似且同样造成大规模流行的冠状病毒,SARS-CoV也曾导致区域性脑血管病死亡风险增加[18] 。既往对人体感染SARS-CoV后发生的一系列病理生理学变化机制研究一定程度上可以作为SARS-CoV-2感染各系统机能异常研究的参考。
5.1 凝血功能异常
凝血功能异常是此疾病实验室检查的一项重要特征。在最初确诊的41例成人肺炎患者中,相比其他患者,进入重症监护室治疗的患者其凝血酶原时间和D-二聚体水平较高[12] 。前期指南已反复阐明, 血液高凝状态是缺血性脑血管病的重要可干预危险因素[19]。而很大一部分COVID-19患者的凝血酶原时间及D-二聚体水平高于正常水平,这使此类人群并发脑血管疾病的风险大大提高。
Chen等[5]报道,感染SARS-CoV-2的患者中52%出现白细胞介素6水平升高,86%出现C反应蛋白升高。众所周知,感染和炎性反应在脑血管病的发生、进展、治疗及预后方面均有重要作用,C 反应蛋白升高者预后不佳,其含量与梗死面积、神经功能缺损程度相关,是脑梗死患者病变程度的指标之一[20]。炎性因子作用于血管壁及脂质斑块,影响颅内及颅外动脉粥样硬化性斑块的稳定性,进而增加卒中风险。白细胞介素6及C反应蛋白升高均提示患者存在明显的炎性反应状态,这从另一方面验证了COVID-19患者存在脑血管病高危风险,感染SARS-CoV-2可能通过各种机制造成卒中风险增加。
5.2 高血糖代谢紊乱
在COVID-19患者的实验室检查分析中,可观察到52%的患者存在高血糖状态[5],提示这可能是SARS-CoV-2感染的另一个主要临床特征。前期对SARS的死亡患者的分析发现,无论在入院时或在最后死亡时,因SARS-CoV感染死亡的患者均有血糖升高[21],而死亡时血糖升高更为显著。其原因可能是SARS作为病毒血症导致机体应激使血糖升高,而大剂量应用糖皮质激素造成分解代谢加强也是血糖升高的主要原因。有研究表明,高血糖状态患者 的卒中事件发生概率显著升高[22]。
SARS-CoV也可以造成严重的ARDS,其表现与COVID-19的病理学特征相似[17]。一项研究报道了1例来自沙特阿拉伯的感染SARS-CoV的42岁女性患者并发自发性颅内出血,最终死于脑疝[23]。而其颅内血管造影未显示任何动脉瘤或结构缺陷。患者从未患有过无法控制的高血压或凝血功能异常,也从未接受过抗血小板聚集治疗。该患者既往有糖尿病,且在患者发生自发性颅内出血的当天,其血糖水平高达25 mmol/L,这可能是其并发脑血管病的危险因素。
因此,在SARS-CoV-2感染的同时,应强调严格的血糖水平控制,以降低脑血管病并发症的发生率。
5.3公共卫生
在非重大传染病流行期间,脑血管病的死亡率一般呈现季节性变化,而在如SARS-CoV等传染病流行期间,死亡率则出现波动。一项针对中国台湾的人口学研究显示,与非SARS流行时期相比,SARS流行期间由脑血管疾病引起的地区死亡率显著增加了6.2%[18]。脑血管疾病属于受众较广的疾病,容易受到短期医疗保健服务减少的影响。统计学分析显示,疾病流行期的卫生保健使用率较平常下降了20%,统计后的脑血管病死亡率也大幅上升。
由此可见,脑血管病患者的死亡率增高受多方面因素影响,不仅应追溯脑血管病的疾病本身,也应考虑到易感人群因为害怕暴露于感染风险之下而避免就诊的因素,从而延误疾病的诊疗;另一至关重要的是,应确保对慢性病患者进行持续的疾病管理,以避免并发症的发生和降低死亡风险。因为对于有脑血管疾病风险的患者,其突然中断医疗服务的可能性更大,可能对这些患者造成不良后果。
06
呼吸道损伤因子与血管活性物质
造成COVID-19高病死率及重症率的主要原因在于其对呼吸系统的损害,大量的肺泡损伤和进行性呼吸衰竭可能导致疾病严重发作甚至死亡,而各类因子的活化则为导致呼吸系统损伤的重要环节。在复杂的病理生理学反应中,众多血管活性物质与SARS-CoV-2的感染密切相关。在基于武汉市感染人群的最初研究中,患有高血压病的患者比例高达15%,而高血压病同样是脑血管疾病发生和发展的重要危险因素,容易合并存在[12]。当脑血管病患者同时合并高血压病等疾病时,则需要充分了解此病的疾病特点,考虑药物的不良反应,从而更加合理地减轻对各系统的损害。
对社区老年高血压病患者的用药情况分析研究显示[24],在使用西药的患者中,使用较多的为血管紧张素Ⅱ受体拮抗剂(angiotensin-converting enzyme inhibitor, ACEI) ,因受众较广,故而需慎重选择降压 药物。ACEI 、血管紧张素Ⅱ受体阻滞剂(angiotensin receptorblocker, ARB)等降压药物的作用原理主要在于其可抑制肾素-血管紧张素-醛固酮系统(renin-angiotensinaldosterone system, RAAS),但同时此类药物也可上调ACE2表达水平。ACE2不仅可以介导SARS-CoV-2的感染,且其表达减少会加重肺部损伤进展[25],又与病毒感染后肺部急性损伤过程密切相关。在RAAS中,ACE2起着重要的调控作 用(如图1右下所示)[26-28]。现有研究表明,同为降压药物的肾素抑制剂阿利吉仑对ACE2表达有一定的下调作用[29]。
另一方面,因为ACE能够降解缓激肽,故使用 ACEI治疗期间产生的不良反应如刺激性干咳与缓激肽水平升高有关。在气道上皮细胞中,缓激肽是导致气道微血管渗漏和血管通透性增加的有效诱因,参与上呼吸道与下呼吸道的急性反应,导致血管长时间渗漏[30-31]。多项研究结果显示,不同于ACEI,肾素抑制剂在维持了对RAAS系统各成分的抑制作用的同时[32],不影响血浆及血管内皮细胞中缓激肽的降解,不会引起缓激肽累积,进而更大程度地避免对呼吸系统的刺激[33]。
考虑到SARS-CoV-2感染可能导致患者RAAS失衡[34],故作者认为,用于COVID-19患者的治疗可考虑选用作用于肾素-血管紧张素系统的ARB类药物,或可老药新用。
SARS-CoV-2作为新发现的病毒,现仍缺乏对其全面的病理生理学作用机制研究。对于心脑血管病患者,常合并高血压病风险,选用降压药物时需要综合考虑对于RAAS的影响。ACE2对于此系统有重要的调节作用,当其表达减少时,可能会加重急性肺损伤,无法发挥保护作用;而当其表达增加时,又可能使人群更加易感。临床上应慎用ACEI、ARBs类 药物,酌情考虑使用肾素抑制剂,以更好地为临床患 者规避风险,提供更个体化的治疗。ACE2的表达含量与临床预后之间的关系仍需更深一步的研究探索。
COVID-19的疫情控制形势仍然严峻,希望通过本文增强临床一线工作者对于脑血管病患者的关注度,为应对其并发症、潜在的系统损害提供参考和依据。
参考文献请见原文
本文作者

宋海庆
神经病学博士 主任医师
首都医科大学宣武医院神经内科 副主任
主要从事脑血管病和认知障碍的机制、干预及流行病学研究。

王 族
现就读于首都医科大学宣武医院神经内科,师从宋海庆教授。主要研究方向为脑血管病与认知障碍。






