
文章来源:中国脑血管病杂志, 2021, 18(10):724-727.
作者:张玥 刘思文 张丽花 周琪
基金项目:吉林省科技发展重点研发计划(20200404171YY)
通信作者:周琪,Email:zhou_qi@ jlu.edu.cn
摘要:新生儿颅内血管畸形临床罕见,为毛细血管畸形-动静脉畸形(CM-AVM)综合征的表现形式之一,临床可表现为皮肤CM、肺动脉高压、心功能不全,甚至心力衰竭等,但新生儿期可无皮肤及神经系统典型表现,易被漏诊、误诊。作者报道了1 例CM-AVM 综合征患儿,并结合文献分析其临床表型和基因特点,提示对于新生儿早期出现不明原因心力衰竭或肺动脉高压怀疑该病的患儿,应详细询问家族史,并进行AVM 和AVF 筛查;对于明确存在CM-AVM 综合征相关家族史者,建议进行详细的遗传咨询及产前或植入前诊断,必要时行基因检测。
毛细血管畸形(capillary malformation, CM)-动静脉畸形(arteriovenous malformation,AVM)综合征是一种以皮肤多灶性CM 伴或不伴高流量血管病变为特征的常染色体显性遗传性疾病[1],分为RASA1 基因变异导致的CM-AVM 综合征1与EPHB4 基因变异导致的CM-AVM 综合征2[2]。CM 也称为葡萄酒色斑或鲜红斑痣,是最常见的血管畸形,可发生于0. 3%的新生儿中[3],为低流量血管病变。AVM 是由扩张的动脉和静脉组成的血管畸形,与动静脉瘘(arteriovenousfistula,AVF)同属于高流量血管病变的表现形式,可出现在皮肤、肌肉、骨骼、内脏器官和大脑中,并可能导致致命的并发症,如出血、充血性心力衰竭或神经系统疾病等[1]。约三分之一的CM-AVM 综合征患者存在高流量血管病变,目前尚无国内婴儿或新生儿患病率的相关数据报道。约8%的CM-AVM 综合征患者存在颅内AVM 或AVF,而新生儿颅内AVM 或AVF 患病率国内尚无相关报道。现回顾性分析我院确诊的1 例表现为颅内血管畸形的新生儿CM-AVM 综合征临床资料,并进行相关文献复习,探讨RASA1 基因变异所致CM-AVM 综合征的临床表型和基因特点。
患儿
女,5日龄,系1 胎1 产,出生胎龄38 + 5周,出生体质量4. 055 kg,出生史无异常。因呼吸困难6 h于2020 年2 月24 日收入吉林大学第一医院新生儿科,病程中无发热、抽搐,母乳喂养,自行分次进乳,尿便正常。孕期未规律产检。入院体格检查:头围34 cm,体质量4. 055 kg,一般状态及反应可,皮肤及巩膜中度黄染,皮肤无出血点及皮疹,前囟平,无紧张,瞳孔对光反射正常,呼吸52 次/ min,三凹征阳性,双肺呼吸音粗,可闻及中小水泡音,四肢肌张力正常,原始反射减弱。门诊肺部多排CT:左上肺门增大,双肺炎性改变,心影增大。入院后心脏彩色多普勒超声:动脉导管未闭,卵圆孔未闭,左心房、右心房及右心室增大,二、三尖瓣反流。经颅多普勒超声:颞枕部可见走行迂曲的条形无回声,其内血流信号充盈,彩色多普勒频谱显示为静脉频谱,考虑颅内血管畸形。完善头部多排CT 平扫(图1a):左侧额颞顶枕叶脑表面、双侧枕部颅内外、大脑镰及小脑幕多发血管畸形。头部MRI +扩散加权成像+ MR 血管成像(图1b ~ 1d):左侧大脑中动脉、后动脉及其分支明显增粗迂曲,考虑AVM。
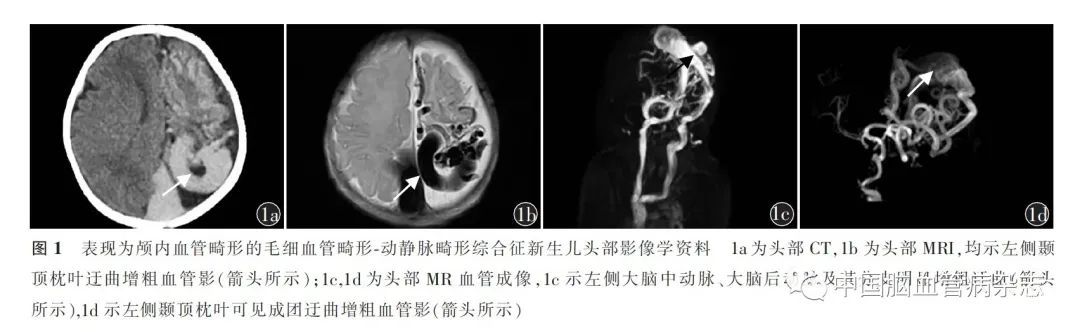
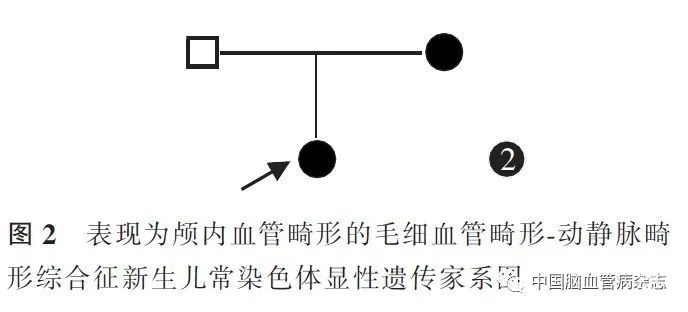
MR 静脉成像:左侧额颞顶枕叶脑表面、双侧枕部颅骨内板下、大脑镰、小脑幕异常血管影。临床诊断为颅内AVM,同时伴有心功能不全。因患儿家长考虑预后不佳放弃治疗,于入院第5 天离院。后随访患儿于出院后3 d 因呼吸衰竭而死亡。为明确病因,住院期间患儿作为先证者行全外显子基因检测,结果显示,患儿第5 号染色体上的RASA1 基因存在杂合突变c. 2035C > T(p. R679X)[chr5:86672233],为常染色体显性遗传(图2)。
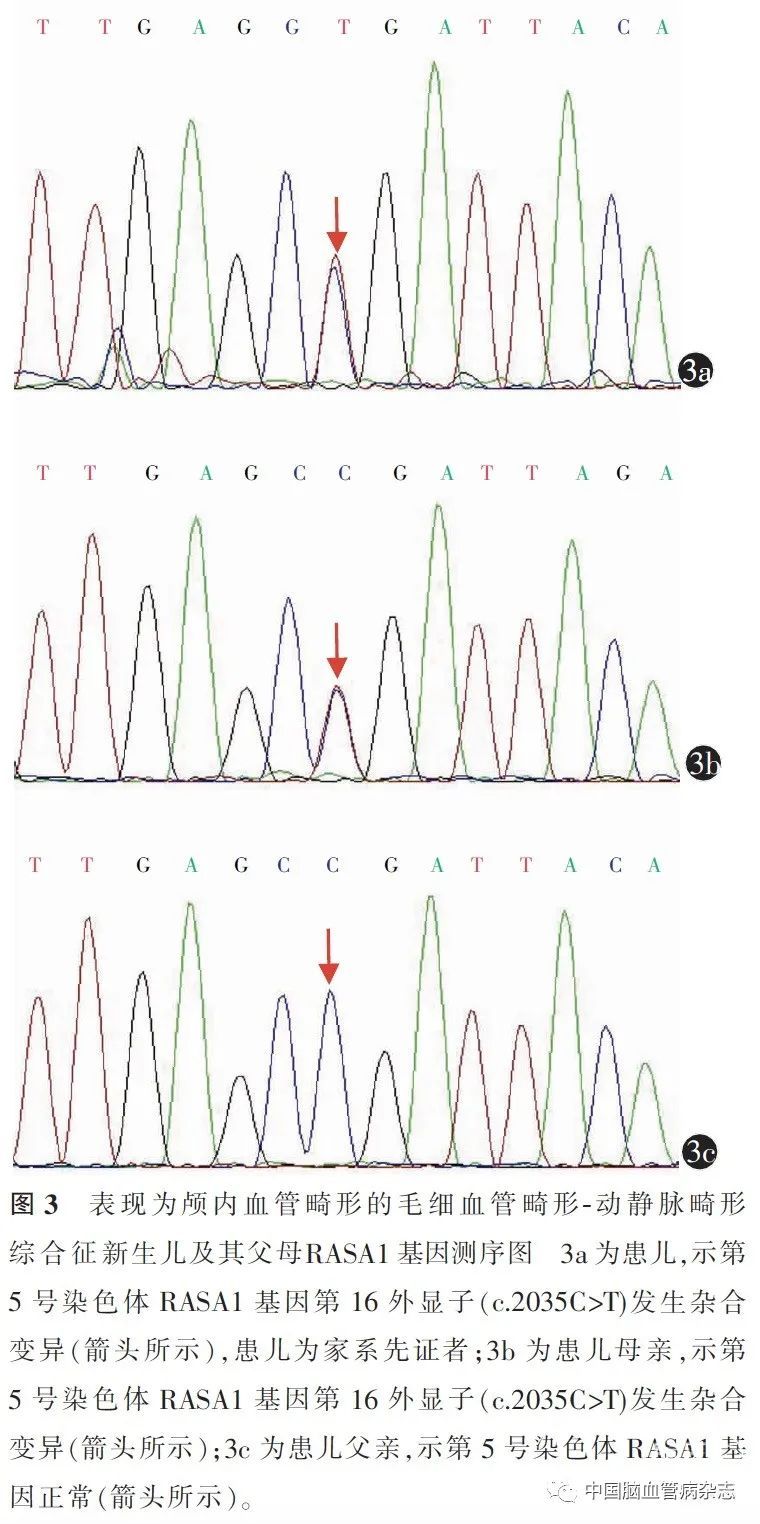
后对其父母进行基因验证,结果为其母携带该位点变异(杂合),其父该位点为正常基因型(图3a ~3c)。c.2035C > T (exon16,NM _002890)导致氨基酸改变p. R679X,Clin Var 数据库将该位点判定为致病突变。明确该患儿为CM-AVM 综合征。
讨论
以“毛细血管畸形-动静脉畸形” “新生儿” “RASA1 基因” “颅内血管畸形” 为关键词, 检索 中国知网、 维普数据库 和 万方数据库, 以“Capillary malformation-arteriovenous malformation”“Neonate”“RASA1 gene”“Intracranial vascular malformations” 为关键词 检索生物医学文献数据库 (PubMed) ,检索自建库至 2020年7月收录的文献,共纳入5 篇病例报道,共5 例患儿[4-8],均为国外文献,其中出生时明确存在皮肤CM 者2 例[7-8],有1 例在4 月龄时出现四肢多发CM[5],另外2 例未进行相关描述。5 例患儿均存在颅内高流量血管病变;其父或母存在皮肤CM 表现,且经基因检测均存在RASA1 基因变异。有4 例患儿明确存在RASA1 基因变异[4-7],1 例未进行相关描述。有4 例患儿合并心脏扩大、心功能不全,甚至心力衰竭表现[4-5,7-8],有3 例患儿合并肺动脉高压[5-6,8]。有4 例患儿已接受手术治疗[5-8],主要方式为栓塞手术,有1 例患儿准备接受手术治疗;已接受手术治疗的4 例患儿中有3 例心功能逐渐好转,但早期存在轻度发育落后[5,7-8],另外1 例患儿预后未进行相关描述。本例患儿虽然无皮肤CM 表现,但根据头部影像学检查明确存在颅内AVM,同时伴有心功能不全,且该患儿及其母亲已证实存在RASA1 基因变异,故CM-AVM综合征诊断明确,且预后不佳。该患儿母亲存在RASA1 基因突变,但因其并无皮肤CM、心血管系统及神经系统等相关症状,故而未行心脑血管相关检查。
CM-AVM 综合征是与RASA1 基因变异相关的常染色体显性遗传疾病,于2003 年由Eerola 等[1]首次报道,其发生在1∶ 10 万的人群中[9],约78%由RASA1 基因变异引起[10]。该基因位于染色体5q,其编码的Ras-GTPase 激活蛋白p120RasGAP位于细胞质中,在人体组织中广泛表达,可负性调控Ras 活性并影响血管生成[10-11]。因此,该基因变异可能会产生高反应性血管生成环境,导致不受控制的血管生长。有研究报道,缺乏该蛋白的小鼠具有血管缺陷,甚至导致死亡[9]。2017 年Amyere 等[2]的一项研究提出,非RASA1 基因变异的CM-AVM 综合征患者中检测到存在EPHB4 基因变异现象。Vivanti 等[12]报道的52 例Galen 畸形静脉患儿中,10% (5 例)存在EPHB4 致病变异。人EphB4 是EPHB4 基因编码的跨膜Eph 受体酪氨酸激酶,由RASA1 基因编码的Ras-GTPase 激活蛋白p120RasGAP 是EPHB4 的直接下游效应子,EPHB4 基因变异可导致体外EphB4 的磷酸化活性丧失,使EphB4-RASA1 信号轴传导异常,从而影响脑血管发育[13]。故将由RASA1 变异导致的综合征命名为CM-AVM1,由EPHB4 基因突变导致的综合征命名为CM-AVM2[14]。本例患儿及其母亲的DNA 分析显示,RASA1 基因(c. 2035C >T)的第16 外显子突变,未检测到EPHB4 基因变异。已报道的5 例病例中有4 例患儿均检测到RASA1 基因变异,无EPHB4 基因变异,1 例患儿未进行相关描述,5 例患儿父母之一检测到RASA1 基因变异,由此可见,常见的CM-AVM 综合征多由RASA1 基因变异导致,为常染色体显性遗传。Amyere 等[2]亦提出CM-AVM2 患者中比尔斑及毛细血管扩张较CM-AVM1患者更常见,发病率分别约为1/12 000和1/20 000,但中枢神经系统AVM 发生率较低(3%比10% )。基因变异类型包括重复、缺失、移码突变等,目前尚无足够证据证明其表型及预后与基因变异类型相关。
CM-AVM 综合征在人群中具有较高的外显率,为90%~99% [14-15],且存在明显的临床异质性,同一家族中有患者仅有甚至无皮肤CM 表现[16]。这些畸形看起来多是皮肤上小的、圆的、粉色或红色斑点,其中有多达一半具有变白的晕圈,多普勒超声显示其内存在动脉流动,出生时即可存在,随着时间的推移而逐渐增多[15]。Manzocchi 等[17]报道1 例女性患者40 岁才发现皮肤CM 表现。因此,尽管已报道的5 例患儿父母之一存在皮肤CM,但本例患儿母亲并未发现皮肤相关表现,仍不能除外本例患儿母亲随着时间推移而出现皮肤CM 的可能。有研究报道提出,除皮肤CM 表现外,有约三分之一的患者存在AVM 或AVF,最常见的位置为大脑、面部和四肢[10-11]。由于AVM 或AVF 中大量动脉血直接分流至静脉系统,导致回心血量增加,故新生儿极易出现肺动脉高压、心功能不全,甚至充血性心力衰竭等并发症,已报道的5 例患儿中有4 例患儿合并心脏扩大、心功能不全,甚至心力衰竭表现,其中有3 例患儿合并肺动脉高压。又因婴儿期静脉系统尚不成熟,若存在颅内AVM 和(或)AVF,可导致快速的脑损伤,一旦表现出固定的神经功能缺损,其恢复的可能性就大大降低,所以,对于新生儿早期出现不明原因心力衰竭或肺动脉高压怀疑该病的患儿,应详细询问家族史,尽早进行颅内和脊髓AVM 和(或)AVF 筛查,有助于在严重的神经系统损伤发生之前检测出潜在的颅内或脊髓动静脉异常,对于不确定者需进一步行RASA1 基因检测[10],必要时行EPHB4 基因检测[18],在遗传检测结果协助疾病确诊前,可根据新生儿的临床表现、多普勒超声及影像学检查特征进行临床诊断,早期采取治疗措施,从而改善预后,降低病死率。已报道的5 例患儿中有4 例已接受手术治疗。本例患儿未接受手术治疗,于出院后3 d 因呼吸衰竭而死亡,病程中均未发现皮肤CM 表现,因此,表现为颅内血管畸形的CM-AVM 综合征新生儿早期可无皮肤CM 表现及抽搐等典型的神经系统症状,这对新生儿期无神经系统症状的患儿的诊断带来了一定困难。该病预后较差,早期手术治疗为目前主要的治疗手段。因此,详细了解患儿的家族史,及时进行相关基因检测对早期诊断与治疗尤为重要[16]。
RASA1 基因检测是CM-AVM 综合征诊断的重要工具,虽然其突变类型与临床严重程度尚无明确相关性,但一个家系中一旦有确诊患者,其家庭成员则需筛查是否存在相关临床表现,进一步检测是否存在AVM 或AVF,还需进行精确的遗传咨询以及产前或植入前遗传学诊断[14]。遗传咨询是为个人和家庭提供有关遗传的性质、遗传方式和遗传疾病影响信息的过程,以帮助患者及其家系成员做出明智的医疗和个人决定[14],建议先证者或其受影响父母孕前进行相关遗传咨询,以确定遗传风险。产前诊断可用于确定胎儿是否患有特定疾病,为预防出生缺陷的有效手段。D′Amours 等[19]报道,CM-AVM 综合征的产前表现并不常见,但大多数(10 /15)表现为产前超声检测到颅内AVM 或AVF,而颅内AVM 或AVF可引起不可逆性神经系统损伤,因此对于产前规律产检发现羊水过多或过少、胎儿发育异常或可疑畸形、有遗传病家族史等情形者,建议进行产前诊断检查,可使用侵入性方法如绒毛膜绒毛取样进行RASA1 基因检测,以达早期诊断。植入前遗传学诊断即胚胎植入前遗传学诊断或筛查,也称第三代试管婴儿技术,是指在体外受精胚胎移植术前,取胚胎的遗传物质进行分析,诊断是否有异常,以筛选健康胚胎移植,防止遗传病基因的传递,适用于想要繁育后代,本身却患有高遗传风险疾病的人群,包括单基因遗传病和染色体结构畸变患者[20]。CM-AVM 综合征为常染色体显性遗传病,因此对于已知的携带RASA1 杂合突变的育龄女性,可通过第三代试管婴儿技术在胚胎植入前进行遗传物质分析,以避免孕有基因缺陷儿童,同时还可减少因发现胎儿缺陷后引产对孕母造成的伤害。
综上,本研究通过对RASA1 基因变异致CM-AVM 综合征,表现为颅内血管畸形新生儿1 例进行报道并复习文献发现,新生儿期起病的CM-AVM 综合征患儿多由RASA1 基因变异所致,为常染色体显性遗传。存在颅内AVM 或AVF者,在新生儿期可以心功能不全、心力衰竭或肺动脉高压为首发症状,而缺乏典型的皮肤CM 表现或神经系统相关症状;延迟诊断及治疗可能会引起神经系统不可逆性损伤,早期诊断并外科手术干预尤为重要。因此,存在CM-AVM 综合征相关家族史者,建议孕前进行详细遗传咨询,植入前行遗传物质分析,产前完善相关检查,必要时行RASA1 基因检测,以达优生优育目的。






