作者:魏婧1(第一作者),邹治凡2,李继平3,张宇清3(通讯作者)
单位:1首都医科大学生物医学工程学院,2首都医科大学生理学与病理生理学系,3首都医科大学宣武医院功能神经外科
Wei J, Zou Z, Li J, Zhang Y. Gamma Oscillations and Coherence Are Weaker in the Dorsomedial Subregion of STN in Parkinson's Disease. Front Neurol. 2021 Sep 7;12:710206. doi: 10.3389/fneur.2021.710206. PMID: 34557146
宣武医院功能神经外科张宇清教授团队,与首都医科大学生物医学工程学院魏婧老师合作,发现PD患者静息状态下的gamma振荡幅值小于beta活动幅值,且STN区背内侧的gamma活动明显低于背外侧区。STN区的背外侧部分接收来自初级运动皮层的传入投射,而其背内侧区域接收来自辅助运动区的投射,来自辅助运动区的投射要弱于来自初级运动皮层的投射[36],基于此原因,STN区的不同亚区在运动功能的执行中发挥不同的作用,这可能也是这两个区域中gamma活动特性不同的原因。
丘脑底核(subthalamic nucleus, STN)的深部脑刺激(deep-brain stimulation,DBS)是一种可以缓解晚期帕金森病(Parkinson’s disease,PD)运动症状的有效疗法。由于缺乏对STN区详细组织结构特性的研究,如何在STN区内精准确定最有效的DBS刺激靶点是目前的研究热点。目前,已有一些关于STN区内不同深度拓扑特性的探讨,而对其不同旁开位置特性的研究则比较少。本研究主要探索STN背内侧和背外侧亚区的局部场电位(local field potential,LFP)分布特性,旨在为临床精准定位DBS刺激靶点提供技术支持。
帕金森病(Parkinson’s disease,PD)是一种由黑质致密部多巴胺能神经元变性引起的运动障碍,其病生理特征是皮层-基底节回路发生异常振荡活动,而同步振荡是用来衡量不同神经元群体之间相互作用的关键机制之一[1]。
已有研究发现,PD患者丘脑底核(subthalamic nucleus,STN)存在显著增强的beta振荡[2],并发现这个异常振荡与PD的运动症状密切相关[3,4]。此外,也有报道称beta振荡在左旋多巴药物和高频深部脑刺激(deep-brain stimulation,DBS)作用下会减弱[5,6]。因此beta振荡被认为可以抑制运动,而且在PD的运动迟缓和强直症状中也起重要作用[4,7]。与此相反,被认为具有“促运动”作用的gamma振荡活动在运动过程中会显著增强[8],特别是精细调谐的gamma振荡(finely tuned gamma,FTG)[9-11]。类似现象在服用抗帕金森药物或采用深度脑刺激治疗的PD患者中均可观察到。基于以上研究结果,我们推断出,临床疗法对PD的治疗可能是通过重新平衡异常神经回路中的抑制和促进运动的神经节律来实现的[12,13]。
STN-DBS是治疗晚期PD的有效疗法,尤其对运动迟缓、震颤和僵硬等症状改善明显[14]。但目前DBS存在的副作用也不可忽视,究其原因,可能是因为STN区是一个复杂的核团,对其详细的组织结构特性的研究还比较有限。目前已有的研究集中在对STN区不同深度的拓扑特性的探讨,而对不同旁开位置特性的研究则比较少。多数研究认为STN区背外侧的运动亚区是DBS的最佳刺激靶点,可以最佳的临床效果和最小的副作用[15,16]。也有人提出可以通过结合STN内不同深度下的不同频率特性,从而自动估计DBS电极的最佳轨迹[17]。还有研究称在抽动秽语综合征中,STN区特定深度下单个神经元的放电模式特性可以为DBS最佳刺激靶点位置的选择提供技术参考[18]。
本研究团队在临床中发现,部分PD患者STN区的背外侧亚区距离内囊较近,因此位于该亚区的DBS电极的刺激作用会扩散至内囊,导致患者出现眼球偏斜、肢体或面部肌肉痉挛等症状。这种情况下,我们考虑将DBS电极进行重新定位,把电极向内侧移动2-3mm,最终将其放置于STN区的背内侧位置,可达到临床效果佳而副作用小的目的。伴随着这个过程,我们在术中可以获取STN背内侧和背外侧两个亚区的局部场电位(local field potential,LFP)信号,为研究STN区异常的神经电生理特性提供了宝贵的临床资料。
2017年1月至2018年12月期间,共有303名PD患者接受了双侧STN-DBS手术,最终18名患者被纳入本研究,虽均为双侧STN-DBS植入术,但电极再植入术仅发生在一侧大脑,因此只记录到了这一侧的LFP信号。这些患者中7例为女性,11例为男性,平均年龄55.30±9.11岁,病程9.83±4.15年。术前左旋多巴日等效剂量当量(levodopa equivalent daily dose,LEDD)为749.78± 248.10mg/天。相对于基线Med-off状态,Med-on state状态下UPDRS-III评分改善了57.30±14.45%,术后6个月随访时,Med-off/Stim-on状态改善了61.50±21.30%,而Med-on/Stim-on状态改善了76.17±16.48%。
图1A所示为一根DBS电极的示意图,0、1、2和3表示电极上的四个触点,触点0最靠近腹侧,触点3最靠近背侧。图1B表示两两相邻电极触点对记录到的一段3通道LFP信号(触点0-1,1-2和2-3)。
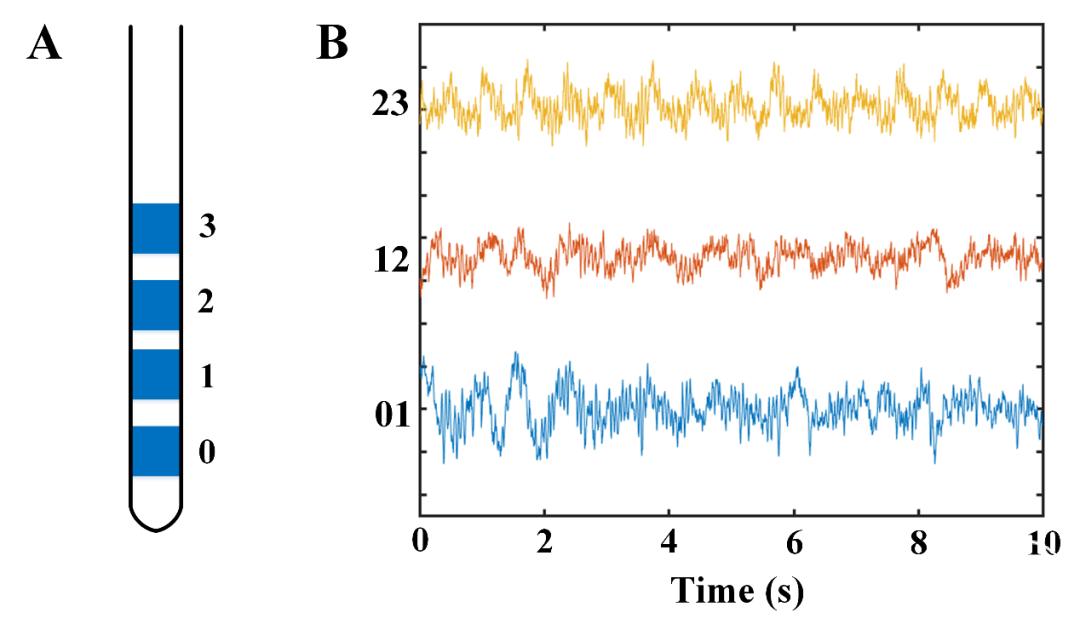
图1. STN区植入DBS电极的示意图和LFP记录。(A)DBS的四个电极触点。触点0为底部触点,触点3为顶部触点。(B)STN区电极三个触点对的LFP信号示例。X轴表示时间,Y轴表示触点对的名称。蓝线:触点对0-1的LFP;红线:触点对1-2的LFP;黄线:触点对2-3的LFP。
图2表示1例PD患者STN区LFP信号的时频图和功率谱密度图。从图2A时频图的所示的定性结果来看,可以观察到一条明显的beta振荡条带(13–30 Hz)以及一条较弱的gamma振荡(100–110 Hz)条带。进一步的定量功率谱图同样显示,beta和gamma振荡幅度显著增强。值得一提的是,gamma功率的增强只出现在部分患者中,具体数值结果为,STN区背内侧亚区组别为33.3%,而背外侧亚区组别为72.2%。
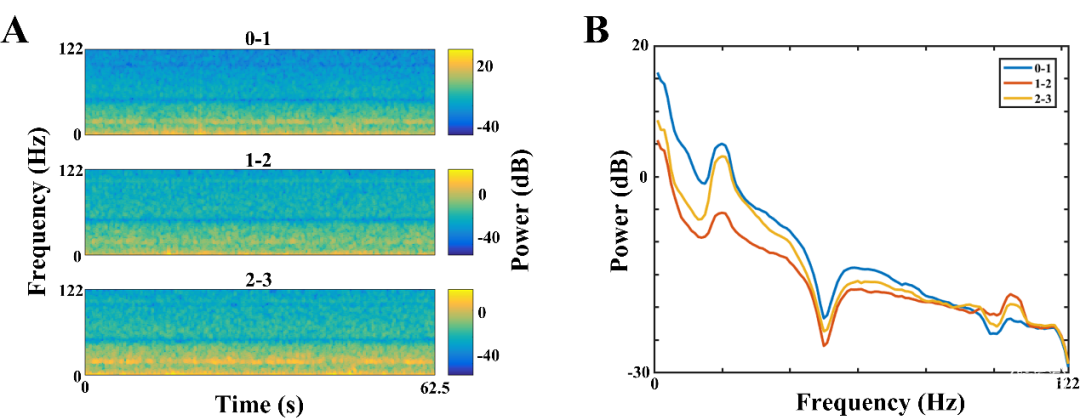
图2. 电极对的时频图与功率密度图。(A)一位代表性患者的STN区三个电极对的LFP的时频图。时频图具有一个时域X轴和频域Y轴,使用颜色来表示功率大小(dB),颜色图例在各时频图的右侧。目测结果显示,STN区有较明显的beta(13-30Hz)波段和较不明显的gamma(100-110Hz)波段。(B)同一患者的STN区三个电极对的LFP的功率密度图(蓝色代表0-1电极对,红色代表1-2电极对,黄色代表2-3电极对)。X轴表示频率(Hz),Y轴表示功率(dB)。功率密度图显示,受试者beta和gamma振荡幅度增加。
将所有PD患者每个STN亚区组别所有电极对的功率谱结果分别进行平均,得到每个组别的平均功率谱结果,背内侧亚区的beta能量为0.282±0.073,而背外侧组别的结果为0.421±0.075,但是两组结果显示没有统计学差别。相反,对于gamma振荡而言,STN区背外侧的gamma能量(0.0611±0.019)显著强于背内侧组(0.0173±0.003)。
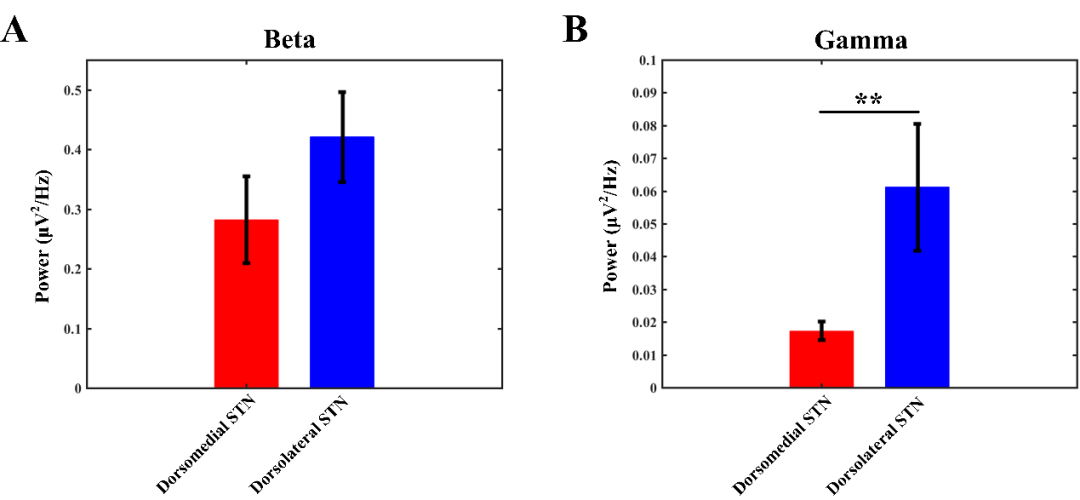
图3. 18名患者STN区背内侧与背外侧beta与gamma的功率比较。(A)beta功率图。(B)ganmma功率图。图中功率数值为实验组内所有有效功率的平均值。红色柱表示STN区背内侧,蓝色柱表示STN区背外侧。误差条表示标准差,**表示p<0.01。
为了衡量STN区不同深度神经信号之间的相互关系,计算了两两电极对之间beta和gamma振荡的相干值(触点0-1和1-2,1-2和2-3,0-1和2-3),然后再将一根电极所得到的三个相干值作平均,代表电极所在亚区神经信号间的相互作用。最终结果表明,STN区背外侧(0.221±0.023)和背内侧(0.245±0.028)亚区间的beta频段相干值无统计学差别,但是STN区背外侧组gamma频段的相干值(0.237±0.038)显著强于背内侧组(0.128±0.016)。
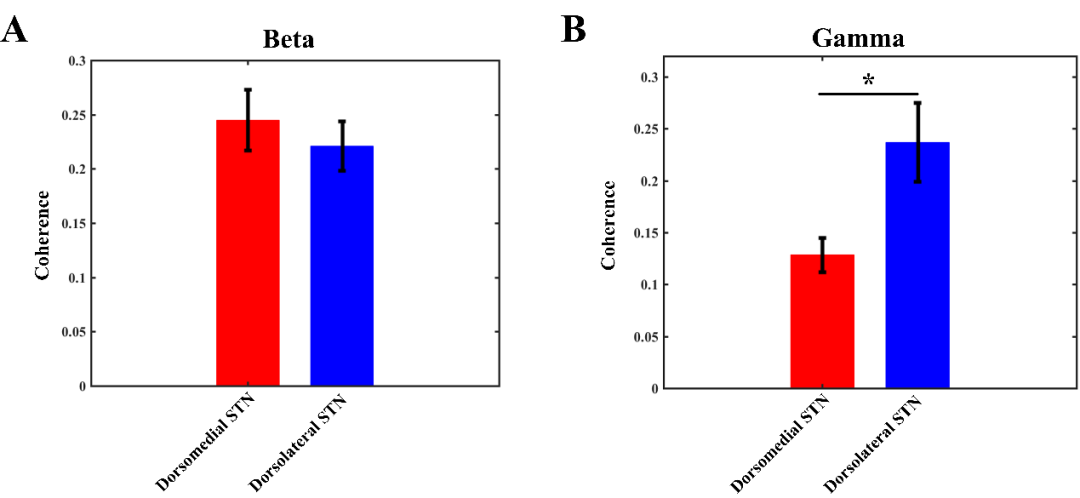
图4. STN区背内外侧beta与gamma的平均相干值。(A)beta的平均相干值。(B)gamma的平均相干值。红色代表STN背内侧,蓝色代表STN背外侧。*代表p<0.05。
本研究在DBS电极植入手术中对18例PD患者单侧STN区背内测和背外侧亚区的LFP信号进行记录分析,得到了两个主要发现:(1)STN区背外侧和背内侧两组间的beta振荡和相干性无明显差异;(2)STN区背内侧的gamma振荡和相干性均低于其背外侧亚区。
STN区背内侧和背外侧两组间的beta振荡和beta相干性均无统计学差别
已有研究表明,PD疾病中异常增强的beta振荡会破坏皮层-基底节环路中神经信息的编码和处理能力[19,20],进而引起运动障碍的发生。有研究团队发现,PD患者的苍白球和皮层之间以及STN区和皮层之间均存在增强的beta相干性,而这个异常的电生理指标和PD的病生理改变具有相关性[21-23]。进一步地,也有研究发现STN区的背侧区域存在高beta频段的相干性增强,这个增强和PD患者药物关期状态下的运动迟缓和僵直症状的严重程度呈正相关关系[24]。
根据PD患者术中电生理信号的分析结果,研究者发现具有beta频带发放特性的神经元和beta振荡的峰值都位于STN区的背外侧运动亚区,这个亚区也是可以获得最佳临床疗效的DBS刺激靶点[25-28]。然而,内囊邻近STN区的外侧部。对于某些PD患者来说,如果STN区背外侧部与内囊距离过近,在DBS刺激过程中可能会产生副作用。有研究认为,这是由于刺激电流扩散到了内囊中的锥体束纤维,损害了皮质脊髓和皮质延髓通路中的神经信息传递模式[29]。在本研究中,为了避免内囊引起的副作用,将刺激电极向内侧移位2mm,因此可以依次将STN区背外侧区域的背外侧和背内侧的LFP信号记录下来。结果发现,两个亚区中的beta振荡和相干性没有显著差别。事实上,我们所分析的LFP信号仅仅来源于术中的单根刺激电极,而整个STN区背外侧区域的神经振荡特性是否和我们所分析的结果保持一致,还有待进一步分析。但是值得注意的是,将DBS刺激电极植入到STN区的背内侧区域,同样可以获得很好的临床治疗效果,这也提示我们这个亚区可能也是一个DBS的潜在靶点。
STN区背内侧的gamma振荡和相干性显著弱于背外侧区域
Beta频段与gamma频段是一对互为拮抗的神经电活动[13],有研究表明左旋多巴药物治疗与DBS治疗都是通过减少beta振荡的同步化,同时促进gamma频段同步化而起作用的[19,30,31]。也有研究揭示,gamma频段的能量与gamma频段的爆发式放电率都与PD患者的运动障碍呈负相关[32]。更有研究认为,gamma振荡的增强是用来代偿异常增强的病理性beta振荡的,进而改善PD的运动迟缓症状[10,33]。总的来说,gamma振荡可以促进自主运动时的运动功能。
早期研究发现,gamma振荡在STN区的上部和不确定带的边缘较强[34],进一步研究还发现,在PD患者发生较强震颤时,其STN区背侧的低频gamma振荡和其相干性会显著增强,提示gamma频段的电活动参与了感觉运动功能的执行。还有研究认为gamma振荡可能是通过对STN区的下游神经元产生影响,从而间接参与了震颤症状的产生[35]。我们的研究发现,静息状态下的gamma振荡幅值小于beta活动幅值,且STN区背内侧的gamma活动明显低于背外侧区。STN区的背外侧部分接收来自初级运动皮层的传入投射,而其背内侧区域接收来自辅助运动区的投射,来自辅助运动区的投射要弱于来自初级运动皮层的投射[36],基于此原因,STN区的不同亚区在运动功能的执行中发挥不同的作用,这可能也是这两个区域中gamma活动特性不同的原因。
本研究发现,在PD患者STN区的背内侧和背外侧亚区中,beta频段的电活动特性没有显著差别,而gamma频段的电活动特性在STN区背内侧区域表现较弱。这个结果提示我们,gamma频段的振荡和相干性可以用来区分STN区的不同亚区,同时STN区的背内侧区域可能是DBS治疗PD的一个潜在刺激靶点。
首都医科大学宣武医院功能神经外科
医学博士,主任医师,研究生导师
迄今为止已独立完成运动障碍病(帕金森病、原发性震颤、多系统萎缩、扭转痉挛,痉挛性截瘫、脑瘫等)手术5000余例
担任中国神经调控联盟常务理事
[1]SIEGEL M, DONNER T, ENGEL A J N R N. Spectral fingerprints of large-scale neuronal interactions [J]. 2012, 13(2): 121-34.[2]POSTUMA R, BERG D, STERN M, et al. MDS clinical diagnostic criteria for Parkinson's disease [J]. Movement disorders : official journal of the Movement Disorder Society, 2015, 30(12): 1591-601.[3]LITTLE S, POGOSYAN A, KUHN A, et al. β band stability over time correlates with Parkinsonian rigidity and bradykinesia [J]. Experimental neurology, 2012, 236(2): 383-8.[4]CHEN C, HSU Y, CHAN H, et al. Complexity of subthalamic 13-35 Hz oscillatory activity directly correlates with clinical impairment in patients with Parkinson's disease [J]. Experimental neurology, 2010, 224(1): 234-40.[5]NEUMANN W, DEGEN K, SCHNEIDER G, et al. Subthalamic synchronized oscillatory activity correlates with motor impairment in patients with Parkinson's disease [J]. Movement disorders : official journal of the Movement Disorder Society, 2016, 31(11): 1748-51.[6]OSWAL A, BEUDEL M, ZRINZO L, et al. Deep brain stimulation modulates synchrony within spatially and spectrally distinct resting state networks in Parkinson's disease [J]. Brain : a journal of neurology, 2016, 139: 1482-96.[7]LITTLE S, BROWN P. What brain signals are suitable for feedback control of deep brain stimulation in Parkinson's disease? [J]. Annals of the New York Academy of Sciences, 2012, 1265: 9-24.[8]TSANG E, HAMANI C, MORO E, et al. Subthalamic deep brain stimulation at individualized frequencies for Parkinson disease [J]. Neurology, 2012, 78(24): 1930-8.[9]ANDROULIDAKIS A, KüHN A, CHEN C, et al. Dopaminergic therapy promotes lateralized motor activity in the subthalamic area in Parkinson's disease [J]. Brain : a journal of neurology, 2007, 130: 457-68.[10]LITVAK V, EUSEBIO A, JHA A, et al. Movement-related changes in local and long-range synchronization in Parkinson's disease revealed by simultaneous magnetoencephalography and intracranial recordings [J]. The Journal of neuroscience : the official journal of the Society for Neuroscience, 2012, 32(31): 10541-53.[11]MURALIDHARAN A, ZHANG J, GHOSH D, et al. Modulation of Neuronal Activity in the Motor Thalamus during GPi-DBS in the MPTP Nonhuman Primate Model of Parkinson's Disease [J]. Brain stimulation, 2017, 10(1): 126-38.[12]DE HEMPTINNE C, WANG D, MIOCINOVIC S, et al. Pallidal thermolesion unleashes gamma oscillations in the motor cortex in Parkinson's disease [J]. Movement disorders : official journal of the Movement Disorder Society, 2019, 34(6): 903-11.[13]MUTHURAMAN M, BANGE M, KOIRALA N, et al. Cross-frequency coupling between gamma oscillations and deep brain stimulation frequency in Parkinson's disease [J]. Brain : a journal of neurology, 2020, 143(11): 3393-407.[14]BARI A, FASANO A, MUNHOZ R, et al. Improving outcomes of subthalamic nucleus deep brain stimulation in Parkinson's disease [J]. Expert review of neurotherapeutics, 2015, 15(10): 1151-60.[15]DEMBEK T, REKER P, VISSER-VANDEWALLE V, et al. Directional DBS increases side-effect thresholds-A prospective, double-blind trial [J]. Movement disorders : official journal of the Movement Disorder Society, 2017, 32(10): 1380-8.[16]BENABID A, CHABARDES S, MITROFANIS J, et al. Deep brain stimulation of the subthalamic nucleus for the treatment of Parkinson's disease [J]. The Lancet Neurology, 2009, 8(1): 67-81.[17]TELKES I, JIMENEZ-SHAHED J, VISWANATHAN A, et al. Prediction of STN-DBS Electrode Implantation Track in Parkinson's Disease by Using Local Field Potentials [J]. Frontiers in neuroscience, 2016, 10: 198.[18]VISSANI M, CORDELLA R, MICERA S, et al. Spatio-temporal structure of single neuron subthalamic activity identifies DBS target for anesthetized Tourette syndrome patients [J]. Journal of neural engineering, 2019, 16(6): 066011.[19]SWANN N, DE HEMPTINNE C, MIOCINOVIC S, et al. Gamma Oscillations in the Hyperkinetic State Detected with Chronic Human Brain Recordings in Parkinson's Disease [J]. The Journal of neuroscience : the official journal of the Society for Neuroscience, 2016, 36(24): 6445-58.[20]TINKHAUSER G, POGOSYAN A, LITTLE S, et al. The modulatory effect of adaptive deep brain stimulation on beta bursts in Parkinson's disease [J]. Brain : a journal of neurology, 2017, 140(4): 1053-67.[21]HIRSCHMANN J, ÖZKURT T, BUTZ M, et al. Distinct oscillatory STN-cortical loops revealed by simultaneous MEG and local field potential recordings in patients with Parkinson's disease [J]. NeuroImage, 2011, 55(3): 1159-68.[22]WANG D, DE HEMPTINNE C, MIOCINOVIC S, et al. Subthalamic local field potentials in Parkinson's disease and isolated dystonia: An evaluation of potential biomarkers [J]. Neurobiology of disease, 2016, 89: 213-22.[23]MüLLER E, ROBINSON P. Suppression of Parkinsonian Beta Oscillations by Deep Brain Stimulation: Determination of Effective Protocols [J]. Frontiers in computational neuroscience, 2018, 12: 98.[24]POGOSYAN A, YOSHIDA F, CHEN C, et al. Parkinsonian impairment correlates with spatially extensive subthalamic oscillatory synchronization [J]. Neuroscience, 2010, 171(1): 245-57.[25]ALAVI M, DOSTROVSKY J, HODAIE M, et al. Spatial extent of β oscillatory activity in and between the subthalamic nucleus and substantia nigra pars reticulata of Parkinson's disease patients [J]. Experimental neurology, 2013, 245: 60-71.[26]ZAIDEL A, SPIVAK A, GRIEB B, et al. Subthalamic span of beta oscillations predicts deep brain stimulation efficacy for patients with Parkinson's disease [J]. Brain : a journal of neurology, 2010, 133: 2007-21.[27]RODRIGUEZ-OROZ M, RODRIGUEZ M, GURIDI J, et al. The subthalamic nucleus in Parkinson's disease: somatotopic organization and physiological characteristics [J]. Brain : a journal of neurology, 2001, 124: 1777-90.[28]GUO S, ZHUANG P, ZHENG Z, et al. Neuronal firing patterns in the subthalamic nucleus in patients with akinetic-rigid-type Parkinson's disease [J]. Journal of clinical neuroscience : official journal of the Neurosurgical Society of Australasia, 2012, 19(10): 1404-7.[29]XU W, MIOCINOVIC S, ZHANG J, et al. Dissociation of motor symptoms during deep brain stimulation of the subthalamic nucleus in the region of the internal capsule [J]. Experimental neurology, 2011, 228(2): 294-7.[30]WANG D, DE HEMPTINNE C, MIOCINOVIC S, et al. Pallidal Deep-Brain Stimulation Disrupts Pallidal Beta Oscillations and Coherence with Primary Motor Cortex in Parkinson's Disease [J]. The Journal of neuroscience : the official journal of the Society for Neuroscience, 2018, 38(19): 4556-68.[31]DE HEMPTINNE C, SWANN N, OSTREM J, et al. Therapeutic deep brain stimulation reduces cortical phase-amplitude coupling in Parkinson's disease [J]. Nature neuroscience, 2015, 18(5): 779-86.[32]LOFREDI R, NEUMANN W, BOCK A, et al. Dopamine-dependent scaling of subthalamic gamma bursts with movement velocity in patients with Parkinson's disease [J]. eLife, 2018, 7.[33]FLORIN E, ERASMI R, RECK C, et al. Does increased gamma activity in patients suffering from Parkinson's disease counteract the movement inhibiting beta activity? [J]. Neuroscience, 2013, 237: 42-50.[34]TROTTENBERG T, FOGELSON N, KüHN A, et al. Subthalamic gamma activity in patients with Parkinson's disease [J]. Experimental neurology, 2006, 200(1): 56-65.[35]WEINBERGER M, HUTCHISON W, LOZANO A, et al. Increased gamma oscillatory activity in the subthalamic nucleus during tremor in Parkinson's disease patients [J]. Journal of neurophysiology, 2009, 101(2): 789-802.[36]THEODOSOPOULOS P, MARKS W, CHRISTINE C, et al. Locations of movement-related cells in the human subthalamic nucleus in Parkinson's disease [J]. Movement disorders : official journal of the Movement Disorder Society, 2003, 18(7): 791-8.声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。










