
脑膜瘤是成人中枢神经系统最常见的原发性肿瘤[1]。存在症状的患者通常接受外科手术,但目前尚无有效的药物治疗手段。目前认为WHO病理组织分型和手术切除范围(辛普森分级)与肿瘤复发直接相关,然而,这两种变量均无法准确预测所有脑膜瘤的临床病程[2]。来自多伦多大学的Zadeh教授和Aldape教授研究团队整合了脑膜瘤基因组、转录组和蛋白组信息,将脑膜瘤分为4种独具生物学特征的分子分型:免疫相关型(MG1)、良性NF2野生型(MG2)、高代谢型(MG3)和增值型(MG4);同时,研究人员证实了这种分型方法与现有分级系统相比,能够更准确的预测患者临床预后。该项研究成果2021年8月25日发表于《Nature》杂志。
近年来,多项关于脑膜瘤分子生物学的研究让我们对其基因背景认识更加深刻,为实现脑膜瘤分子分型提供了重要参考[3-8],然而,目前尚无研究对各类分子生物信息进行整合。作者纳入201例脑膜瘤样本,通过整合肿瘤DNA拷贝数变异,基因突变,DNA甲基化,转录组及蛋白组数据构建了脑膜瘤基因组图谱,在此基础上,作者还对部分样本进行了单细胞测序。类似于其他类型实体瘤[9-12],该研究通过整合脑膜瘤多组学数据成功构建了一个与患者临床预后相关的分子分型体系。
脑膜瘤样本及患者临床信息(Patient samples and clinical data)
研究人员纳入121例脑膜瘤样本进行分子分型,随后再纳入80例样本进行验证。所有样本中均包括WHO 1-3级脑膜瘤样本。该研究对肿瘤基因多态性,点突变及肿瘤染色体拷贝数变异进行了全外显子测序(whole-exome sequencing),对DNA甲基化状态进行了检测(EPIC array profiling);同时采用mRNA测序(mRNA sequencing)对实验组共121例脑膜瘤样本进行了转录组分析。研究人员还对其中96例样本进行了全细胞蛋白质组学分析(whole-cell proteomics)(Fig. 1a)。此外,该研究对5例健康人源脑膜组织进行了甲基化测序并将其设置为对照组;研究人员还纳入8例肿瘤样本和2例健康脑膜组织样本进行单细胞测序(single-nucleus RNA sequencing)以检测瘤内异质性。该研究中纳入的所有脑膜瘤样本均由2名神经肿瘤病理专家根据2016版WHO中枢神经系统肿瘤分级标准进行病理诊断和分级。此外,所有纳入的样本均具备完善的临床资料(Methods and Supplementary Table 1)。
数据类型的相互依赖性分析(Interdependencies of datatypes)
为了检验数据类型之间的相关性,研究人员计算了所有数据类型成对组合中每个基因之间的Mutual Information(MI)metric,并将其与置换空分布(a permuted null distribution)进行比较。MI值为零表示正交信息。结果显示,不同数据类型比较的MI值分布在统计学上显著不同(Extended Data Fig. 1a)。此外,对基因标准化MI值进行一致聚类后发现了四个不同的基因集群,每个基因集群都具备不同数据类型的独立特征。上述研究结果显示了在脑膜瘤中实现多种数据类型整合的潜在价值。
多平台整合分析(Multiplatform integrative analyses)
研究人员随后尝试整合WES和基因拷贝数,DNA甲基化和mRNA测序数据进行聚类分配(COCA)[9-12],通过这种方法实现二次分配,能够通过分子特征检测样本之的高阶关系。
根据CNAs、DNA甲基化和转录组数据进行聚类(unsupervised sample-wise clustering)后,在每种数据类型中均得到6个与临床特征及预后相关的稳定集群(Fig. 1b, Extended Data Fig. 1b, d, f)。不同数据类型之间的集群既不一致也不正交(Fig. 1c),同时,与预后相关的集群在每种数据类型中均是唯一的(Extended Data Fig. 1c, e, g)。
将上述CNAs、DNA甲基化和转录组3个类型数据中共18个集群结合起来进行COCA分析后得到4个与脑膜瘤相关的分子亚型(MG1-MG4)(Fig. 1d, Extended Data Fig. 1h)。RNA集群分配与MG1、MG3和MG4密切相关,而CNA和DNA甲基化集群分配与MG2密切相关,这些数据类型的相对重要性通过两种数据类型的正式无监督整合得到一次性证实(Supplementary Table 2)。除MG1型脑膜瘤中仅包括WHO 1级和2级肿瘤以外,其他3种类型脑膜瘤(MG2, MG3, MG4)均包括WHO1-3级肿瘤。较高WHO级别脑膜瘤更多见于MG3型和MG4型(Fisher’s exact test, P=5.49×10−7)。值得注意的是,上述脑膜瘤分子分型与WHO分级之间的一一对应关系并不明显,因此,研究人员对分子分型的临床相关性进行了研究。脑膜瘤分子分型临床特征(Clinical relevance of integrative molecular groups)
虽然上述4种脑膜瘤分子分型是否能够预测患者临床预后暂不得而知,但这些分子亚型之间患者无进展生存期存在显著差异(Fig. 1f)。总体而言,MG3型和MG4型脑膜瘤患者的复发时间较短(log-rank test, P=5×10−15),其中MG4型脑膜瘤最易短期复发。Cox多元回归分析结果显示,在考虑已知脑膜瘤预后相关因素的情况下(包括WHO病理分级,术中切除范围以及术后是否接受放疗),分子分型与肿瘤是否复发独立相关(Supplementary Table 3)。在依据WHO分级分析肿瘤复发情况时,各分子亚型的复发模式存在显著差异(Extended Data Fig. 1j–l)。根据该分子分型预测脑膜瘤复发时间效果优于前期报道的甲基化分类体系[3],以及单一数据类型聚类体系(Fig. 1f)。研究人员还通过mRNA特征在独立队列中证实了该分子分型的普适性(Extended Data Fig. 2),为后续独立验证和普适性评估提供了方向。
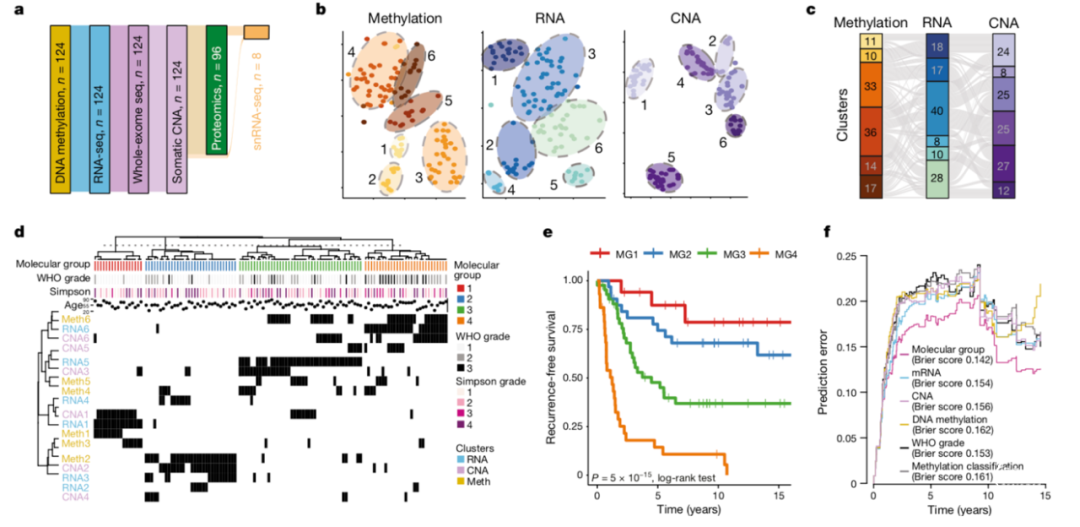
Figure 1. Integrative multiplatform analysis reveals four molecular groups of meningioma.
脑膜瘤分子分型的基因突变特征(Mutational profiles of molecular groups)
研究人员随后研究了脑膜瘤各分子亚型的基因突变特点。NF2是脑膜瘤中最常发生突变的基因,然而该突变在各类分子亚型中却存在显著差异(Fig. 2a, Extended Data Fig. 3a)。在几乎所有MG1型脑膜瘤均存在NF2突变,而这种突变在MG2型脑膜瘤中极为罕见(88% 比 9%; Fisher’s exact test, P=5.9×10−8)。相反,已报道的其他脑膜瘤相关基因如TRAF7、AKT1、KLF4和POLR2A突变仅存在与MG2型肿瘤中,频率分别为25%、13%、13%和6%(Fisher’s exact test, P=1.20×10−8)。
研究人员还发现了尚未报道的脑膜瘤相关驱动基因,包括参与染色质构建和表观遗传调控的基因(KDM6A、CHD2),肿瘤抑制基因(PTEN;Supplementary Table 4),染色质重塑基因(CREBBP,q=0.127)和肿瘤抑制基因(FBXW7,q=0.226;RB1,q=0.250)(Supple-mentary Table 4)。这些突变发生频率与其他目前已知的脑膜瘤驱动基因突变频率相似(3–5%, Fig. 2a),并且在脑膜瘤的侵袭性表型中共同富集,能够区分MG3型和MG4型肿瘤与MG1型和MG2型肿瘤(Fisher’s exact test, P=0.002)。与MG1–MG3型脑膜瘤相比,MG4型脑膜瘤具有更高的突变负荷(P=1.6×10−3, Kruskal–Wallis test; Extended Data Fig. 3b)。脑膜瘤中大多数点突变为克隆性,只有一小部分为晚期进化中的累积突变(Extended Data Fig. 3c–e)。由于分子亚型的构建因素与肿瘤突变特征无关,因此不同分子亚型中存在的基因突变特征具有显著特异性。脑膜瘤分子分型的基因组异常(Genomic disruptions across molecular groups)
研究人员随后又分析了脑膜瘤各分子亚型的基因组特征(Extended Data Fig. 4a),发现MG1型脑膜瘤中更多见22q等位缺失,导致NF2失活。MG2型脑膜瘤包括两个亚型:一类是染色质拷贝数无明显异常,但存在TRAF7、AKT1、KLF4或SMO突变;另一类肿瘤没有基因突变,但存在5、12、13、17和20号染色体异常。MG3型和MG4脑膜瘤存在更明显的染色体异常,包括22q(分别为93%和86%)、1p(77%和89%)、6q(30%和38%)、14(47%和35%)和18号染色体(19%和38%)缺失。MG4型脑膜瘤也表现出1q染色体拷贝数增加和10号染色体丢失,但这在MG3型脑膜瘤中并不常见(1q: 34% vs. 2%, P=2.9×10−4, Fisher’s exact test; ch10: 38% vs. 14%, P=0.025, Fisher’s exact test)。部分包括野生型NF2的MG3型和MG4型脑膜瘤也显示NF2表达缺失,这与NF2基因甲基化改变无关(Extended Data Fig. 4b, c)。与MG1型(中位数3.5%)和MG2型(中位数9.6%)脑膜瘤相比,MG3型(中位数16.9%)和MG4型(中位数19.5%)脑膜瘤的总基因组异常程度(量化为基因组改变的百分比)更高(P=5.2×10−6, Kruskal–Wallis test)。与MG1型和MG2型脑膜瘤相比,MG3和MG4肿瘤中存在更频繁的染色体融合(Extended Data Fig. 4d, Supplementary Table 5)。综上所述,这些数据表明MG3型和MG4型脑膜瘤的基因组不稳定性增加,这两种脑膜瘤患者预后最为不利。
脑膜瘤分子分型基因表达调控网络(Gene-expression networks of molecular groups)
此外,该课题还研究了各分子亚型基因表达调控网络(Fig. 2b, Extended Data Fig. 5a)。MG1型脑膜瘤表现出更丰富的淋巴细胞浸润,其相关基因富集于免疫细胞调控相关通路(Fig. 2b, inset, Extended Data Fig. 5b)。相比之下,MG4型脑膜瘤免疫相关特征较少,肿瘤相关基因多富集于细胞周期调控、细胞增值相关转录因子(如MYC, FOXM1, E2F),以及蛋白复合体(mTORC1, CDKs, 驱动蛋白kinesins)等相关通路中。MG3型脑膜瘤独具代谢途径相关特征。在MG2型脑膜瘤中,虽然根据CNAs和DNA突变特征能够将该类肿瘤细分为2种亚型(Extended Data Fig. 5c, d),然而这些亚型转录组基因多富集于血管和血管生成相关通路(Fig. 2b)。因此,作者将各类分子亚型分别定义为免疫相关型(MG1)、良性NF2野生型(MG2)、高代谢型(MG3)和增值型(MG4)(Extended Data Fig. 5e, Supplementary Table 6)。随后,研究人员试图通过上述脑膜瘤分子亚型相关通路及靶点筛选FDA已获批的治疗药物。研究发现,组蛋白去乙酰化酶抑制剂(HDACi)伏立诺他(vorinostat)能够特异性异质MG4型脑膜瘤中几条关键的增值相关通路(Fig. 2b)。体外试验表明,伏立诺他能够选择性抑制MG4型脑膜瘤细胞的增值活性(Fig. 2c, Extended Data Fig. 6a, b)。然而,用类似的药物5-氮杂胞苷(5-azacytidine)处理相同的细胞系对细胞增值能力没有影响。研究人员通过构建人源MG4型脑膜瘤小鼠原位模型检测伏立诺他的体内抑瘤效果,发现伏立诺他在动物体内也能够有效抑制脑膜瘤生长(Fig. 2d)并延长实验动物生存率(Fig. 2e,Extended Data Fig. 6c, d)。总的来说,这些研究结果表明不同的脑膜瘤分子亚型对伏立诺他治疗的敏感性可能不同,需要进一步研究。
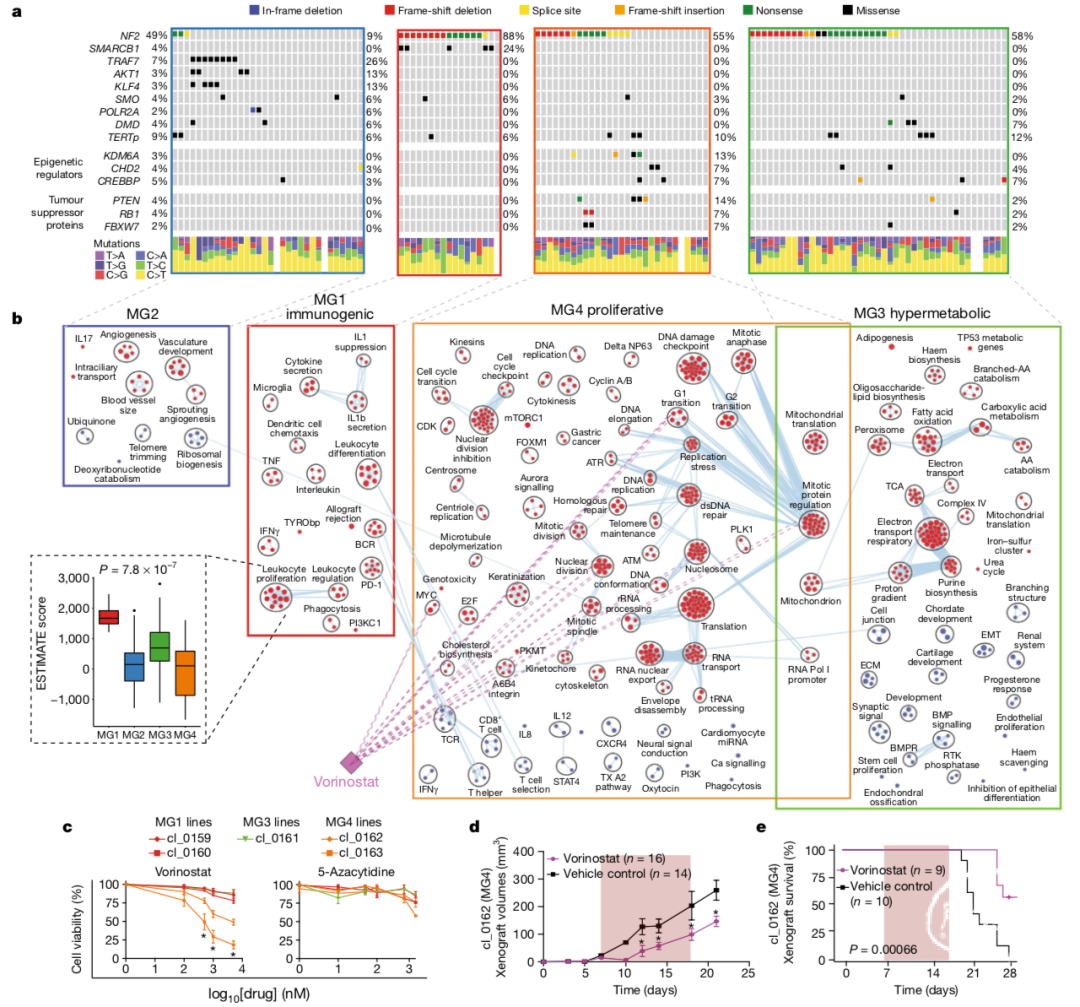
Figure 2. Molecular groups are distinguished by prototypical biology that inform on new therapeutics.
脑膜瘤分子分型蛋白组学特征(Proteogenomic characterization of molecular groups)
研究人员采用单次液相色谱-串联质谱法对96例具备体细胞突变、表观基因组和转录组数据背景的脑膜瘤中共6568个蛋白质组进行了量化。在同类分子亚型中,通过mRNA和蛋白质组数据得到的基因集富集分数具有良好的一致性(Extended Data Fig. 7a–c)。仅使用蛋白组数据构建的生物网络与转录组数据构建的生物网络显示出高度一致性(Fig. 3a, Extended Data Fig. 7d)。具体而言,免疫相关型脑膜瘤(MG1)富含参与免疫调节的蛋白质,高代谢型脑膜瘤(MG3)富含核酸和脂质代谢相关通路蛋白,而增值型脑膜瘤(MG4)则富含调节细胞周期和细胞增殖相关的蛋白质基因族群。
随后,研究人员比较了mRNA和蛋白质丰度与预后的相关性。总体而言,蛋白质和基因突变与预后的一致性性良好(Pearson’s ρ=0.49, 95% confidence interval 0.47-0.50, P<2.2×10-16)。在与预后相关的682个基因中,mRNA或蛋白组数据一致性均较高(odds ratio=213.17, 95% confidence interval 113.74-422.26,Fig. 3b)。值得注意的是,在两种数据类型中,临床预后较差的样本基因均与细胞周期和氧化磷酸化代谢通路相关。
通过蛋白组学分析,研究人员发现每种分子亚型中高表达的特异性蛋白,其中:S100B在MG1型脑膜瘤样本中高表达,SCGN在MG2型脑膜瘤样本中高表达,ACADL在MG3型脑膜瘤样本中高表达,MCM2在MG4型脑膜瘤样本中高表达(Supplementary Table 7)。研究人员通过免疫组化染色对其进行了验证,发现每种蛋白都能很好的区分相应的分子亚型(Fig. 3c)。这些研究结果表明,在进一步独立验证后,这种分子分型在未来临床诊断中具有应用前景。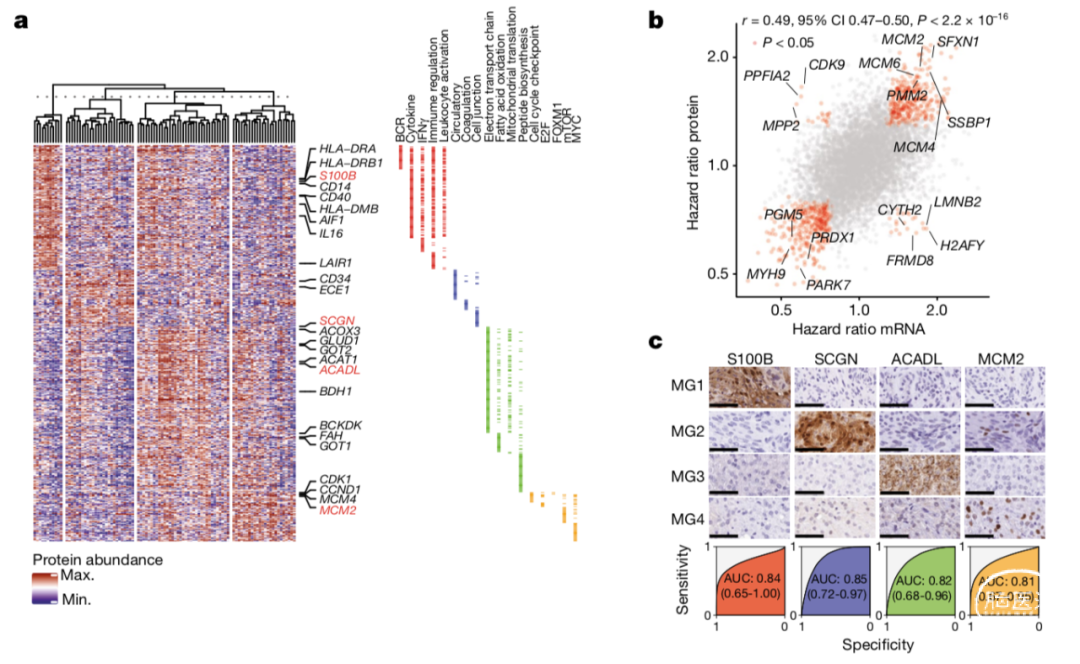
Figure 3. Proteogenomic characterization validates the robustness of molecular groups and identifies markers that can distinguish molecular groups by immunohistochemistry.脑膜瘤分子分型的甲基化特征(Methylation characteristics of molecular groups)
该课题接下来研究了脑膜瘤和正常脑膜组织之间的DNA甲基化特征。研究人员发现了两组能够将正常脑膜组织和脑膜瘤区分开的探针(Extended Data Fig. 8a)。其中一组在正常脑膜组织中均为低甲基化状态,在脑膜瘤不同分子亚型中发生不同程度甲基化;另一组探针中,健康脑膜组织均为高甲基化状态,而在脑膜瘤不同分子亚型中发生不同程度去甲基化(Extended Data Fig. 8b)。这种甲基化特征与已有报道类似[14-16],说明异常的DNA甲基化可能与侵袭性更强的分子亚型有关,尽管脑膜瘤中细胞类型的差异性也可能导致同样的结果(Extended Data Fig. 8c)。研究人员随后根据各组低甲基化增强子区域、已知转录因子结合位点基序列及与基因表达的相关性[17],确定了脑膜瘤各分子亚型中富集的转录因子(Extended Data Fig. 8d),同时发现脑膜瘤DNA增强子区域的甲基化与各分子亚型的转录组特征具有一致性(Extended Data Fig. 8e, f)。脑膜瘤单细胞图谱(Single-cell map of meningiomas)
为了探索脑膜瘤的异质性,研究人员对8例脑膜瘤样本进行了单细胞测序(droplet-based single-nuclear RNA sequencing),这8例样本中包含了所有脑膜瘤分亚型同时涵盖不同WHO病理级别,另外还纳入2例健康脑膜组织样本作为对照。
该研究分析了54393个符合质控标准的细胞单核,并确定了14个不同的集群(Fig. 4a–d, Supplementary Figs. 1, 2)。根据基于基因表达的聚类算法(Extended Data Fig. 9a)、CNAs推理算法(Extended Data Fig. 9b, c)以及典型标记注释(Extended Data Fig. 10a)对细胞进行分类,发现其中大部分为肿瘤细胞(69%),14%为免疫细胞(包括巨噬细胞和T细胞),10%为成纤维细胞,6%为内皮细胞。
不同脑膜瘤样本中非肿瘤细胞能够按细胞类型聚类,而肿瘤细胞却存在显著个体差异,说明罹患脑膜瘤对不同个体间存在异质性(Fig. 4a, Extended Data Fig. 10b, Supplementary Table 8)。如果仅纳入肿瘤细胞进行分析,不同肿瘤样本间的差异远大于同一肿瘤间的差异(F=65,538, P<2.2×10−16, one-way ANOVA),且肿瘤细胞的基因表达更接近亲代细胞的分子特征(Extended Data Fig. 10c)。研究人员还发现,具有细胞周期特征的单细胞多富集于MG3(P=2.2×10−2)和MG4(P=1.49×10−2)型脑膜瘤中,而免疫细胞则在MG1型脑膜瘤中富集(P=1.8×10−2, mixed-effects; Extended Data Fig. 10d, e)。单细胞RNA测序进一步证实了MG1中存在巨噬细胞富集,各分子亚型脑膜瘤样本与健康脑膜瘤组织之间存在差异(Fig. 4e, Extended Data Fig. 10f)。脑膜瘤单细胞异质性(Heterogeneity by single cell)
研究人员先采用两种独立的聚类算法(Seurat和DBSCAN)分别对每个样本中的单细胞基因表达谱进行聚类,试图寻找离散的变异模式。将样本中所有细胞纳入分析时,MG1-MG3型脑膜瘤聚类为不同的族群,这是因为该类脑膜瘤中存在大量基质细胞和免疫细胞所导致的;而主要由肿瘤细胞构成的MG4型脑膜瘤则未显示出不同的聚类族群(Fig. 4f)。为了更深入的研究每个样本中肿瘤细胞的异质性,研究人员使用相同的算法选择每个脑膜瘤样本的肿瘤细胞进行聚类,发现大部分样本都仅有一个占优势的肿瘤细胞族群。此外,单细胞基因拷贝数与组织整体测序数据一致,没有显示细胞之间的实质性变化(Extended Data Fig. 9b, c)。这些研究结果表明脑膜瘤肿瘤细胞亚克隆扩增的相对罕见性。随后,研究人员采用非负矩阵分解(NMF)来识别肿瘤细胞中内源性表达模式及样本间的共性,在不同样本中共识别了24个独立模式,并根据模块间共享基因的相似程度聚集成四个“元程序”(meta-programs)(Fig. 4g, Extended Data Fig. 11a)。这类元程序与四种分析亚型的生物学特征非常类似,他们在不同类型脑膜瘤细胞中存在激活(Extended Data Fig. 11b)。其中,最主要的程序模式与细胞周期相关(FDR=3.13×10−32, hypergeometric test)。其他模式包括代谢(FDR=7.66×10−3, hypergeometric test),TNF炎症通路(FDR=5.99×10−13, hypergeometric test)以及细胞间质相关模式(FDR=2.12×10−15, hypergeometric test)均显示出持续的可变性(Extended Data Fig. 11c, d)。总体来讲,脑膜瘤的这些内源性表达模式提示了其微妙的变异方式;然而,这些肿瘤细胞固有的表达模式与上诉分子分型的生物学特征相似,反应了这些生物学过程在脑膜瘤病理机制中的重要性。实际上,作者通过分析各组样本单细胞RNA测序数据,发现这些表达模式也与分子亚型的分子特征高度一致(Extended Data Fig. 10g)。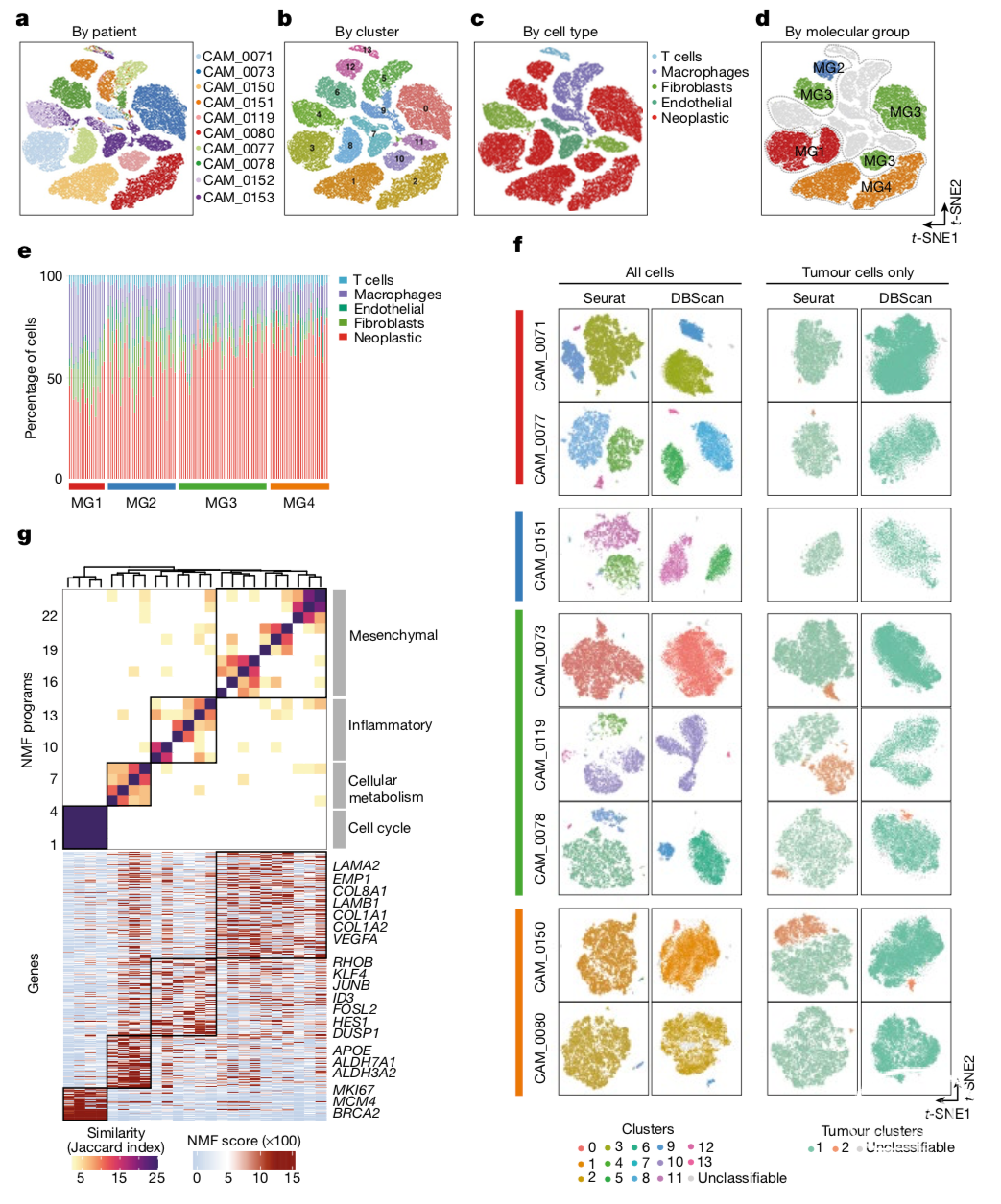
Figure 4. Single-cell RNA sequencing of human meningiomas reveals substantial inter-patient heterogeneity and subtle within-patient variability.该项研究整合了脑膜瘤基因组、转录组和蛋白组信息,将脑膜瘤分为4种独具生物学特征的分子分型,研究人员认为这种分子分型方式能够在临床上取代现有的分类方法,为将来脑膜瘤分级分类方案迭代提供参考。
文中所有原始数据,材料方法及补充数据来源于https://doi.org/10.1038/s41586-021-03850-3
1. Ostrom, Q. T. et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2012–2016. Neuro. Oncol. 21, v1–v100 (2019).2. Goldbrunner, R. et al. EANO guidelines for the diagnosis and treatment of meningiomas. Lancet Oncol. 17, e383–e391 (2016).3. Sahm, F. et al. DNA methylation-based classification and grading system for meningioma: a multicentre, retrospective analysis. Lancet Oncol. 18, 682–694 (2017).4. Clark, V. E. et al. Genomic analysis of non-NF2 meningiomas reveals mutations in TRAF7, KLF4, AKT1, and SMO. Science 339, 1077–1080 (2013).5. Brastianos, P. K. et al. Genomic sequencing of meningiomas identifies oncogenic SMO and AKT1 mutations. Nat. Genet. 45, 285–289 (2013).6. Clark, V. E. et al. Recurrent somatic mutations in POLR2A define a distinct subset of meningiomas. Nat. Genet. 48, 1253–1259 (2016).7. Harmancl, A. S. et al. Integrated genomic analyses of de novo pathways underlying atypical meningiomas. Nat. Commun. 8, 14433 (2017).8. Nassiri, F. et al. DNA methylation profiling to predict recurrence risk in meningioma: development and validation of a nomogram to optimize clinical management. Neuro. Oncol. 21, 901–910 (2019).9. Hoadley, K. A. et al. Cell-of-origin patterns dominate the molecular classification of 10,000 tumors from 33 types of cancer. Cell 173, 291–304.e6 (2018).10. Koboldt, D. C. et al. Comprehensive molecular portraits of human breast tumours. Nature 490, 61–70 (2012).11. Cancer Genome Atlas Research Network. Comprehensive, integrative genomic analysis of diffuse lower-grade gliomas. N. Engl. J. Med. 372, 2481–2498 (2015).12. Hoadley, K. A. et al. Multiplatform analysis of 12 cancer types reveals molecular classification within and across tissues of origin. Cell 158, 929–944 (2014).13. Reshef, D. N. et al. Detecting novel associations in large data sets. Science 334, 1518–1524 (2011).14. Zhou, W. et al. DNA methylation loss in late-replicating domains is linked to mitotic cell division. Nat. Ge

复旦大学附属华山医院,医学博士,复旦大学附属华山医院神经外科住院医师,2018赴美国斯坦福大学联合培养。导师:宫晔教授。目前研究方向为难治性脑膜瘤靶向治疗及临床应用。
“阔然生物医药科技(上海)有限公司(Shanghai KR Pharmtech, Inc. , Ltd.)”简称“阔然基因”成立于2015年,总部位于上海,致力于提供多应用场景的一站式分子诊断解决方案,包括癌症早期筛查、诊断与监测以及药物研发服务,拥有6款IVD产品注册申报储备,服务中国500余家医院和科研机构,建立了庞大的基因组数据库。阔然拥有上海和徐州双研发中心,两家医学检验实验室(CAP、CLIA标准建设)和精准医学技术研究院。凭借“产品+服务”模式开展肿瘤分子诊断、免疫微环境和病原微生物检测等业务。为临床医生对患者的诊疗提供一体化解决方案,实现“精准医疗践行者”的理念,推动我国医疗事业发展。2019年荣获“上海市高新技术企业”认定。
阔然精准诊疗脑肿瘤产品CaptioX-M是一款以NGS技术为基础的检测产品。CaptioX-M用于脑膜瘤的分子诊断,涵盖了脑膜瘤复发相关的67个基因(NF2、TERTp、CDKN2A/B、ARID1A和BIP1等)、预后相关的染色体(22q、1p、5、10等)拷贝数变异和潜在靶向治疗相关基因的信息,脑膜瘤CaptioX-M可用于脑膜瘤患者分子分型、预后评估和辅助医生制定治疗策略。
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。










