荷兰鹿特丹大学医学中心放射医学与核医学部的Marion Smits通过文献检索和荟萃分析重点介绍MRI成像的进展,文章发表在2021年8月的《Curr Opin Neurol》杂志。
——摘自文章章节
【Ref: Smits M. Curr Opin Neurol. 2021 Aug 1;34(4):497-504. doi: 10.1097/WCO.0000000000000950.】
磁共振成像(MRI)是脑肿瘤最常用的诊断方式:用于脑肿瘤的初步诊断、制定治疗计划(手术或放射治疗)和随访检查。荷兰鹿特丹大学医学中心放射医学与核医学部的Marion Smits通过文献检索和荟萃分析重点介绍MRI成像的进展,文章发表在2021年8月的《Curr Opin Neurol》杂志。本文将内容概括几点,阐述如下:
2016年,WHO的中枢神经系统肿瘤分类首次在传统组织病理学诊断中引入分子诊断标准。放射基因组学迅速发展,将定量或半定量放射学成像特征与临床表现特征结合起来,包括分子/遗传特征成像。神经胶质瘤的放射基因组学是影像学特征与肿瘤基因学相结合的新诊断方法。每一种肿瘤基因型都有一定的放射基因组学特征性表现,有助于决定治疗手段和预测预后。所以,采用影像学方法可在早期,即在组织学诊断之前,对神经胶质瘤的基因型进行精确的鉴定。如IDHmut 1p/19q共缺失肿瘤(即少突胶质细胞瘤)的影像学特征,包括钙化、位于额叶、异质性、皮质受累和边缘模糊等在常规影像学成像的视觉评估的准确率可达到50%-79%。Patel等2017年采用MRI-T2-FLAIR信号不匹配的错配征(T2-FLAIR mismatch sign)识别IDHmut 1p/19q无缺失的胶质瘤(图1)。通过五个独立队列的四项研究的荟萃分析发现,该T2-FLAIR错配征具有高度特异性。其重要意义是,即使未经组织学诊断,依据T2-FLAIR错配征的表现可以用来制定患者治疗决策和预测患者生存时间。如对于IDHmut胶质母细胞瘤患者,切除所有强化的肿瘤部位,一般认为肿瘤全切除。然而,放射基因组学发现,与IDHwt胶质母细胞瘤相比,IDHmut胶质母细胞瘤内的非强化部分仍残留大量的肿瘤组织,需要进一步的治疗(图2)。
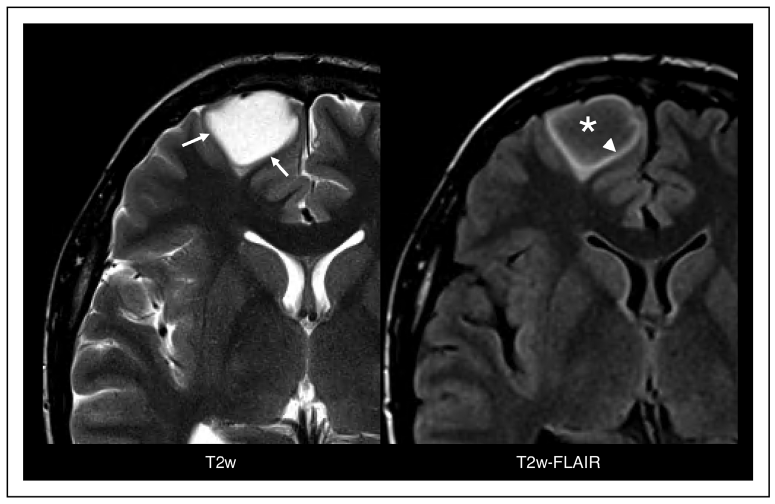
图1. 右额叶IDHmut 1p/19q无缺失胶质瘤的MRI-T2w-FLAIR错配征。在MRI-T2加权(T2w)成像为均匀的高信号(左图,箭头),MRI-T2w-FLAIR成像呈低信号伴环形高信号边缘(右图,箭头)。
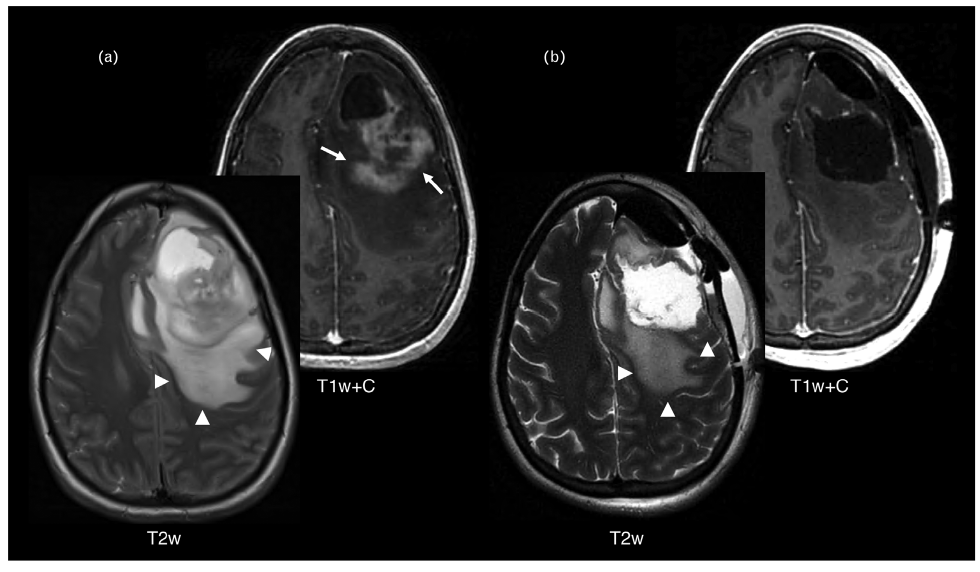
图2. a.IDHmut胶质母细胞瘤患者术前和术后T1加权增强和T2加权轴位图像。肿瘤强化部分(箭头)已完全切除;b.存在较大的非增强T2加权高信号(箭头)区域,该区应视为残余肿瘤。磁共振功能成像(fMRI)是脑肿瘤手术和术中皮质电监测的重要辅助手段。传统使用功能磁共振成像技术的缺点是每次扫描5分钟只能评估一个功能。静息态功能磁共振成像(rs-fMRI)克服这些问题,提供一个更全面的大脑功能视图网络。最近有研究显示,应用特定的信息采集和后处理技术,rs-fMRI在绘制感觉运动皮质和语言系统方面可能与任务型fMRI一样灵敏。rs-fMRI与任务型fMRI并非相互排斥,可以利用它们各自的优点,使用这两种技术。手术过程中,研究者利用mDoppler或高帧频多普勒超声(high frame rate doppler)技术成功地观察到功能活跃的皮质和肿瘤的血管形成;其空间分辨率为50毫米,不涉及电刺激,可降低术中癫痫发作的风险,比传统的皮质电刺激图具有更深的渗透力。因此,在提高脑实质的术中定位、指导肿瘤切除以及提供高时空分辨率的血管信息等方面有很大的潜力。Kickingereder等根据神经肿瘤学反应评估(RANO)标准,将人工智能的全自动反应评估与传统的手动反应评估进行比较,创立新的肿瘤反应评估方法。而且已有一个独立的研究数据集中验证此研究结果。在试验和临床实践中,为肿瘤体积精确的监测迈出重要一步。另一个重要的进展是图像采集和评估标准化研究。小儿神经肿瘤学工作组发表一系列包括低级别胶质瘤、弥漫性中线胶质瘤和弥漫性固有桥脑胶质瘤(DIPG)等肿瘤反应评估新指南;均规定图像采集的最低标准和相应标准。新指南明确地将儿童与成人胶质瘤的RANO标准区分开来。重点提出非强化病变的存在意义,认为许多儿童胶质瘤,无论是高级别还是低级别,没有明显强化对比度;即使有,在T2w或T2w-FLAIR图像上可以可靠地测量。第二个重点是结合扩散加权成像(DWI)在高级别胶质瘤反应标准的应用,在某种程度上是一个革命性的进展,因为这已不是第一次单纯依靠解剖成像评估脑肿瘤患者的治疗反应。指南还对重复使用钆基造影剂(GBCA)、新型治疗药物的疗效、区分血管源性水肿与浸润性肿瘤和囊性病变的测量提出建议。同时,肿瘤监测的另一发现与重复服用GBCA和体内钆沉积有关。最近两项回顾性研究认为,应用T2加权成像对肿瘤进行随访与T1加权成像检测作对照,可以避免使用GBCA造影剂。通过人工智能在多参数非对比MRI扫描中,人工构建“虚拟对比增强”图像减少或甚至不用GBCA造影剂。对47例增强型肿瘤、39例非增强型肿瘤和30例正常对照扫描研究,发现人工创建的虚拟增强扫描检测增强的敏感性和特异性分别为92%和91%。肿瘤假性进展与真性进展在传统的影像学上难以区分,也是脑肿瘤监测中的重要挑战。灌注MRI是常用的先进成像技术,其基本病理生理学原理是肿瘤新生血管与高灌注相关,可以鉴别因治疗引起的炎症和其它反应性改变,区分胶质瘤的假性进展和真性进展。
最后,作者认为传统的神经影像学对于神经肿瘤的诊断和分级、区别假性或真性进展、确定肿瘤边界和测量肿瘤体积等基本问题上存在不足。先进的图像采集和分析技术有望在不久的将来极大地提高神经影像学诊断和处理神经胶质瘤的效应,使患者得益。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。











