作者:
孔祥杰,孙泽宇,凌晨晗,徐良,钱聪,虞军,许璟
作者单位:
浙江大学医学院附属第二医院神经外科
摘要
累及小脑后下动脉(PICA)的椎体夹层动脉瘤(VDAs)需要一个最佳的方法来闭塞夹层并防止症状性梗死的发生。本研究旨在展示我们采用闭塞载瘤动脉(PAO)和支架辅助弹簧圈栓塞(SAC)治疗这类动脉瘤的经验,并提供一个良好的策略来处理破裂的累及PICA的VDAs。我们回顾了2013年3月至2018年12月在我们的数据库中患有颅内椎动脉夹层动脉瘤并经血管内治疗的蛛网膜下腔出血患者。最终共16例患者纳入该研究,其中10例动脉瘤采用闭塞载瘤动脉治疗,3例为单纯近端闭塞,7例在保留的PICA的同时对瘤体进行靶向栓塞。5例动脉瘤采用椎动脉内支架辅助栓塞,1例采用PICA内支架辅助载瘤动脉及动脉瘤闭塞。2例(12.5%)患者在急性期死亡。在术后30天随访中,在13(81.5%)病例中观察到良好的临床结果(改良Rankin Scale 0至3)。一例患者发生了无症状的PICA供血区域的梗死。12例患者术后进行DSA随访,9例获得了良好的栓塞结果,无需再次治疗。若患者对侧椎动脉发育良好,PAO可作为累及PICA的破裂VDAs一线治疗方式。保留的PICA的靶向栓塞或近端闭塞后在瘤体内疏松填塞或许是一种可以防止严重PICA梗死的有效方式。
[REF: Kong X, Sun Z, Ling C, et al. Endovascular treatment for ruptured vertebral dissecting aneurysms involving PICA: Reconstruction or deconstruction? Experience from 16 patients. Interv Neuroradiol. 2021;27(2):163-171. doi:10.1177/1591019920970030] PMID: 33115297
椎动脉夹层动脉瘤是一种少见的病变,约占动脉瘤性蛛网膜下腔出血(aSAH)的9.7%。1,2与囊状动脉瘤相比,VDAs具有更高的再破裂率,这需要我们动脉瘤破裂后早期进行治疗。3-5治疗方式包括开颅手术与血管内治疗,但开颅手术容易导致低位颅神经麻痹与脑干损伤,目前血管内治疗为VDAs的首选治疗方式。6-8过去PAO是治疗VDAs的一线治疗方案,但材料的进步为VDAs的重建性治疗打开了一扇新的大门。2
累及PICA的VDAs的治疗是广受关注的问题,原因有以下两点:首先,当PICA受累时,闭塞治疗后脑干梗塞的风险将从5%提升至38%,且与不良预后相关。9其次,PICA受累时动脉瘤术后复发、再破裂的危险因素,常需要进一步处理。10虽然PICA被认为是一个重要结构,使用支架或血流导向装置可以有效保留PICA,但PICA是否可以牺牲以及牺牲后的影响仍有争议。Peluso等的研究显示PICA牺牲后的并发症通常是温和且可以恢复的。11但PICA牺牲后导致小脑大片梗死需要去骨瓣减压的情况也有报道,虽然这很少见。12在血管内治疗对于VDAs的疗效方面,闭塞或重建都是比较有效的方式,但对于累及PICA的VDAs的治疗仍缺乏一个最佳的治疗方案。本研究的目的在于展示本中心关于治疗累及PICA的破裂VDAs的经验,以期提供一个可令人满意的治疗策略。
回顾性分析了2013年3月至2018年12月在浙江大学医学院附属第二医院连续16例累及PICA的破裂椎动脉夹层动脉瘤患者的影像学表现和临床结果。所有患者均经计算机断层扫描(CT)确诊蛛网膜下腔出血(SAH),同时数字减影血管造影(DSA)提示椎动脉V4的夹层动脉瘤被认为是蛛网膜下腔出血的潜在原因,夹层动脉瘤在血管造影的形态学评估中有以下特征:囊性扩张、串珠状、梭形动脉瘤扩张或血管不规则。采用Hunt&Hess分级评估SAH的严重程度和入院时患者的状态。
由神经介入医生对患者和动脉瘤形态进行评估。所有手术均在全身麻醉下进行,股动脉穿刺置鞘后静脉注入肝素,目的是在手术过程中达到2-2.5倍于基线的活化凝血时间。对于病变侧椎动脉为优势血供的患者,首选支架辅助弹簧圈栓塞(SAC)。动脉瘤破裂计划支架辅助栓塞时,术前经胃管给予氯吡格雷300-600 mg和阿司匹林325mg的负荷剂量。手术后,氯吡格雷以75mg/天的剂量持续应用3个月。阿司匹林以100mg/天的剂量服用1年。因患者病情的特殊性,我们采用目测的方式评估双侧椎动脉的流量大小和流速。当对侧VA发育良好时,PAO是将夹层动脉瘤的首选治疗方法。在这种情况下,选择在最可疑的动脉瘤破裂部位进行靶向栓塞,避开PICA以防止症状性梗死。当靶向栓塞难以实现时,可以适当地在动脉瘤内进行疏松填塞并闭塞近端载瘤动脉来避免急性缺血性卒中,根据我们的经验,适度疏松填塞应符合以下标准。首先,与对侧小脑相比,静脉引流应对称或延迟<2s。其次,所涉PICA应在AICA显影后0.5s以内出现。在一个严格筛选的病例中使用了从VA到PICA放置支架并闭塞动脉瘤与载瘤动脉。
术后30d采用改良Rankin量表(mRS)评分评价临床疗效。mRS评分为0~3定义为预后良好。使用CT平扫或磁共振成像(MRI)评估术后缺血。手术相关缺血定义为手术后新的缺血症状或新的影像学表现。经至少两名具有5年以上神经介入工作经验的医生评估后确定梗死与手术有关。术后3-6个月和1年进行DSA随访。良好的影像学结果定义为完全闭塞、多次随访中观察到瘤体有稳定的残留,动脉瘤残腔显影的大小随时间逐渐减少。
采用独立样本t检验、卡方检验和Mann-Whitney U检验比较PAO和SAC患者的基本信息、动脉瘤特征、手术相关并发症和随访结果。所有分析均采用SPSS V.25进行。p<0.05为有统计学差异。
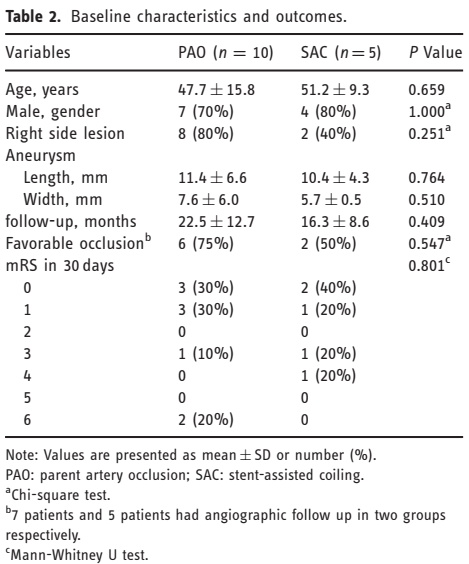
120例VDAs患者于2013年3月至2018年12月在我院接受血管内治疗。39例(32.5%)患者中动脉瘤累及PICA。最后,共有16例VDAs累及PICA的患者被诊断为SAH并纳入(表1)。患者包括11名男性和5名女性,平均年龄48.6岁(24-68岁)。11例破裂VDAs位于右侧VA,其中有2例患者有对侧VDAs。5例VDAs破裂位于左侧,1例有对侧VDAs。入院时HUNT-HESS评分分别为Ⅰ2例(11.8%),Ⅱ 6例(35.3%),Ⅲ 1例(11.8%),Ⅳ 7例(41.2%), 16个病人被分为PAO组和SAC组。1例接受VA-PICA支架植入的患者未纳入上述两组。分析PAO组和SAC组的基线特征(表2)。年龄、性别、病变部位、动脉瘤长度和宽度均无显著性差异。
回顾动脉瘤的血管造影特征、颅内循环血流动力学特征及手术相关并发症(表1)。梭形扩张11例,囊性病变4例,动脉瘤导致VA闭塞并有残留囊腔1例。分析患者血流动力学特征及动脉瘤与PICA的关系。对10例对侧椎动脉发育不全的患者,采用几种不同方法进行载瘤动脉闭塞。4例优势侧VDAs患者和1例有右侧颈内动脉闭塞的患者接受SAC治疗。1例患者术前发现远端VA闭塞,随后采用VA-PICA支架植入辅助闭塞动脉瘤。
所有VDAs均成功应用PAO或SAC治疗,无术中破裂。PAO组有6例(60%)患者术后立即完全闭塞载瘤动脉。4例(40%)患者在手术中出现不完全闭塞。术中PICA梗死1例(10%)。4例(80%)接受椎动脉支架植入术后即刻动脉瘤完全闭塞。经VA-PICA支架植入治疗的患者在保留PICA的情况下完成了动脉瘤的完全闭塞。
表1. 16例患者的详细信息
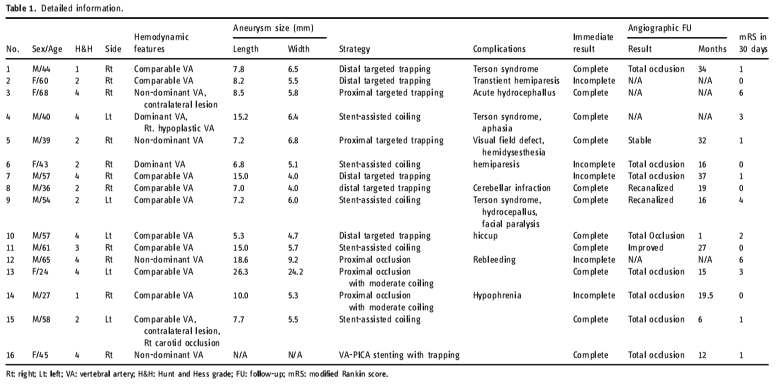
3例出现手术相关缺血并发症。1例(case 5)采用近端靶向栓塞术治疗,出现短暂的同侧感觉障碍,10个月后恢复。1例患者(case 6)行SAC治疗,出现暂时性偏瘫,出院前恢复。以上两例患者均未发现延髓的影像学梗死。1例患者(case 8,图1)术后6天CT发现无症状的PICA区梗死,尽管术后即刻造影显示PICA保留。1例(case 12,图2)采用单纯近端闭塞治疗的患者在术后20天动脉瘤再次破裂,最终死亡。另一名入院时H-H评分较高的患者昏迷后无法恢复,因肺部感染死亡。14例存活患者中,30天mRS评分0~2分有9例,3分3例,4分2例。
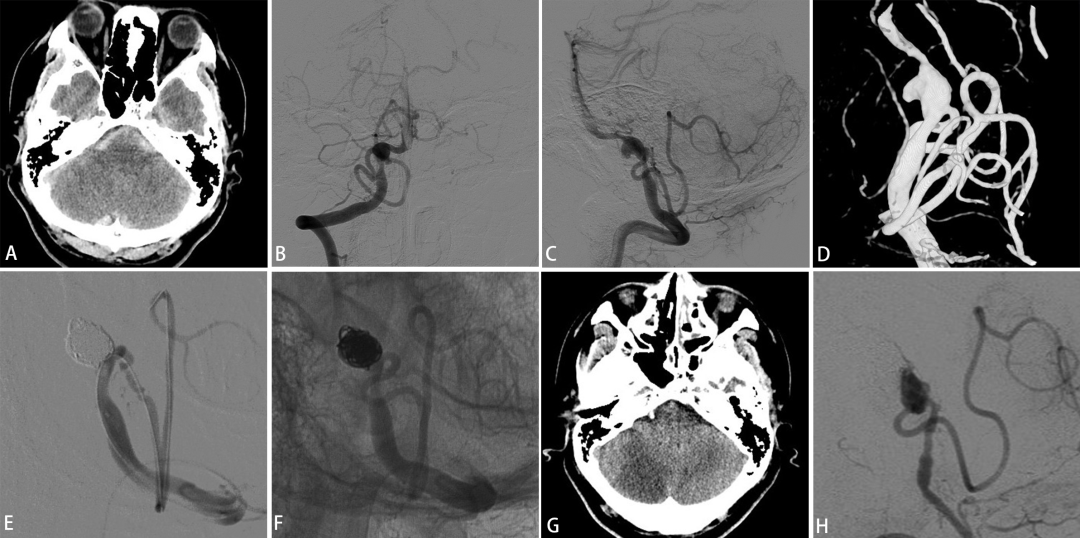
图1. 一例36岁男性患者诊断为蛛网膜下腔出血(A)和右侧椎动脉动脉瘤(BCD),术中使用微导丝超选至PICA保护开口(E),使用5枚弹簧圈闭塞椎动脉与动脉瘤(F),术后CT提示右侧小脑梗塞,患者无相应症状(G)。4月后随访夹层复发增大(H)。
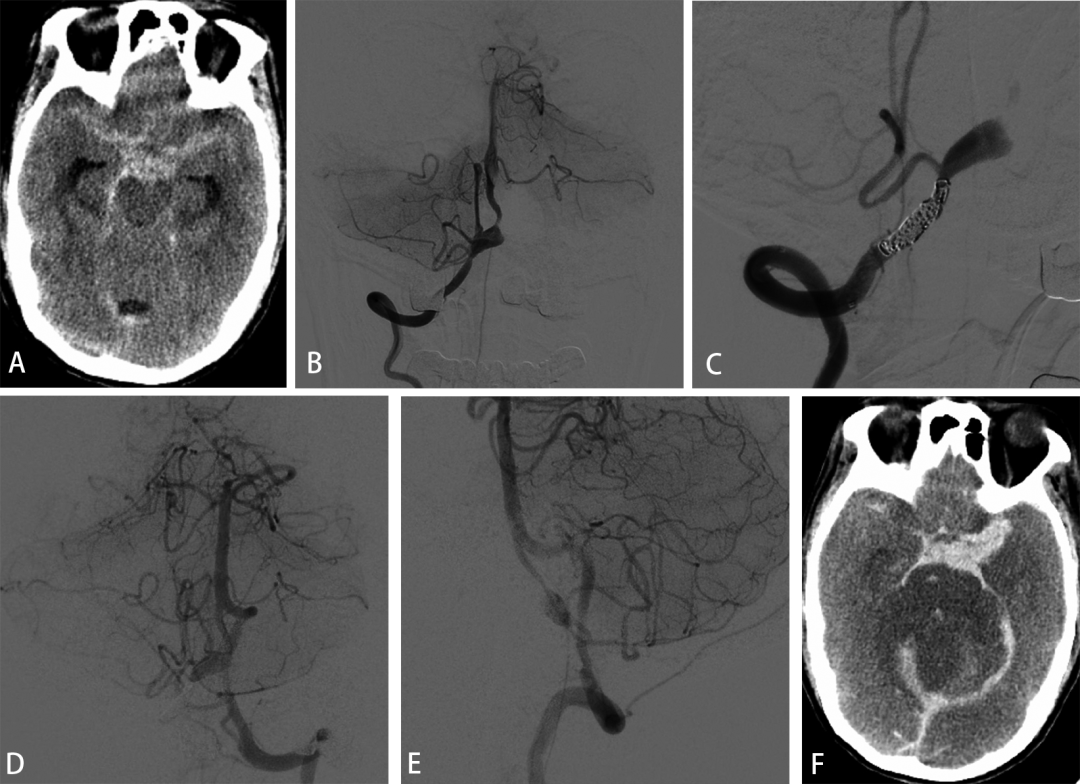
图2. 一例65岁男性患者表现为蛛血,H&H IV级(A),DSA提示右侧VDAs累及PICA(B),手术对夹层近端的载瘤动脉进行了闭塞(C),对侧椎动脉造影见夹层内血流逆灌(D,E)。术后20天动脉再次破裂最终患者去世(F)。
14例存活患者中,12例(85.7%)接受了血管造影随访。PAO组中有7例患者出院后进行DSA随访(平均随访22.5个月,范围1-37个月)。PAO组的良好闭塞率为75%(6/7)。1例在4个月的随访中观察到残余夹层扩大,在球囊试验(BTO)评估阴性后,VA被进一步闭塞。1例接受瘤体内疏松填塞与近端载瘤动脉闭塞的患者(case 13,图3)在6个月随访时发现PICA的延迟闭塞,未发现任何功能障碍。SAC组4例患者出院后进行DSA随访,平均随访16.3个月,范围6-27个月。第一次随访总闭塞率为50%(2/4)。1例(case 9)有动脉瘤增大但拒绝进一步治疗,另1例(case 11,图4)因动脉瘤再通而行二次支架置入术。最后随访显示这两名患者的动脉瘤均几乎完全闭塞。患者(case 16,图5)接受VA-PICA支架植入术后1年随访显示完全闭塞。13例患者获得了临床随访资料(平均随访23.9个月,范围1-79个月)。13例患者临床预后良好(mRS 0~3),2例患者因脑积水和Terson综合征导致严重残疾。PAO组与SAC组在临床转归方面差异无统计学意义(表2)。
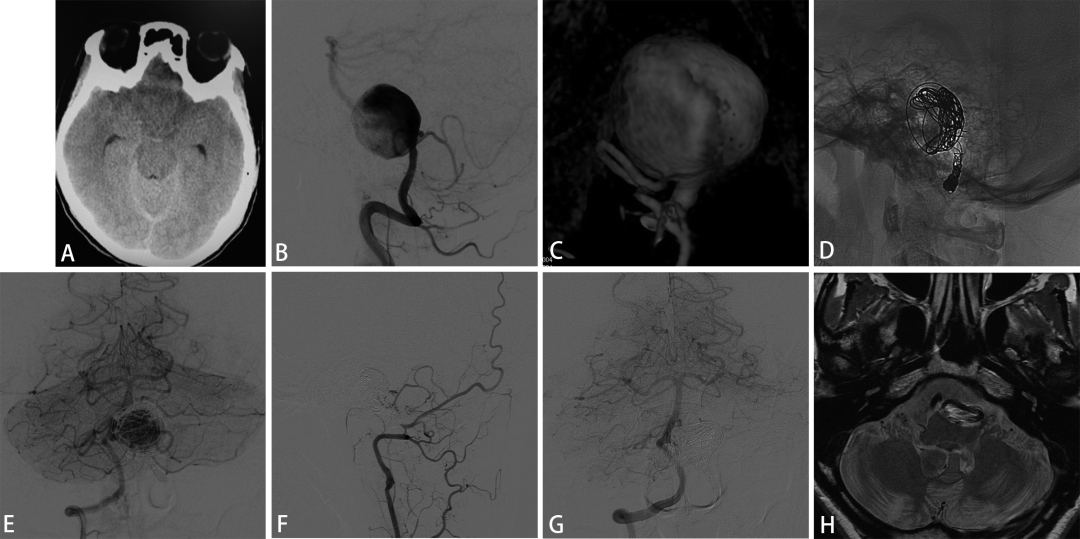
图3. 一例24岁女性因突发意识不清入院,CT提示蛛血(A)。进一步造影见左侧椎动脉巨大动脉瘤累及PICA(B,C),采用近端载瘤动脉闭塞加瘤体内疏松填塞(D),对侧椎动脉造影可见逆灌(E),术后6月随访动脉瘤不显影(F,G),MRI显示动脉瘤瘤体缩小且无脑梗塞(H)。
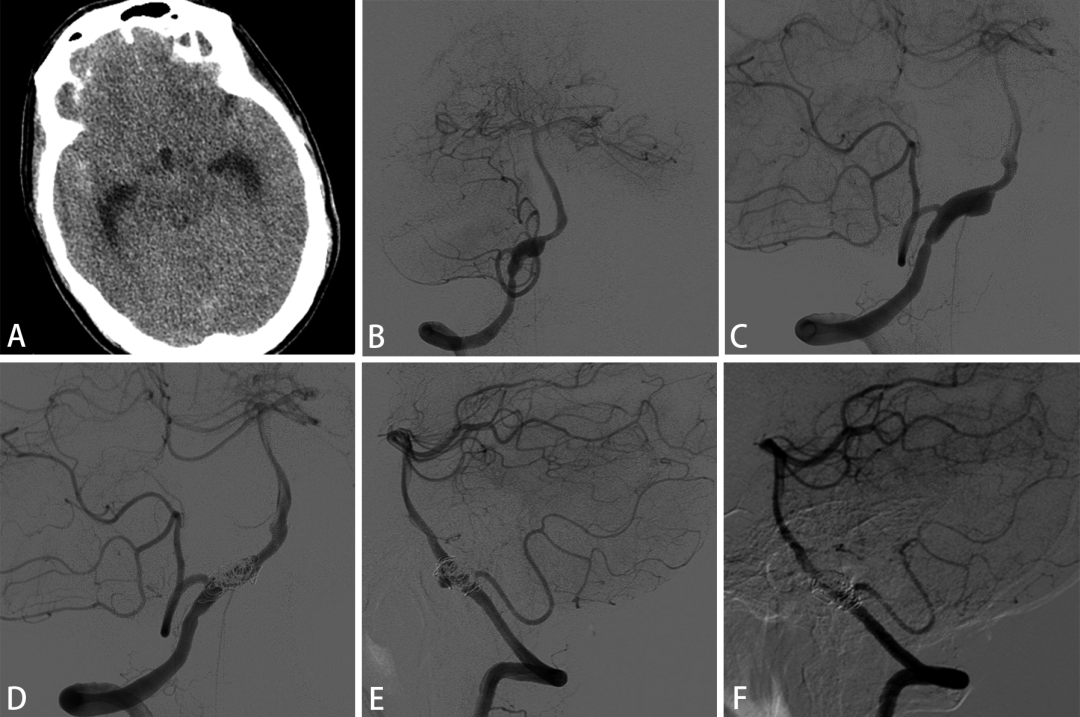
图4. 一例63岁男性表现为蛛血与右侧VDA累及PICA(A,B,C),使用2枚Enterprise支架辅助弹簧圈栓塞动脉瘤(D),术后8月提示瘤体复发(E),二次手术植入两枚LVIS支架,12月后随访动脉瘤闭塞(F)。
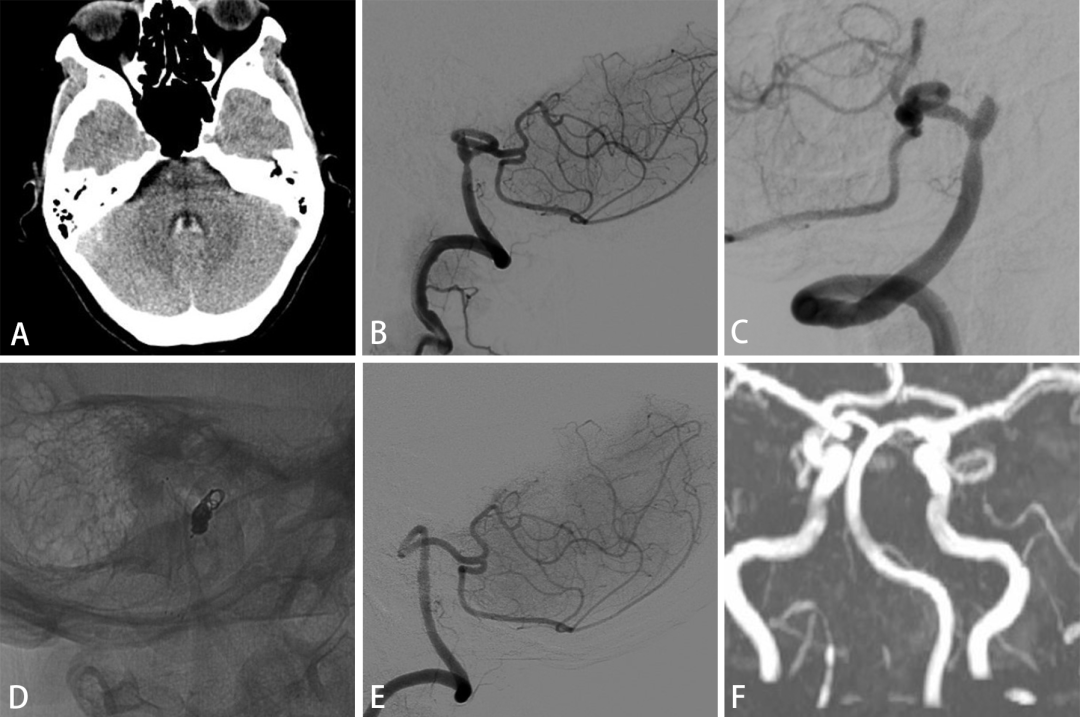
图5. 一例45岁女性表现为蛛血与脑室出血(A),DSA见右侧VDA同时远端VA自发闭塞,PICA自瘤体近端发出(B,C),向PICA植入LVIS支架保护PICA血流后闭塞动脉瘤(D)。术后3月的DSA随访与术后6月的MRA随访显示PICA被保留且动脉瘤闭塞(E,F)。
表2. 两组特征与预后的比较
在PICA未受累及的情况下治疗破裂的VDAs时,根据每个患者的血流动力学基础,闭塞治疗和重建治疗能获得相似的临床结果。如Jian Guan等人在他们的研究中所显示的那样,在长期闭塞、临床结局和复发率方面,闭塞和支架辅助栓塞之间没有显著差异。13然而,但由于需要平衡再出血和缺血之间的风险,治疗累及PICA的VDAs是一个相当大的挑战。
在动脉瘤联合载瘤动脉闭塞是治疗破裂VDAs最常用的方法。据报道,这种方法有最低的再出血率,但当PICA被闭塞时,缺血事件的发生率为38%。9因此,PICA受累似乎是闭塞治疗的禁忌,有学者建议采用重建治疗保留PICA。14,15然而,Kitanaka等人认为由于丰富的侧支存在,PICA被牺牲的结果可能是轻微的或无症状的,16Peluso等也得出类似的结论。11在我们的中心,常采用靶向栓塞避开PICA开口的方法来保存PICA。这种靶向栓塞的方法已被广泛报道,但由于不完全栓塞可能导致复发,很少被建议。17,18当血管造影中发现有明显的破裂点或PICA位于夹层边缘时,我们常会采用这种技术。回顾我们中心的数据,我们发现这种方法在避免再破裂和术后并发症方面是有效的。治疗后动脉瘤通常稳定,但在3个月的DSA随访中,5例患者中有1例出现了复发。这一结果强调了短期监测的重要性。
闭塞病变段近端的载瘤动脉是一种可以利用对侧VA向PICA提供逆向血流灌注治疗方法。导致医源性梗塞的风险低于瘤体栓塞,但有19%再出血率。9Yasui T在他们的研究中指出,术后逆行性血流通过动脉瘤进入同侧PICA使得动脉瘤内压力不太可能迅速上升,因此术后再出血发生的时间较长(平均15.2天)在我们的研究中,1例近端闭塞患者术后20天再次出血,这与Yasui T的报道相似。19与再出血引起的灾难性后果相比,梗塞的影响似乎被夸大了。最近的一项荟萃分析显示,与动脉瘤联合载瘤动脉闭塞相比,近端闭塞与不良预后和死亡相关(p=0.0403),这表明防止再破裂的缺陷可能是这种治疗方式的主要问题。20这可能是由于PICA通畅会加速血流,延长夹层内血栓形成的时间,从而增加再出血的发生率。10,15对于不能避免PICA被闭塞的病例,我们会在瘤体内疏松填塞弹簧圈,然后在夹层近端闭塞载瘤动脉。我们认为瘤体内的弹簧圈会扰乱血流,因此这种改良的近端闭塞能够促进夹层内血栓形成,并在急性期保持PICA通畅,以避免严重的缺血事件。两名患者成功地采用了这种方法,取得的结果非常好。
当病变侧VA为优势供血侧或对侧VA发育不良时,常采用SAC和血流导向装置(FDD)进行重建治疗。SAC和FDD可以保护载瘤动脉血流,但患者必须严格执行抗血小板治疗,防止支架内血栓形成。这可能会带来再出血的风险,并增加出血性并发症的严重程度。在治疗PICA受累的破裂VDAs时,术者可能会人为降低动脉瘤栓塞的致密程度以避免PICA闭塞,这就增加了随后再出血的风险。21此外,使用FDD或多个支架可以获得更高的金属覆盖率,从而降低VDAs的复发。17,22-24在本中心,重建治疗以多支架辅助栓塞最为常见,无围术期动脉瘤再出血及出血并发症发生,术后动脉瘤完全闭塞率为50%。曾经破裂的VDA出现复发似乎是二次手术的指征。然而,1例患者(case 9)经DSA检查发现动脉瘤扩大,未作进一步治疗,在后续的随访中动脉瘤发生了自发闭塞。
有报道在急性期或亚急性期使用VA-PICA支架辅助动脉瘤闭塞治疗VDAs。25,26然而,由于这种方式需要同时进行载瘤动脉闭塞和支架植入,可能同时增加了缺血性和出血性并发症的风险,我们认为在干预前必须进行严格的评估。在我们的研究中,这种手术仅在一个病例中进行,该患者术前远端的VA自发闭塞,且PICA灌注近一半的左侧小脑,闭塞可能导致大面积梗死导致不良预后。
在处理累及PICA的破裂VDAs时,最重要的是明确患者后循环的特征和PICA开口与动脉瘤的位置关系。对于对侧VA发育良好的患者,PAO可作为累及PICA的破裂VDAs的一线治疗。如果可能,应该通过靶向栓塞避开PICA开口。当PICA的牺牲不可避免时,近端闭塞后在瘤体内疏松填塞可为代偿血流的形成争取时间,以防止严重的急性缺血性并发症,并降低再出血率,但其有效性有待进一步研究证实。
![]()
通讯作者简介
许璟
浙江大学医学院附属第二医院
主任医师
中国医师协会神经介入专业委员会常委
卫健委脑卒中防治专家委员会出血性卒中介入专业委员会常委
吴阶平医学基金会脑卒中专家委员会常委
中国医师协会神经外科分会神经介入学组委员
浙江省医师协会神经介入专委会主任委员
浙江省卒中学会常务理事
浙江省神经介入沙龙召集人
参考文献:










