病 例 1
2019年6月接诊一例来自北京丰台9岁女性患儿(126cm,35.0kg)。主诉:身材矮小伴多饮多尿4年。门诊查体:神清语利,自主体位,视力视野正常,身高较同龄人矮小,余神经系统查体(-)。血清学检查:生长激素<0.05ng/ml(正常6-12岁儿童10-50ng/ml),余各类激素基本正常。头颅CT平扫提示:鞍内及鞍上圆形高密度影,无钙化影,大小约16X15X25cm,CTA未见异常血管影(图1);头颅MRI显示:鞍内鞍上异常信号囊性团块,边缘清晰,未见明显强化,垂体受压变薄,蝶鞍略扩大,拉克氏囊肿(Rathke囊肿)可能性大(图2)。
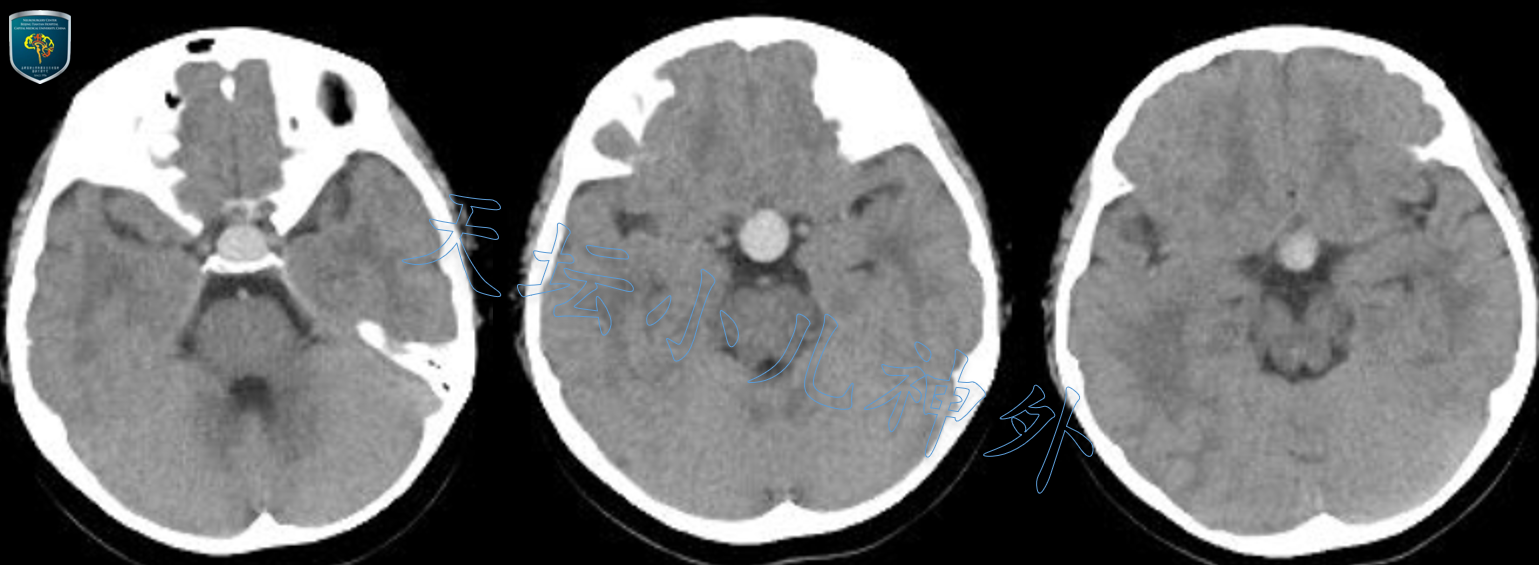
图1.头颅CT平扫提示:鞍内及鞍上圆形高密度影,无钙化影,大小约16X15X25cm,CTA未见异常血管影。
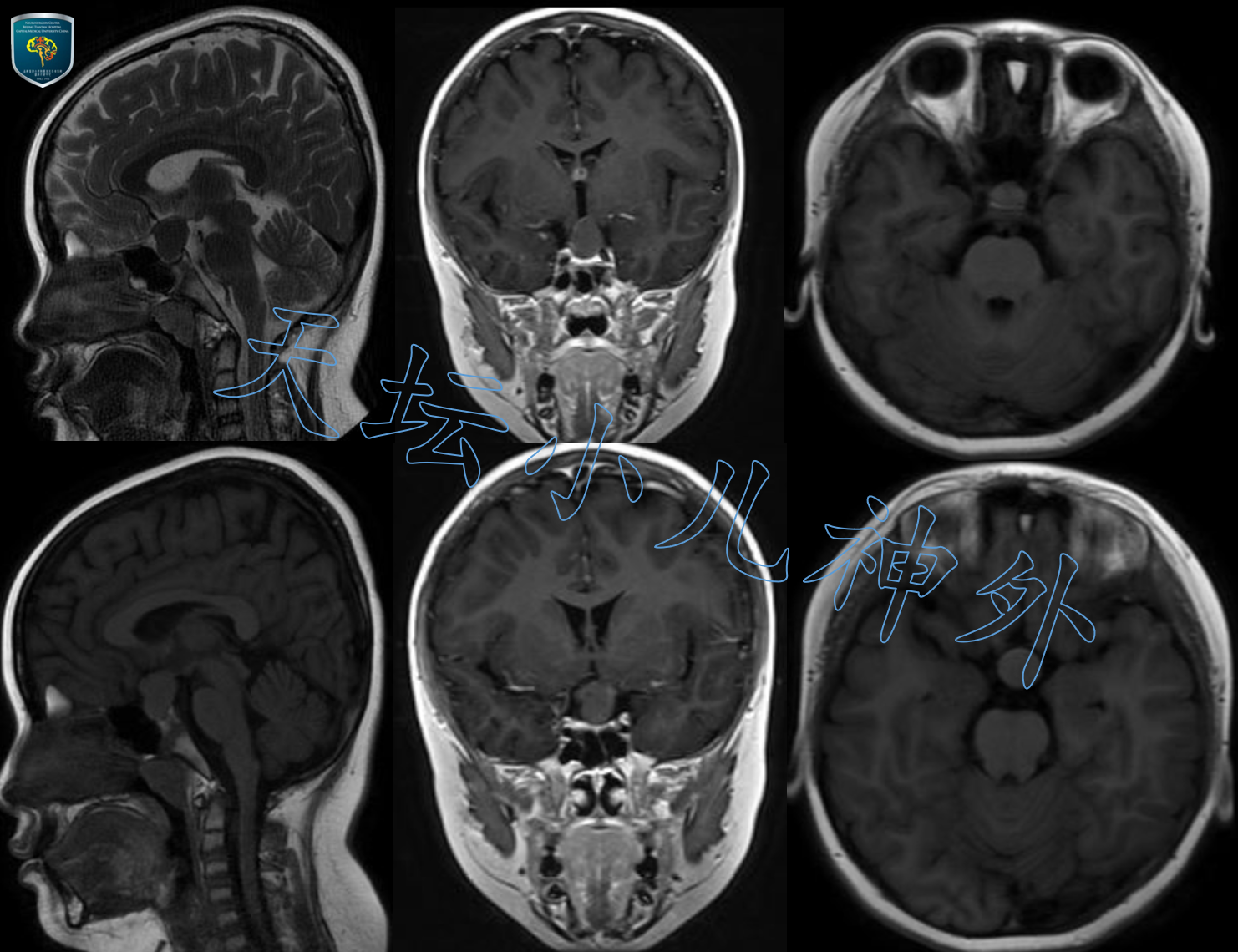
图2.头颅MRI显示:鞍内鞍上异常信号囊性团块,边缘清晰,未见明显强化,垂体受压变薄,蝶鞍略扩大,拉克氏囊肿(Rathke囊肿)可能性大。
患儿鞍区占位,手术指征明确,于2019年06月13日在全麻下行内镜下经鼻蝶入路鞍区病变切除术。先行右大腿外侧阔筋膜及脂肪留取备用。神经内镜下经右侧鼻孔入路,粘膜瓣成形,咬除蝶窦间隔、磨除鞍底骨质,矩形切开鞍底硬膜,见垂体受压变薄,剥离子牵开垂体,见病变位于鞍内鞍上,灰白色,胶冻样,乏血运,刮圈轻柔刮除,与蛛网膜下腔沟通,垂体柄、垂体、视神经、颈内动脉直视下保护完好。病变全切后,鞍隔下塌但未完全疝入鞍内,与鞍上池沟通,人工硬膜及自体筋膜、脂肪重建鞍底,鼻中隔粘膜瓣贴覆加固,右侧鼻腔填塞膨胀海绵,手术顺利,出血约100ml,未输血。
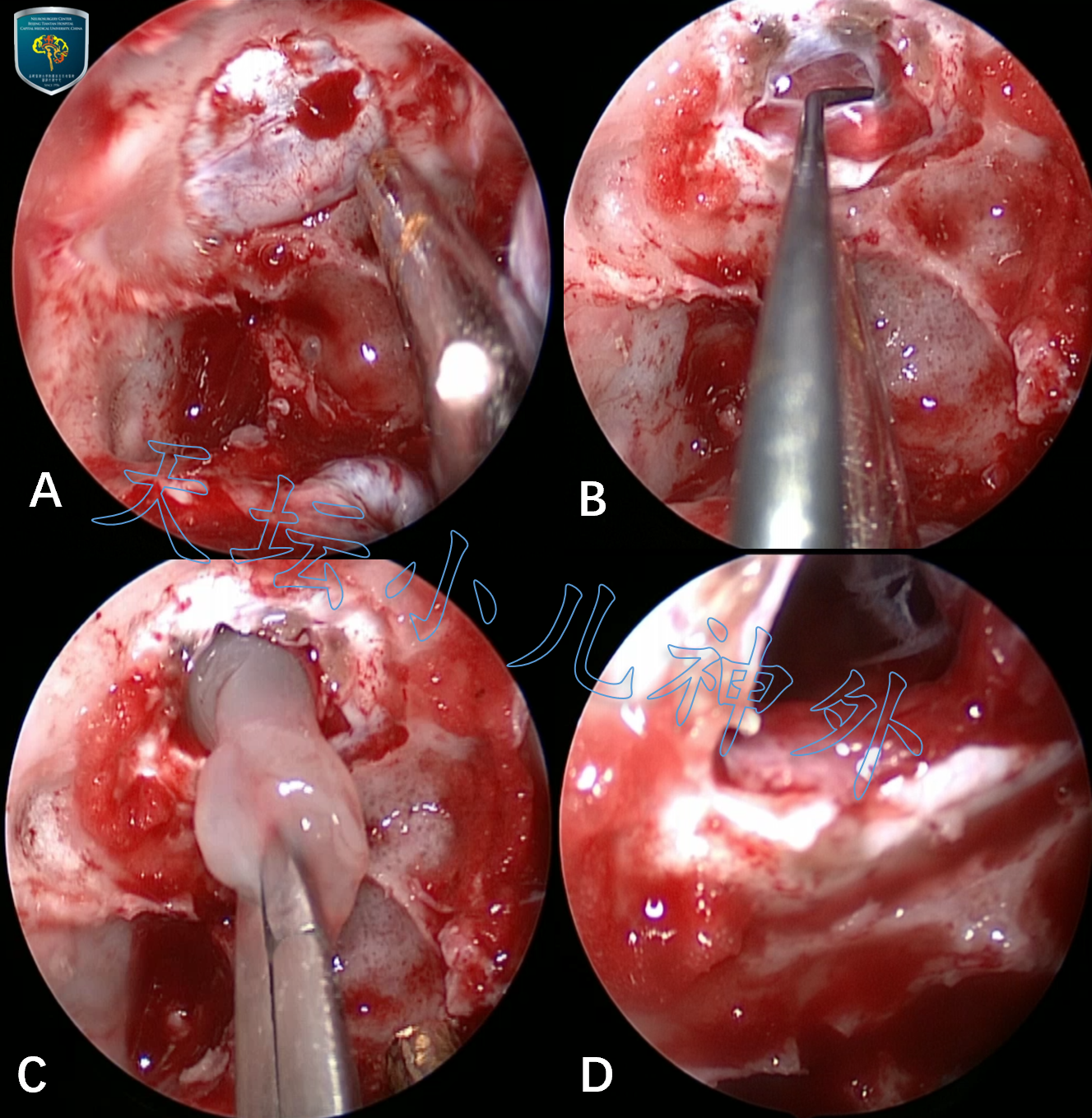
图3.手术图片:A充分暴露鞍底,磨除鞍底骨质;B鞍底硬膜切开,推开片状垂体;C拉克氏囊肿囊内减压;D拉克氏囊肿镜下全切,鞍隔未完全疝入鞍内,术腔与鞍上池沟通。
术后患儿状态好,视力视野同术前,血清学生长激素水平较术前提高(0.128ng/ml)。复查头颅CT/MRI显示拉克氏囊肿切除满意(图4)。术后病理显示:内容物为粉染无结构物,考虑为拉克氏(Rathke)囊肿。术后3天顺利出院,随访中。
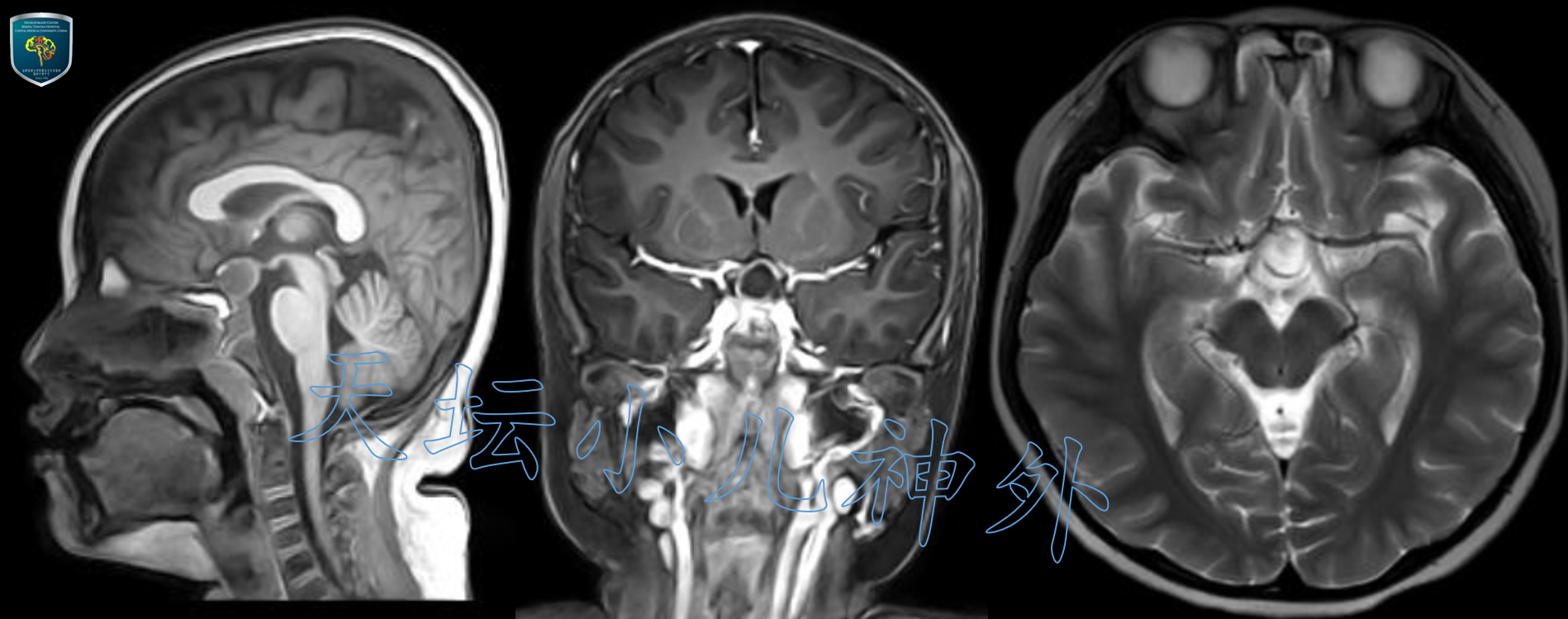
图4.术后一周复查头颅CT/MRI显示拉克氏囊肿囊内减压满意,鞍隔未完全下陷入鞍内。
病 例 2
2021年3月接诊一例来自河北唐山13岁男性患儿(174cm,90kg)。主诉:间断头痛40天来我院就诊。门诊查体:神清语利,自主体位,粗侧视力视野正常,发育正常,神经系统查体(-)。血清学检查:甲状腺素降低(59.75nmol/L),AFP及HCG阴性。头颅CT提示:鞍区类圆形病变,大小约15X11X14mm,囊壁部分蛋壳样钙化,蝶鞍扩大,鞍底下陷,颅咽管瘤可能性大(图1);头颅MRI提示:鞍区囊性异常信号团块,呈短T1长T2信号影,无明显强化,垂体显示不清,垂体柄左移,边缘清晰,Rathke囊肿?颅咽管瘤?(图2)。
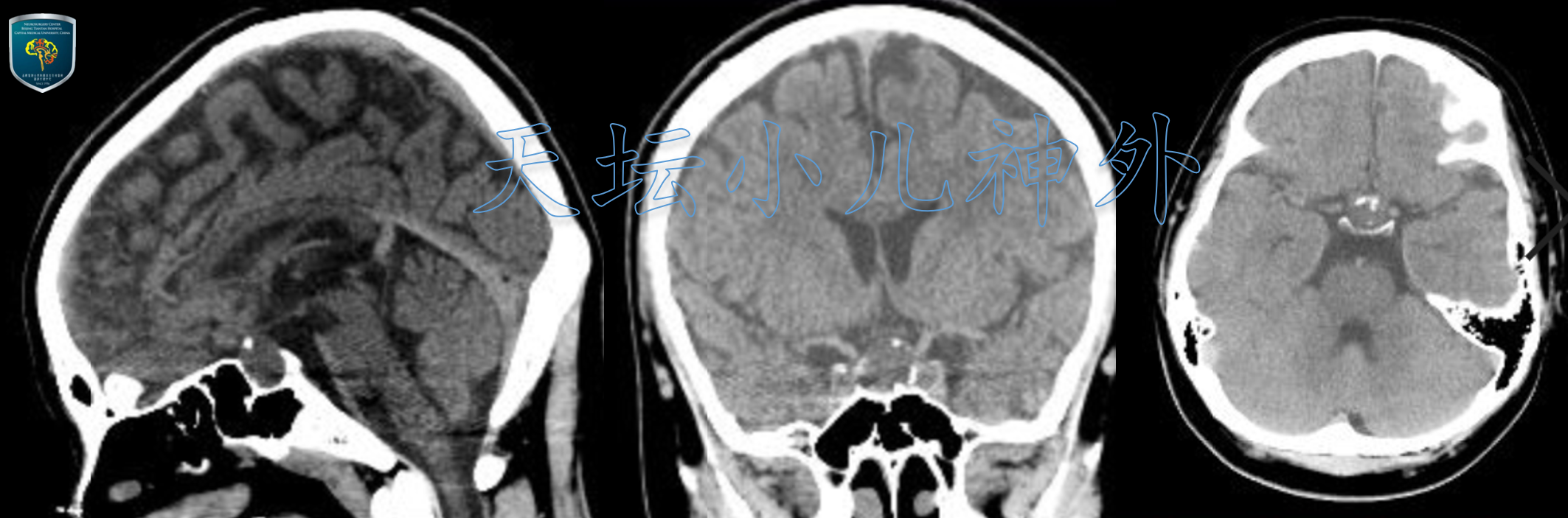
图5:术前头颅CT提示鞍区类圆形病变,大小约15 X 11 X 14 mm,囊壁部分蛋壳样钙化,蝶鞍扩大,鞍底下陷,颅咽管瘤可能性大。

图6:术前头颅MRI提示鞍区囊性异常信号团块,呈短T1长T2信号影,无明显强化,垂体显示不清,垂体柄左移,边缘清晰,Rathke囊肿?颅咽管瘤?
综合影像学特点,患儿鞍隔下型颅咽管瘤诊断基本明确,于2021年03月19日在导航辅助下行内镜下经鼻蝶入路颅咽管瘤切除术。先行右大腿外侧阔筋膜及脂肪留取备用。术中在导航下精确定位鞍底,鞍底骨质菲薄,切除后长针穿刺鞍内除外血管性病变,以勾刀切开鞍底硬膜,有黄褐色肿瘤囊液涌出,鞍底硬膜海绵间窦发达,电凝后流体海绵压迫止血满意。刮圈探查鞍内,见肿瘤囊实性,囊壁较厚,含散在沙砾状钙化,血供中等,鞍隔菲薄。钝性游离肿瘤囊壁,分块全切肿瘤。术腔与鞍上池沟通,人工硬膜及自体筋膜、脂肪重建鞍底,鼻中隔粘膜瓣贴覆加固,右侧鼻腔填塞膨胀海绵,手术顺利,术中出血约150ml,未输血,术后安返病房监护。
术后患儿恢复好,体温、尿量、电解质、激素水平均正常,视力视野同术前,术后复查头颅CT/MRI提示肿瘤切除满意(图7、图8)。术后第三天开始一过性尿量增多,血纳升高,对症处理后恢复正常。术后病理提示:造釉细胞型颅咽管瘤(WHOI级)。术后一周顺利出院,随访中。
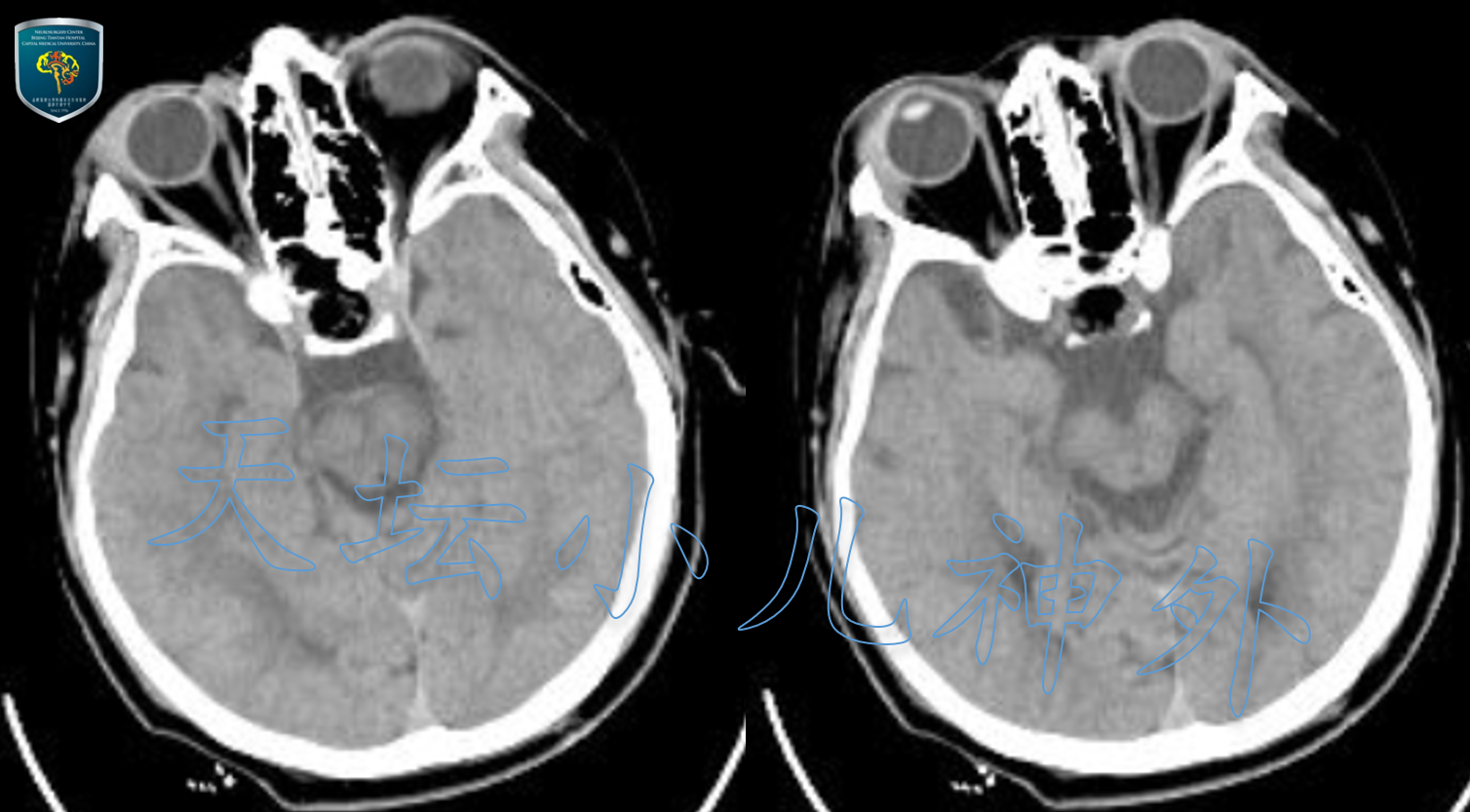
图7.术后当晚复查头颅CT显示颅咽管瘤切除满意。
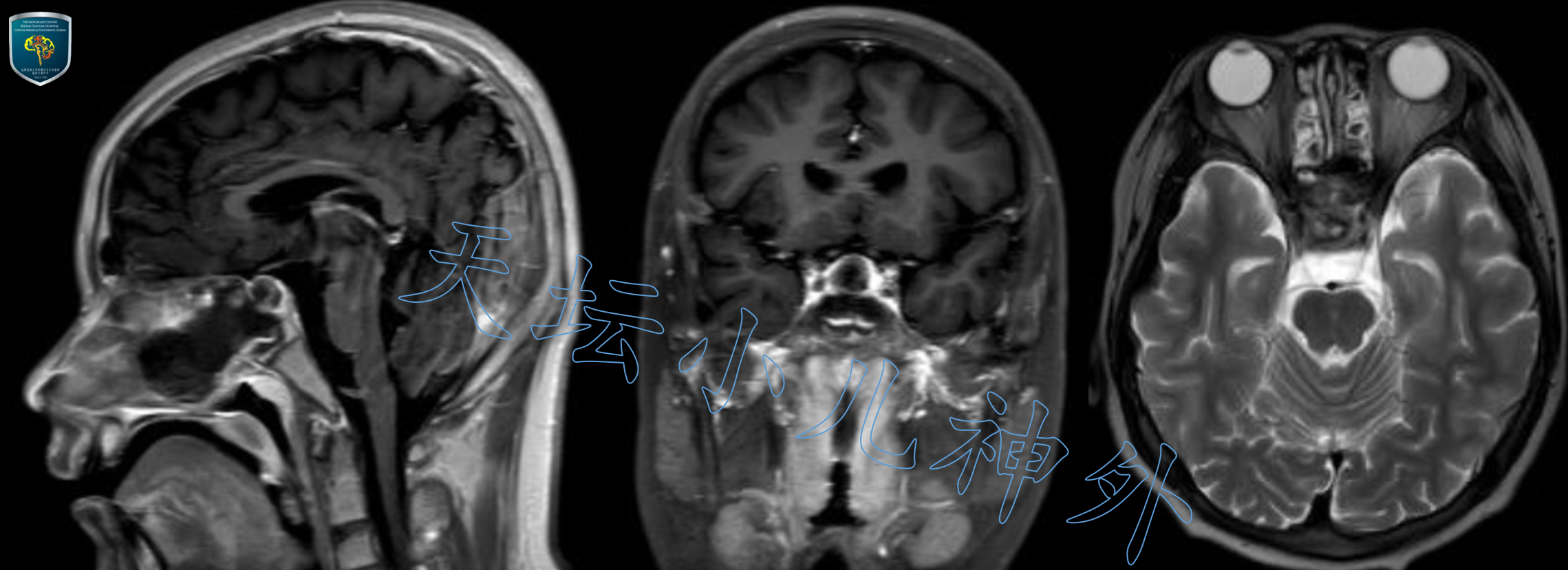
图8.术后一周复查头颅MRI显示肿瘤切除满意。
治 疗 体 会
内镜下经鼻蝶入路切除鞍区肿瘤,也就是大家常说的“微创”手术,发展至今历经五十余年1,目前已成为切除垂体腺瘤的首选入路2。针对成人颅咽管瘤,采取内镜经蝶手术也有广泛报道,疗效满意3。
针对儿童颅咽管瘤采用内镜经蝶手术没有大宗病例报道,多是零星病例,初步看治疗效果差异较大3-5。儿童与成人颅咽管瘤病理类型不同,儿童以造釉细胞型为主,多为囊实性、伴蛋壳样钙化,病理可见肿瘤呈指状突侵袭性生长(finger like protrusion),与毗邻组织粘连紧密6,7 ,肿瘤呈浸润性生长侵犯下丘脑的发生率远高于成人(60%8 vs 42%9)。成人颅咽管瘤多为鳞状乳头型,实体为主,边界清晰,对下丘脑侵袭性低,较易完整剥除。因此,就手术效果而言,儿童颅咽管瘤术后下丘脑损伤率高于成人6,8、5年无进展生存期(PFS)低于成人10;就肿瘤生长特性而言,儿童型颅咽管瘤适合开颅手术,成人型颅咽管瘤更适合内镜经蝶“微创”手术。
事实上,目前国际公认,年龄小于3岁的幼儿,由于鼻孔小、咽颅发育不全(splanchnocranium),是内镜经蝶手术的绝对禁忌;随着年龄增长,鼻腔发育、蝶窦气化、是否采用经蝶手术视具体情况而定13;13岁以上儿童蝶窦普遍气化良好,可行经鼻蝶内镜手术。14 同时需要注意,经蝶手术涉及基底窦、海绵间窦,6岁以前儿童硬膜窦发达,两侧海绵窦之间的距离平均为10.2mm,明显窄于成人,严重影响操作空间15。另外,由于经鼻蝶手术操作空间狭小,切除肿瘤时以牵拉为主,直视下游离肿瘤囊壁与粘附表面的穿支小血管较开颅手术难度大,一旦破裂出血,以局部压迫为主,若术中出血量大,儿童对失血的耐受程度远低于成人,易造成失血性休克等严重并发症。因此,就手术风险而言,颅咽管瘤大于垂体腺瘤、经蝶手术大于开颅手术、儿童大于成人。目前,采用内镜经蝶手术切除儿童鞍膈下型颅咽管瘤得到广泛肯定4;然而,第三脑室内型若采用经蝶手术需要打开三脑室底,易造成下丘脑损伤;偏离中线型呈分叶状侵袭性生长,内镜下也难以看清肿瘤全貌,均列为相对禁忌征3,16。
因此,我们选择的两个病例,均为鞍隔下型,对下丘脑未形成侵袭性生长;年龄为青少年,鼻腔及蝶窦发育好。术中一例海绵间窦发达,硬膜窗范围小于鞍底骨窗范围,庆幸未对手术操作造成严重影响。
内镜经蝶手术切除鞍区肿瘤是大势所趋,优势明显4,5,14。但是,由于儿童颅咽管瘤的特殊性,采用该术式时,应该慎重选择,有序开展,以确保患儿的安全。
参 考 文 献
1. Iancu C. Advances in Endoscopic Surgery. France: InTech; 2011.
2. Bajaj J, Chandra PS. Recent Developments in Endoscopic Endonasal Approach for Pituitary Adenomas. Neurology India. 2020;68(Supplement):S79-s84.
3. 神经内镜经鼻颅咽管瘤切除技术专家共识. 中华神经外科杂志. 2020;36(11):1088-1095.
4. Soldozy S, Yeghyayan M, Yağmurlu K, et al. Endoscopic endonasal surgery outcomes for pediatric craniopharyngioma: a systematic review. Neurosurgical focus. 2020;48(1):E6.
5. Kobets A, Ammar A, Dowling K, Cohen A, Goodrich J. The limits of endoscopic endonasal approaches in young children: a review. Child's nervous system : ChNS : official journal of the International Society for Pediatric Neurosurgery. 2020;36(2):263-271.
6. Hölsken A, Sill M, Merkle J, et al. Adamantinomatous and papillary craniopharyngiomas are characterized by distinct epigenomic as well as mutational and transcriptomic profiles. Acta Neuropathol Commun. 2016;4:20.
7. Flitsch J, Müller HL, Burkhardt T. Surgical strategies in childhood craniopharyngioma. Front Endocrinol (Lausanne). 2011;2:96-96.
8. Sterkenburg AS, Hoffmann A, Gebhardt U, Warmuth-Metz M, Daubenbüchel AM, Müller HL. Survival, hypothalamic obesity, and neuropsychological/psychosocial status after childhood-onset craniopharyngioma: newly reported long-term outcomes. Neuro-oncology. 2015;17(7):1029-1038.
9. Jensterle M, Jazbinsek S, Bosnjak R, et al. Advances in the management of craniopharyngioma in children and adults. Radiology and oncology. 2019;53(4):388-396.
10. Pekmezci M, Louie J, Gupta N, Bloomer MM, Tihan T. Clinicopathological characteristics of adamantinomatous and papillary craniopharyngiomas: University of California, San Francisco experience 1985-2005. Neurosurgery. 2010;67(5):1341-1349; discussion 1349.
11. Park HJ, Dho YS, Kim JH, Kim JW, Park CK, Kim YH. Recurrence Rate and Prognostic Factors for the Adult Craniopharyngiomas in Long-Term Follow-Up. World neurosurgery. 2020;133:e211-e217.
12. Sarkar S, Chacko SR, Korula S, et al. Long-term outcomes following maximal safe resection in a contemporary series of childhood craniopharyngiomas. Acta neurochirurgica. 2021;163(2):499-509.
13. Tatreau JR, Patel MR, Shah RN, et al. Anatomical considerations for endoscopic endonasal skull base surgery in pediatric patients. The Laryngoscope. 2010;120(9):1730-1737.
14. Mazzatenta D, Zoli M, Guaraldi F, et al. Outcome of Endoscopic Endonasal Surgery in Pediatric Craniopharyngiomas. World neurosurgery. 2020;134:e277-e288.
15. Tatreau JR, Patel MR, Shah RN, McKinney KA, Zanation AM. Anatomical limitations for endoscopic endonasal skull base surgery in pediatric patients. The Laryngoscope. 2010;120 Suppl 4:S229.
16. Koutourousiou M, Fernandez-Miranda JC, Wang EW, Snyderman CH, Gardner PA. The limits of transsellar/transtuberculum surgery for craniopharyngioma. Journal of neurosurgical sciences. 2018;62(3):301-309.





