美国阿拉巴马大学伯明翰分校的Erwin G. Van Meir等通过研究发现,N钙粘素在胶质瘤干细胞发生放射抵抗起重要作用,结果发表在2021年3月的《The Journal of Clinical Investigation》在线。
——摘自文章章节
【Ref: Osuka S, et al. J Clin Invest. 2021 Mar 15;131(6):e136098. doi: 10.1172/JCI136098.】
胶质母细胞瘤(GBM)预后差的原因之一是在多次放射治疗后仍有部分肿瘤细胞存活,这也是肿瘤复发的主要原因。研究显示,放射抵抗(radioresistance)的胶质母细胞瘤具有生长缓慢、自我更新能力强的干细胞特性。目前对于放射抵抗的胶质瘤干细胞仍无有效的治疗方法。美国阿拉巴马大学伯明翰分校的Erwin G. Van Meir等通过研究发现,N钙粘素(N-cadherin,N-Cad)在胶质瘤干细胞发生放射抵抗起重要作用,结果发表在2021年3月的《The Journal of Clinical Investigation》在线。作者建立放射抵抗的胶质瘤干细胞模型。干细胞取自Ink4a/Arf-/-缺陷成年大鼠脑室底部,并逆转录病毒转染使其高表达ras,称之为mGS;该细胞可在干细胞培养液内成球状生长,即mGSRR。随后照射该细胞,5Gy/次,共12次,mGSRR细胞获得明显放射抵抗性:克隆实验显示,mGSRR比mGS有明显的放射抵抗性,生存曲线显示mGSRR不能获取放射治疗的效果,并且mGSRR干细胞特性明显增强:神经干细胞标志Olig2表达上调,而神经细胞分化标志Tuj-1下调;3D细胞培养mGSRR细胞呈球团状生长(图1)。
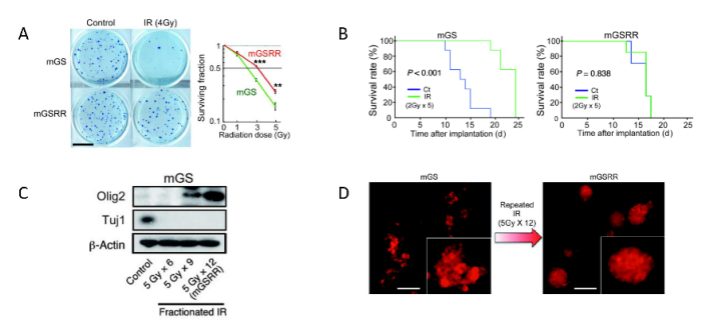
图1. 放射抵抗的胶质瘤干细胞之间细胞黏附性增强,分化减慢,干细胞特性增强。接着,作者对mGSRR细胞采用分割放射治疗,发现mGSRR细胞表面N-cadherin表达上调,相似结果在人胶质瘤干细胞MGG4中得到证实;MGG4过表达N-cadherin后放疗抵抗性明显增强。TCGA数据库分析表明,高表达N-cadherin的患者生存期短,对放射治疗的效果有限。敲除N-cadherin后放射治疗效果明显提高;而再次过表达N-cadherin又增强放射治疗抵抗性(图2)。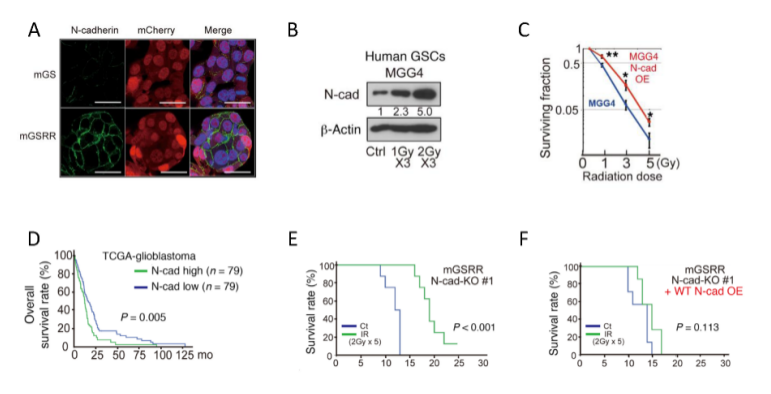
图2. N-cadherin表达上调介导肿瘤放射治疗抵抗性。同时,作者观察到,放射治疗抵抗的肿瘤细胞表面β-catenin表达上升,进一步抑制Wnt/β-catenin介导的细胞增殖分化信号通路;而在由N-cadherin介导的CBR区,N-cadherin表达下调,细胞表面β-catenin明显减少,细胞放疗效果显著提高(图3)。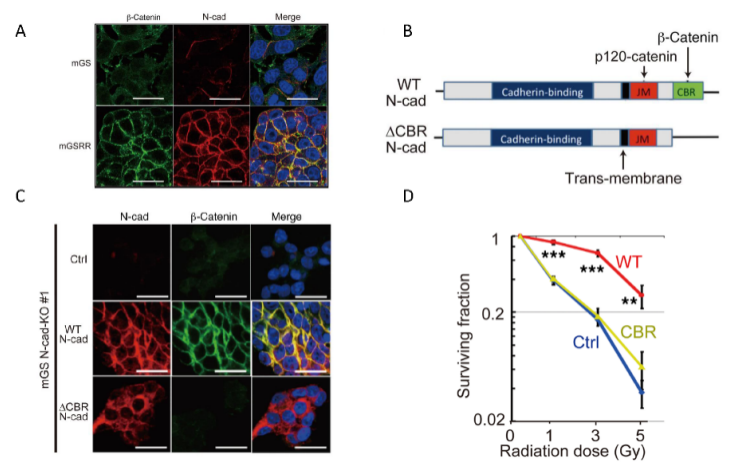
图3. N-cad介导肿瘤细胞表面β-catenin表达增加;在CBR区介导肿瘤放射抵抗。作者进一步发现,N-cad表达增加后,凝聚素表达亦随之上升,抑制放疗后的细胞凋亡。TCGA数据库分析两者表达量之间存在明显正相关;凝聚素高表达的患者生存期明显缩短。此外,放射治疗后IGF-1水平表达增加,介导N-cad及其之后的放射抵抗通路;因此使用IGF-1抑制剂后,mGSRR明显获得放射治疗的效果(图4)。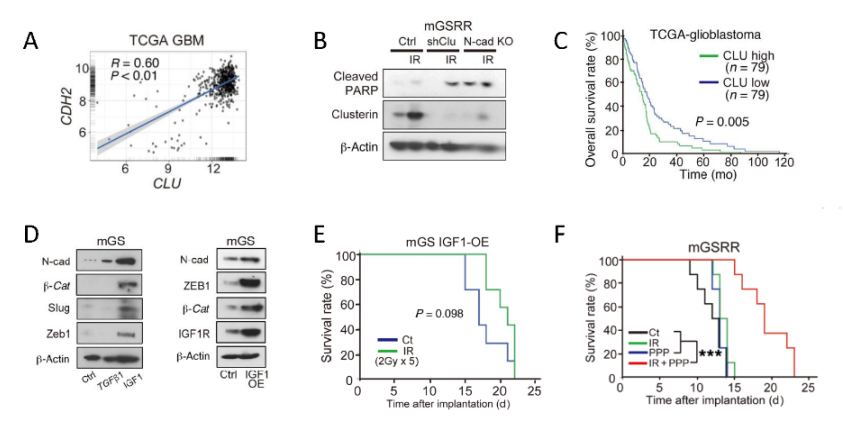
图4. N-cad表达上调凝聚素的表达,进一步抑制放疗后细胞凋亡;IGF-1水平表达增加介导N-cad及其之后的放射抵抗通路,使用IGF-1抑制剂增强放疗敏感性。作者通过研究首次揭示,N-cad介导胶质母细胞瘤在反复放射治疗后发生放射抵抗的相关机制和通路,加深对GBM放疗抵抗的认识。研究结果表明,IGF/ N-cad/β-catenin/Clu信号轴可能成为新的潜在治疗靶标,具有临床转化的实际意义。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。












