2020年9月接诊一例来自海南海口的5岁女性患儿(18.9kg,112cm),主诉:双眼水平震颤3年,视力下降2年、右侧为著,头晕1月余。家长诉患儿3年前双眼水平震颤,于海南当地医院行头颅MRI平扫显示右侧视神经占位,由于患儿幼小,建议观察,未予治疗。近两年,双眼视力进行性下降,右侧为著;1月前患儿诉头晕明显,再行头颅MRI显示肿瘤进展,遂进京来我院就诊。门诊查体:神清语利,自主体位,左眼视力0.05,右侧眼前数指,右侧瞳孔直接对光反射迟钝,双眼水平震颤明显,余神经系统查体阴性。头颅CT/MR显示,右侧视神经、视交叉、右侧丘脑枕部占位性病变,较两年前进展明显,视路胶质瘤可能性大。
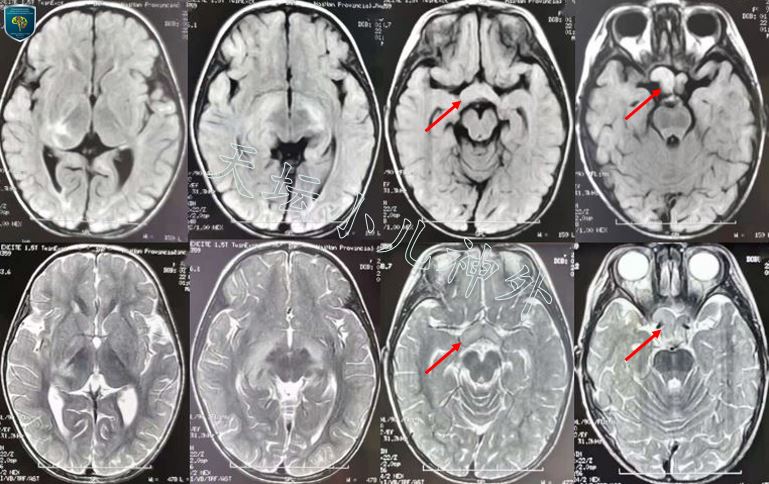
图1.患儿三年前(22月龄)时头部MRI平扫显示右侧视神经、视束增粗(红色箭头),右侧丘脑旁不规则信号影,考虑视路胶质瘤可能性大,未予治疗。
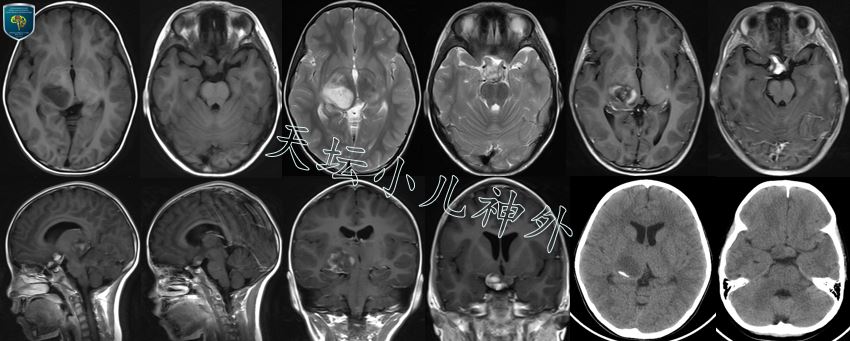
图2.本次入院前检查(5岁龄)肿瘤明显进展,头颅CT示右侧视神经、视交叉、下丘脑及右侧丘脑枕可见不规则低密度影,边缘条状钙化;MRI示视交叉、下丘脑及右侧丘脑枕可见不规则长T1长T2信号影,边缘欠清,不均匀强化,视路胶质瘤可能性大。
鉴于肿瘤进展明显,手术指征明确,主体位于右侧视放射区域、累及右侧丘脑枕部,完善术前检查,于2020年9月25日在全麻下行右侧三角区入路肿瘤切除术。术中超声及fMRI-DTI导航引导下,经皮层造瘘进入右侧脑室三角区,见右侧丘脑枕明显膨隆,电凝切除三角区脉络丛球,纵行沿纤维束走形切开丘脑枕,见皮层下肿瘤,色灰黄、质软、部分胶冻样、血供中等,与丘脑边界尚清晰、易辨别,大小约2X2X3cm,镜下右侧丘脑区域肿瘤近全切除。术中冰冻回报:星形细胞瘤可能性大。手术顺利,瘤体负荷减压充分,止血满意,术中出血约110ml,未输异体血。术后安返病房监护。
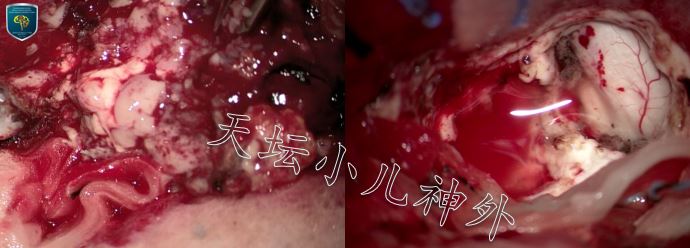
图3.术中见肿瘤累及右侧丘脑枕,色灰黄、质软、部分胶冻样,边界尚清晰(图左);右侧丘脑区域肿瘤,减压充分,切除满意(图右)。
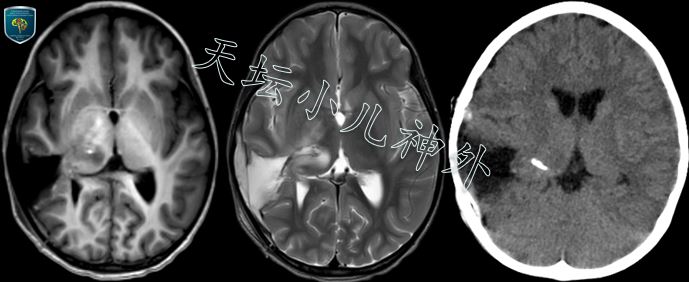
图4.术后复查头颅CT/MR:右侧丘脑区域肿瘤切除满意。
术后患儿状态好,视力同术前,无新增神经系统阳性体征。术后病理回报示星形细胞瘤(WHOⅡ级);免疫组化提示:GFAP(+),Olig-2(+),IDH1(-),ATRX(+),P53(5%弱+),Ki-67(约2-6%),H3K27M(-),H3K27me3(+),Syn(+),CD34(散在+),BRAFV600E(-)。基因检测提示:NF1未检出突变,MGMT启动子甲基化阳性。术后十天顺利出院,回当地继续放疗。
患儿术后3个月开始放疗,1个月结疗后再次来我院门诊复查。患儿一般状态好,视力同前,头颅MRI显示右侧丘脑、视放射区肿瘤切除满意,右侧视神经、视交叉区域瘤体较放疗前明显缩小,疗效果满意,随访中。
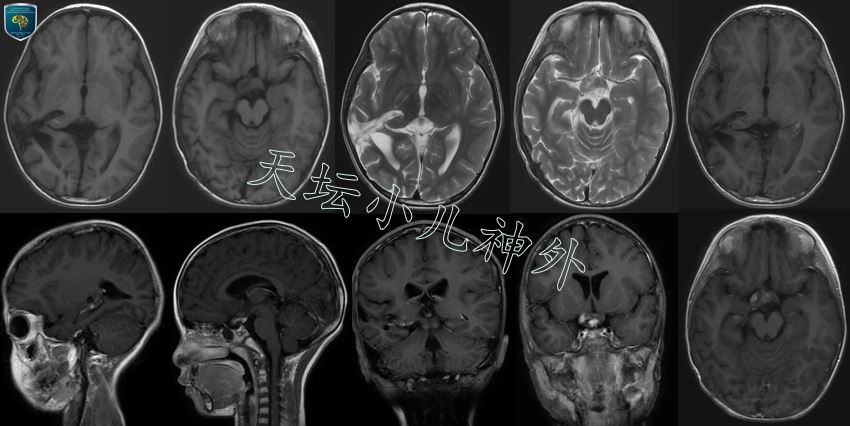
图5.术后4个月,放疗结疗后复查头颅MRI:右侧丘脑、视放射区域肿瘤切除满意;右侧视神经、视交叉区域瘤体较放疗前缩小明显,疗效满意。
治疗体会
视路胶质瘤(Opticpathway glioma,OPG)是起源于视觉传导通路的星形细胞瘤,绝大多数为毛细胞型星形细胞瘤(WHOI级)1,少数为毛粘液型星形细胞瘤(WHOII级),呈膨胀性生长,多发生于儿童,男性多于女性,5-8岁为发病高峰,约占儿童颅脑肿瘤的3-5%2-4。OPG临床依据Dodge分型5:I型仅累及单侧或双侧视神经;II型累及视交叉,伴或不伴视神经临近结构的受累;III型可累及下丘脑及临近结构,本例属于最复杂的Dodge-III型。OPG患儿多以水平眼震为首发症状,可伴单侧或双侧视力下降;若累及下丘脑,可表现为极度消瘦;若堵塞室间孔,可造成梗阻性脑积水,出现剧烈头痛、呕吐等高颅压症状。OPG总体预后良好,5年总生存率(OS)和无进展生存率(PFS)分别为84.1%和70.6%,手术减压辅助放射治疗,普遍治疗效果满意6。
国外约70%的OPG患儿可伴发神经纤维瘤病I型(Neurofibromatosistype I,NF-1型OPG)7-9,但中国儿童伴发率较低10,多为散发型OPG(SporadicOPG)。NF-1的突变情况一般靠外周血即可检测,部分需结合肿瘤标本的双重检验11。在肿瘤的自然进展过程中,NF-1相关的OPG可能自然消退12,因此,无症状型NF1-OPG建议动态观察;若肿瘤进行性增大,无论NFI型还是散发型OPG,均应及时治疗。据此,我们初步制定了儿童视路胶质瘤(OPG)天坛治疗规范,临床效果满意。
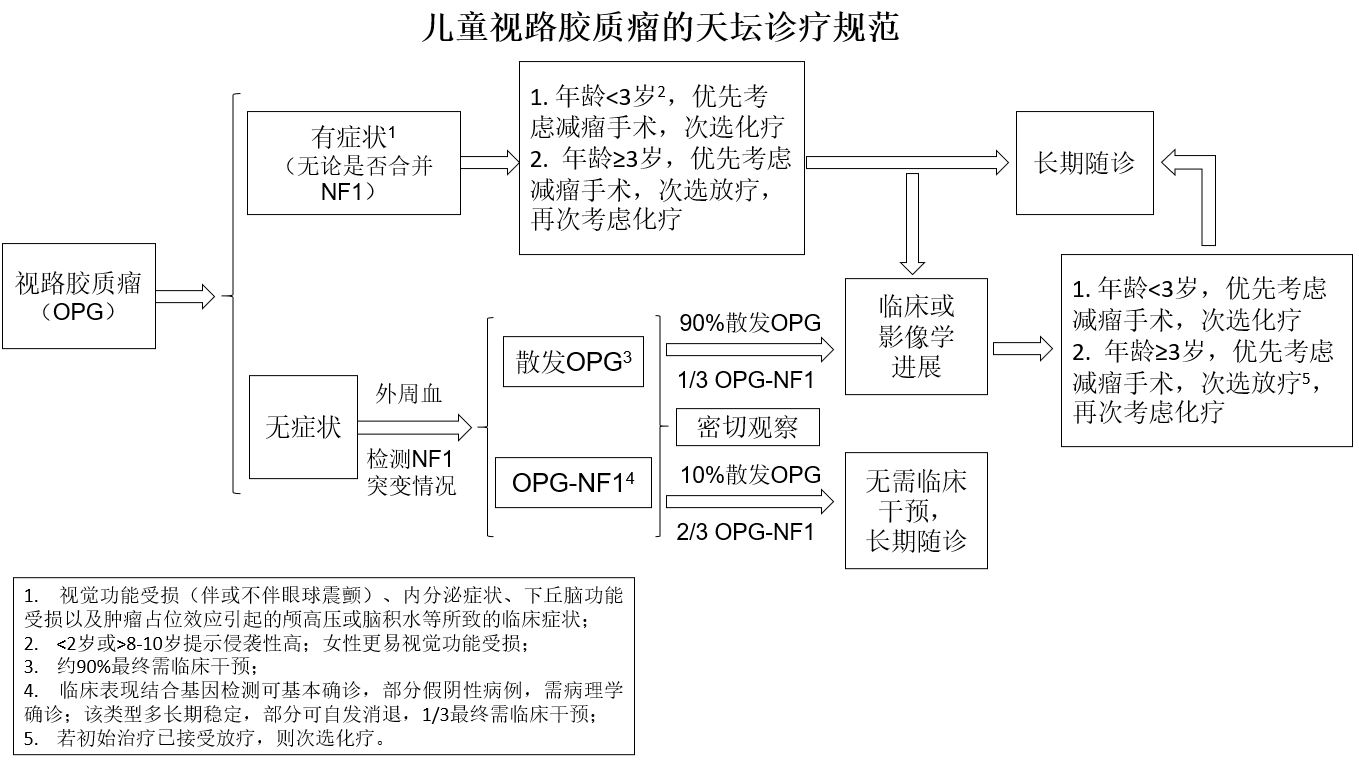
本例基因检测提示NF1变异阴性,属散发型OPG,在临床工作中,该型约90%瘤体进行性增大,需要手术干预。本例患儿22月龄即发现右侧视神经占位,依据天坛诊疗规范,即使无症状体征变化,也应每6-12个月复查一次。然而,该患儿直到三年后出现双眼视力进行性下降伴头晕明显才进行复查,见肿瘤进展迅速,已累及视交叉、下丘脑、右侧视束、右侧视放射及右侧丘脑枕。此时,应尽早施行手术干预。在手术入路选择上,因手术目的是尽量减少瘤负荷,为后续放疗做准备。而肿瘤主体位于右侧视放射,因此选择右侧三角区入路,既避免了对视神经、视交叉、下丘脑的损伤,大大提高了手术安全性;又能充分暴露肿瘤主体,尽量加以切除,以达到充分减轻瘤负荷之目的。当然,丘脑周围神经纤维密布,特别是肿瘤与视放射相交织,需要在DTI导航引导下精确切除。
OPG术后化疗效果差异较大13,对于视力保护效果不佳,超过60%的病例存在肿瘤进展的情况,需要结合放疗或手术进行补救14。术后放疗对视力的保护效果好,可显著延长无失明生存期(Blindness-freesurvival,BFS)15,建议对于>3岁的患儿,可以将术后放疗作为一线方案。而化疗建议应用于<3岁,或无法耐受放疗的患儿。本例患儿经过放疗后,视交叉、下丘脑区域肿瘤体积缩小明显,视力保护好,因此,OPG术后放疗,值得推荐。
参考文献
1. Ryall S, Tabori U, Hawkins C. Pediatric low-grade glioma in the era of molecular diagnostics. Acta Neuropathol Commun. 2020 Mar 12;8(1):30.
2. Jahraus CD, Tarbell NJ. Optic pathway gliomas. Pediatr Blood Cancer. 2006 May 1;46(5):586-96.
3. Rasool N, Odel JG, Kazim M. Optic pathway glioma of childhood. Curr Opin Ophthalmol. 2017 May;28(3):289-295.
4. Aihara Y, Chiba K, Eguchi S, Amano K, Kawamata T. Pediatric Optic Pathway/Hypothalamic Glioma. Neurol Med Chir (Tokyo). 2018 Jan 15;58(1):1-9.
5. DODGE HW Jr, LOVE JG, CRAIG WM, DOCKERTY MB, KEARNS TP, HOLMAN CB, HAYLES AB. Gliomas of the optic nerves. AMA Arch Neurol Psychiatry. 1958 Jun;79(6):607-21.
6. Liu Y, Hao X, Liu W, Li C, Gong J, Ma Z, Tian Y. Analysis of Survival Prognosis for Children with Symptomatic Optic Pathway Gliomas Who Received Surgery. World Neurosurg. 2018 Jan;109:e1-e15.
7. Campen CJ, Gutmann DH. Optic Pathway Gliomas in Neurofibromatosis Type 1. J Child Neurol. 2018 Jan;33(1):73-81.
8. Siwá A, Autrata R, Vejmělková K, Pavelka Z, Zitterbart K. NEUROFIBROMATOSIS TYPE 1 AND OPTIC PATHWAY GLIOMA. Cesk Slov Oftalmol. 2019 Winter;75(4):200-208. English.
9. Khatua S, Gutmann DH, Packer RJ. Neurofibromatosis type 1 and optic pathway glioma: Molecular interplay and therapeutic insights. Pediatr Blood Cancer. 2018 Mar;65(3).
10. 田永吉,李德岭,甲戈,等. 53例儿童视路胶质瘤的临床特点及预后分析[J]. 中华神经外科杂志,2012,28(11):1137-1140.
11. Lobón-Iglesias MJ, Laurendeau I, Guerrini-Rousseau L, Tauziède-Espariat A, Briand-Suleau A, Varlet P, Vidaud D, Vidaud M, Brugieres L, Grill J, Pasmant E. NF1-like optic pathway gliomas in children: clinical and molecular characterization of this specific presentation. Neurooncol Adv. 2019 Dec 20;2(Suppl 1):i98-i106.
12. Sellmer L, Farschtschi S, Marangoni M, Heran MKS, Birch P, Wenzel R, Mautner VF, Friedman JM. Serial MRIs provide novel insight into natural history of optic pathway gliomas in patients with neurofibromatosis 1. Orphanet J Rare Dis. 2018 Apr 23;13(1):62.
13. Zhang J, Wu G, Miller CP, Tatevossian RG, Dalton JD, Tang B, Orisme W, Punchihewa C, Parker M, Qaddoumi I, Boop FA, Lu C, Kandoth C, Ding L, Lee R, Huether R, Chen X, Hedlund E, Nagahawatte P, Rusch M, Boggs K, Cheng J, Becksfort J, Ma J, Song G, Li Y, Wei L, Wang J, Shurtleff S, Easton J, Zhao D, Fulton RS, Fulton LL, Dooling DJ, Vadodaria B, Mulder HL, Tang C, Ochoa K, Mullighan CG, Gajjar A, Kriwacki R, Sheer D, Gilbertson RJ, Mardis ER, Wilson RK, Downing JR, Baker SJ, Ellison DW; St. Jude Children’s Research Hospital–Washington University Pediatric Cancer Genome Project. Whole-genome sequencing identifies genetic alterations in pediatric low-grade gliomas. Nat Genet. 2013 Jun;45(6):602-12.
14. Kelly JP, Weiss AH. Detection of tumor progression in optic pathway glioma with and without neurofibromatosis type 1. Neuro Oncol. 2013 Nov;15(11):1560-7.
15. Hanania AN, Paulino AC, Ludmir EB, Shah VS, Su JM, McGovern SL, Baxter PA, McAleer MF, Grosshans DR, Okcu MF, Chintagumpala MM. Early radiotherapy preserves vision in sporadic optic pathway glioma. Cancer. 2021 Mar 19.





