《Neuro-Oncology》杂志2021年6月28日在线发表德国、瑞士、奥地利、意大利、挪威、比利时、西班牙、荷兰的Roland Goldbrunner,Pantelis Stavrinou,Michael D Jenkinson,等十七位学者联合撰写的《欧洲神经肿瘤学会脑膜瘤诊治指南。EANO guideline on the diagnosis and management of meningiomas》(doi:10.1093/neuonc/noab150.)。

![]()
摘要
脑膜瘤是最常见的颅内肿瘤。然而,只有很少的对照临床试验指导临床决策,导致不同国家和中心的管理方法不同。然而,分子遗传学的最新进展和临床试验结果有助于改进脑膜瘤的诊断和治疗方法。因此,欧洲神经肿瘤学协会(EANO)更新了对脑膜瘤的诊断和治疗建议。
脑膜瘤的拟诊(A provisional diagnosis of meningioma)通常是通过神经成像,主要是磁共振成像作出的。这种拟诊可能是偶然(incidentally)作出的。因此,相当大比例的脑膜瘤,特别是无症状或老年人或两者皆有的患者,可通过观察-扫描策略进行管理。根据WHO分类,需要对组织进行手术干预,通常的目标是大体全部切除组织。分子表达谱(molecular profiling)包括基因全套测序(gene panel sequencing)和基因组甲基化分析(genomic methylation profiling)的作用正在显现。包括受累硬脑膜的手术全部切除通常可以达到治愈。不能手术或复发的肿瘤需要治疗,如果大小或邻近的关键结构允许,可以用放射外科治疗,或分割放射治疗(RT)。虽然对各种放疗方法的时机、类型和剂量仍存在争议,外科手术和放射外科相结合或分割放疗的治疗理念越来越多地得到使用。就像所有的全身系统药物治疗方法一样,以生长抑素受体为靶点的放射性核素治疗是一种实验性方法。以血管内皮生长因子受体为靶点的贝伐单抗或多激酶抑制剂获得了不太算是的最佳的药物治疗效果(The best albeit modest results),但目前尚无确定的全身系统性治疗的标准。
要点
对于意外的(incidental)、无症状的、疑似脑膜瘤,采取观察是第一选择。
对于生长或有症状的肿瘤,手术切除是首选。
放射外科或分割放射治疗可能是补充疗法,甚至在某些情况下是手术的替代方法。
分子诊断学发展迅速。高度推荐组织观察作出分子诊断和未来进行靶向治疗。
研究的重要性
本文更新了2016年发表的脑膜瘤的诊断和治疗指南,它基于2016年至2021年的新证据,包括了2021年WHO中枢神经系统(CNS)肿瘤新分类的更新。该更新是由欧洲神经肿瘤协会(EANO)的一个多学科工作组汇编的。该指南的目标是帮助专业医务人员在最佳证据的基础上参与脑膜瘤患者的诊断和管理。
介绍
2016年,欧洲神经肿瘤协会(EANO)发布了首个脑膜瘤的诊断和治疗指南。从那时起,诊断和治疗决策的证据水平在各个方面都有所提高。许多关于不同WHO分级的脑膜瘤的分子遗传学的报道为脑膜瘤生物学和临床行为提供了有价值的见解。已获得来自对照临床研究的数据,新的WHO 2021年分类法改变了脑膜瘤的诊断方法。因此,EANO的一个工作组被授权重新评估目前关于脑膜瘤的文献,并更新这些肿瘤的诊断和治疗指南。
方法
在EANO工作组有所有涉及脑膜瘤诊断和治疗的临床专业领域的代表。作为第一步,EANO指南委员会对不同欧洲国家的这些学科的代表进行了临床和科学活动以及指南专业知识的评估,并邀请他们加入工作组。神经放射影像学、神经外科学、神经病理学、放射肿瘤学和内科神经肿瘤学专家受邀参加。接下来,指南委员会对更新指南的重点领域和敏感、具体的关键词以及关键词组合进行界定。主要关键词是:化疗、临床表现、认知、流行病学、组织病理学、免疫治疗、药物治疗、磁共振成像、脑膜瘤、显微外科、分子病理学、神经认知、神经病理学、药物治疗、正电子发射断层摄影、预后、放射治疗、放射-手术、危险因素、生活质量、放射外科,颅底肿瘤,支持性治疗,外科(chemotherapy,clinical spansentation,cognition,epidemiology, histopathology,immunotherapy,medical therapy, magnetic resonance imaging,meningioma,microsurgery,molecular pathology, neurocognition,neuropathology,pharmacotherapy,positron emission tomography,prognosis,radiation therapy,radio-surgery,risk factors,quality of life,radiosurgery,skull base tumor,supportive therapy,surgery.)。
考虑临床专业和科学情况下按重点区域分配到单个作者或作者小组。从2016年5月到2020年5月,作者使用定义的关键词检索了Medline数据库、Cochrane图书馆、Embase Ovid、Cancer Net 和Science Citation Index。如果有必要提供证据,可以加入少量较早的参考文献。工作组成员所代表的所有语文的所有类型的文章都得到了审议。在所有作者的参与下,对单个作者检索的文献进行共识评估,并选择120篇论文编写最终指南。根据欧洲神经学会联盟(the European Federation of Neurological Societies)的指南,科学证据被划分为I-IV级,参考文献被标记为A-C级。如果一项建议没有足够的证据,则以“良好的实践要点(good practice point)”提供建议。
流行病学和危险因素
脑膜瘤在所有原发性颅内和中枢神经系统肿瘤中发病率最高(37.6%)。根据2019年发布的美国中枢性脑瘤登记(Central Brain Tumor Registry)报告,2012-2016年美国脑膜瘤年度年龄校正发病率(the annual age-adjusted incidence rate)为每10万人8.58例。发病率随年龄增大而增加,65岁后增加明显从2004年到2010年。
WHO 2级不典型颅内脑膜瘤的发病率从0.28(95%置信区间CI,0.27-0.29)上升到0.30(95%CI,0.28-0.32),年度变化百分比(annual percent change)为3.6%(95%CI,0.8%-6.5%)。相反,从2000-2010年,WHO3级间变性脑膜瘤的发病率从0.13(95%CI,0.11-0.14)下降到0.06(95%CI, 0.06-0.07),年度变化百分比为-5.4%(95%CI,-6.8%至-4.0%)。从2004到2010年,WHO 1级、2级、3级颅内脑膜瘤(根据2000年WHO分级)的总体比例分别为94.6%、4.2%、1.2%。就WHO 1级和2级脑膜瘤总体而言,女性的发病率是男性的2.3倍,本来的非洲裔(originally Africans)脑膜瘤的发病率高于患所有级别脑膜的欧洲裔(Caucasians)。
电离辐射与脑膜瘤发展的风险增加有关。这不仅在因各种医疗指证接受照射后观察到,而且在原子弹幸存者中也观察到。相反,放射外科治疗后发生包括脑膜瘤等继发肿瘤的风险被认为很低,每10万病人年有6.8例。
神经纤维瘤病2型(NF2)是与脑膜瘤相关的最常见的遗传疾病。NF2患者也更有可能发展为2级和3级或多发性脑膜瘤。
因为育龄妇女的发病率较高,激素受体的肿瘤表达,与乳腺癌的关系,以及妊娠、月经周期和绝经期脑膜瘤的大小变化,许多研究试图将内源性和外源性激素暴露与脑膜瘤联系起来。女性长期暴露于外源性孕酮与血液中较低水平的孕酮受体(PR)以及NF2的mRNA有关,并被认为与脑膜瘤的较高风险有关。
诊断程序
成像
联合使用磁共振成像(MRI)和计算机断层扫描(CT)时,在大多数情况下,诊断颅内脑膜瘤的概率很高。典型的脑膜瘤在T1加权序列上呈等信号,在T2加权和液体衰减反转恢复(FLAIR)序列上呈高信号。它们显示出在肿瘤的周边强烈的增强和硬脊膜尾征。基于FLAIR上水肿程度评估和不均匀的对比剂增强,可能怀疑WHO 2级或3级组织学,CT联合骨窗扫描对评估邻近骨的骨质增生和骨内肿瘤的生长是有价值的。脑膜瘤表达生长抑素受体2,在注射生长抑素类似物(如(68)Ga(镓)-DOTATE或(90)Y(钇)-Dotatoc)后,可以通过正电子发射断层扫描(PET)对其进行描述(见图1)。这种探索,尚未成为标准做法,有助于区分肿瘤与健康组织和术后组织变化。

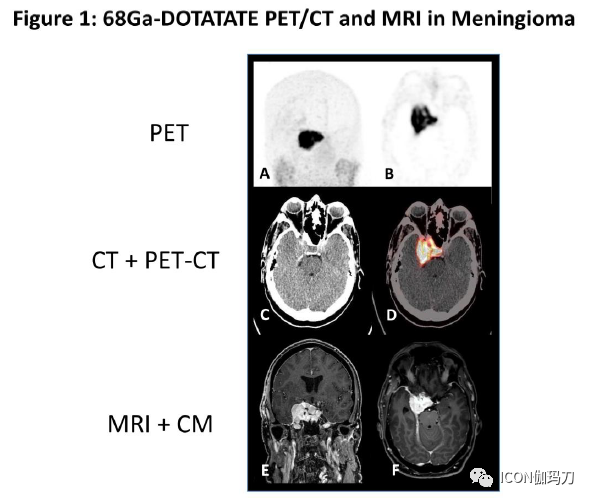
图1.注射68镓-DOTATE PET-CT,A)PET-Gamma-扫描冠状面;B)PET-Gamma-扫描轴面;C)计算机断层扫描(CT)轴面;D)融合的CT和PET扫描轴面;E)海绵窦脑膜瘤(CM)冠状面T1加权MRI,F)海绵窦脑膜瘤(CM)轴位T1加权MRI。
当需要观察治疗时,MRI是随访影像学的金标准。脑膜瘤的大小通常通过注射钆剂的T1序列来评估。关于测量,T2加权轴向MRI提供的信息可与T1钆剂相媲美,一般推荐的监测应基于钆剂增强,保持T1加权序列(良好的实践要点),但可以考虑选择对小脑膜瘤只采用T2加权成像随访。在过去的几年中,几种基于MRI的机器学习模型被用于提高脑膜瘤诊断的准确性,并可能在不久的将来在特定背景下发挥作用。
在脑膜瘤的诊断中,常规血管造影的应用已逐渐下降,但在肿瘤似乎侵入大的静脉窦(旁窦或上矢状窦)的特殊情况下,它可能提供有用的信息,而MRI血管造影提供的信息不足。3D静脉血管造影提供了关于静脉窦开放和附属的静脉引流的准确信息。
在目前的实践中,不推荐术前栓塞,并且与术后心血管并发症的风险增加相关。最近的一项随机试验发现栓塞治疗的唯一潜在好处是减少手术时间。因此,栓塞的决定应由手术团队自行决定。当外科医生无法接近供血动脉时,如岩斜脑膜瘤,它可能是有用的。栓塞的目的旨在闭塞咽升动脉的脑膜支或颈内动脉的小脑幕支。
组织病理学和分子病理学
WHO分类系统描述了15种不同的脑膜瘤亚型,其中9种属于WHO 1级,3种属于WHO 2级,1种属于WHO 3级(表1)。脑膜瘤的分级取决于有丝分裂率、对脑的侵袭(brain invasion)或特定的组织学特征。在2016年WHO分类中,脑的侵袭被引入作为不典型性脑膜瘤WHO2级的新标准,但最近的一些研究对其预后作用提出了挑战。然而,在WHO 2021分类中,脑的侵袭仍然是不典型脑膜瘤WHO 2级的独立标准。与以往的分类版本相比,现在引入分子标志物作为选择亚型的分级标准:除了组织学特征外,还可以通过检测KLF4/TRAF7突变来诊断分泌性脑膜瘤。同样,任何具有TERT启动子突变和/或CDKN2A/B纯合子缺失的脑膜瘤都被归类为WHO 3级,而不考虑间变的组织学标准(irrespective of histological criteria of anaplasia)。此外,以前与WHO 3级相关的两种亚型——横纹肌样脑膜瘤和乳头状脑膜瘤将不再单独根据亚型特异性组织学划分为特定级别。对于这两种亚型,分级现在是基于与其他脑膜瘤变异相同的异型性和间变性(atypia and anaplasia)的标准。
表1 脑膜瘤亚型的分子特征。
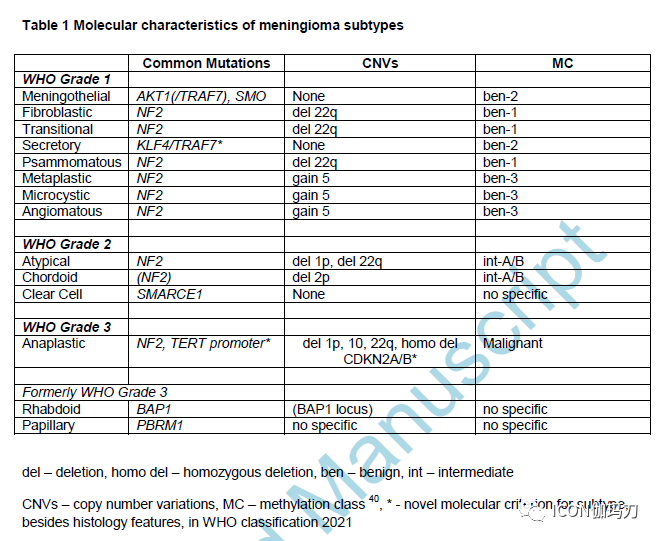
虽然对大多数患者的预后有充分的预测,分级方案仍有局限性。虽然WHO 2级脑膜瘤的患者队列通常表现出较短的肿瘤复发间隔,但有相当数量的WHO 1级脑膜瘤患者出现了意外的早期肿瘤复发。相反,一些WHO 2级脑膜瘤患者,特别是在可以完全切除的情况下,即使没有接受手术后放疗,也会经历一个漫长的惰性临床病程(long indolent clinical course)。
到目前为止,尽管在对脑膜瘤的分子理解过程中,只有少数的临床相关性标志物的出现。所有WHO级别中最常见的改变是22q染色体缺失和其他NF2等位基因突变。具有越来越强的进袭性(aggressiveness)和WHO分级,NF2突变脑膜瘤拷贝数改变累积,其中染色体臂1p和染色体10的缺失通常是最先发生的事件,CDKN2A/B纯合子缺失表明高度进袭性进程。
在WHO 1级NF2野生型脑膜瘤中,还发现了其他几种突变,总体频率如下:AKT1(高达20%)、SMO(高达11%)、KLF4(高达28%)、PIK3CA(高达7%)和TRAF7(高达40%)。AKT1和KLF4突变常与TRAF7突变联合发生,而单独的TRAF7突变较少见。尤其在颅底部位,AKT1/TRAF7和SMO突变是脑膜上皮亚型的典型突变。KLF4/TRAF7突变构成了分泌性脑膜瘤的驱动改变,可作为除分泌性颗粒外鉴别该亚型的替代标准。
由于AKT1和SMO突变与脑膜上皮性WHO 1级脑膜瘤相关,因此被认为是低复发风险的标志物。然而,目前还缺乏更大规模的研究来评估它们的独立预后价值,而且它们与脑膜上皮性脑膜瘤的相关性不如KLF4与分泌型亚型的相关性强,因此无法将它们作为分级标准。类似地,形态学的相关性提示用突变来定义亚型。然而,大多数关于这些突变的文献被搞混淆了,例如,由于某些亚型的富集(enrichment)或集中于NF2野生型脑膜瘤,因此无法对整个脑膜瘤谱的分布做出有力的结论。
与分类无关(Independent of classification),在罕见的进袭性较强的AKT1或SMO突变脑膜瘤中,这些改变可能是有希望的干预靶点,如单个病例所示。
在WHO 2级脑膜瘤中,几乎所有(97%)透明细胞脑膜瘤都带有SMARCE1突变。SMARCE1种系突变可替代NF2种系突变,易患通常发生在脊髓部位的小儿脑膜瘤。然而,关于SMARCE1种系与体细胞突变导致的透明细胞脑膜瘤的比例,没有全面的数据。在以前归属WHO分级3的亚型中,BAP1突变和缺失出现在具有横纹肌样形态的患者子集中。6例BAP1突变横纹肌样脑膜瘤患者中,2例是基于BAP1种系的改变。在乳头状脑膜瘤中,一项研究识别出PBRM1突变的富集。BAP1和PBRM1的改变是否能分别鉴别出表现出WHO 3级脑膜瘤的进袭性临床病程的横纹肌样和乳头状脑膜瘤,仍有待确定。
TERT启动子突变已被证实为高风险复发的标志,因此是新的WHO分级中WHO 3级的独立标准。TERT启动子突变可以在进展过程中演变,并局限于肿瘤的局灶性、更具进袭性的区域,因此需要对DNA进行采样提取。同样,CDKN2A/B的纯合子缺失与不依赖于组织学的不良结果相关,因此也足以作为新的WHO分类中WHO3级的标志物。
对于小儿脑膜瘤,YAP1融合可作为通常与种系相关的SMARCE1、BAP1或NF2突变的替代驱动因素。
基于DNA甲基化的脑膜瘤分型可以克服组织学标准的主观解释,以及突变的空间和纵向异质性的影响。已经提出了不同的亚群和分类算法,从而可能提供更新的WHO分类和候选基因全套测序之外的预后信息。
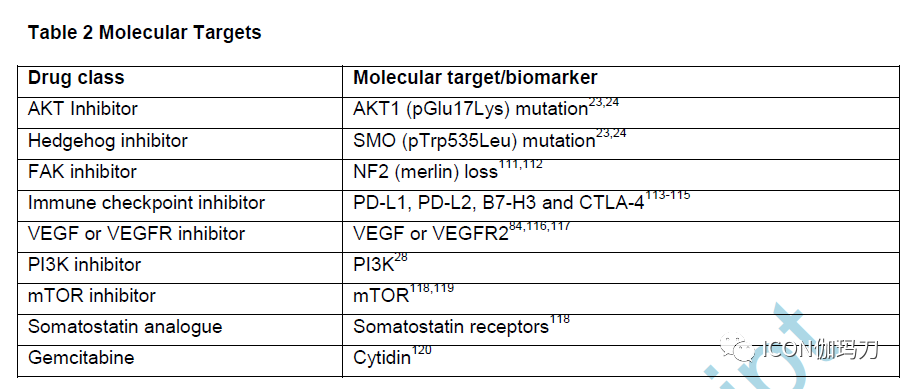
这些分子特征的数据,特别是拷贝数的改变和突变,表明未来基于分子的分类将有可能指导个体化特异性脑膜瘤治疗(表2)。因此,未来进行分子检测的肿瘤组织取样和存储应成为实践的标准。
表2分子靶点
治疗策略
观察
由于神经影像学的广泛应用,意外脑膜瘤的数目增加。在脑部MRI上一般人群的意外脑膜瘤的发生率为0.9%至1.0%。进行的一项为期5年的前瞻性研究,以确定意外脑膜瘤肿瘤生长的危险因素。在随访5年的研究期间,64例意外脑膜瘤患者中没有一例出现肿瘤相关症状,但有48例(75%)肿瘤体积增加了15%或更多。然而,超过60%的肿瘤表现出自限性生长模式,表明无症状的肿瘤可以通过连续成像安全管理,直到出现有持续的放射影像学上或有症状生长。Lee等人(2017)报道了一系列232例患者,这些患者从1997年到2013年进行了前瞻性随访,未接受治疗。59例(25.4%)肿瘤生长较快。肿瘤大小(比值比每cm3 1.07,p=0.000)、无钙化(比值比3.87,p=0.004)、瘤周水肿(比值比2.74,p=0.025)、T2加权MRI高信号或等信号(比值比3.76,p=0.049)是肿瘤生长速率的预测因子。作者建议采用一种加权评分系统来预测未治疗脑膜瘤患者肿瘤快速生长的具体概率。是否需要对每个意外脑膜瘤患者进行长期随访是有争议的。Islim等人(2020)研发出一种预后模型,作为意外无症状脑膜瘤患者的个体化监测方案。通过结合患者年龄、表现状态、并存疾病(co-morbidities)和MRI特征(脑膜瘤高信号、瘤周水肿、接近神经血管结构、大小)的数据,将患者分为低、中、高风险的生长和进展,可以制定个体化监测策略,计算公式可以免费使用(https://www.impact-meningioma.com)。Moreau等人(2020)研发出有助于脑膜瘤诊断和预后的方法和实用应用程序。目前,根据共识,对于疑似脑膜瘤或WHO 1级脑膜瘤,建议5年每年进行MRI扫描。此后,间隔可以加倍(良好的实践要点)。
手术
大多数有症状或扩大的脑膜瘤的首要治疗方法是手术。目前还没有比较手术治疗脑膜瘤与其他治疗方法的随机试验。关于手术作为单一治疗的有效性的证据来自于医疗机构的病例系列,确定了切除范围(EOR)是一个重要的预后因素。这通方面常仍然使用Simpson分类。然而,在临床试验中,切除范围(EOR)通常被定义为大体总全切除(即无残余实体肿瘤)或次全切除。这一定义已被欧洲癌症研究和治疗组织(EORTC)和放射治疗肿瘤组(RTOG)等研究组织采用。
脑膜瘤手术的基本原则是进行低并发症发生率和保护神经功能最大限度的安全切除。虽然目的是大体全切除(所有累及到的硬脑膜和骨),但切除范围(EOR)取决于肿瘤的位置、一致性、大小和邻近或累及关键的神经血管结构。虽然切除范围(EOR)是唯一可改变的复发风险因素,但努力实现全切除不应该是以神经系统或认知功能为代价。当不能切除时,应试图计划进行次全切除以保护神经功能。残留的脑膜瘤可以随后监测或采用术后适形分割放疗或立体定向放射外科治疗。
成功的手术可以达到两个目标——缓解神经症状和肿块占位效应,并为诊断提供组织。应在手术前与患者充分讨论手术风险,包括特定部位的风险和更普遍的风险,如癫痫发作和脑积水。仔细的术前计划,留意神经血管解剖,将最大限度地提高手术成功和减少并发症发生率。需要特别注意的是神经认知障碍,这可能存在于很大比例的患者中。手术可以缓解。另一方面,术后神经认知障碍是一个重大的手术风险。
应常规使用图像引导,并允许将多个数据集集成到手术计划中,包括骨内脑膜瘤(intra-osseous meningioma)的DOTATATE PET成像。术中成像可用于新入路,如自适应性混合手术(adaptive hybrid surgery),有意留下小体积残余脑膜瘤,可通过术后立体定向放射外科治疗。术中神经生理监测,如面神经和脑干诱发电位,可能有助于减少神经系统障碍。微创和内镜技术的使用已得到评估。一般来说,法在前颅底肿瘤的治疗中,这些方并不能显示出其优越性,使开颅术成为切除这些肿瘤的有效选择。
脊柱脑膜瘤比颅内脑膜瘤要罕见得多,然而,适用同样的手术原则。大多数数据支持以大体全切除为目标的策略,即使对老年患者也是如此。由于复发率为1.3-14.7%,医疗机构病例系列支持争取大体全切除的策略。决定对脊柱脑膜瘤进行手术而不是观察,应该权衡肿瘤切除的好处和手术风险。
放射外科
立体定向放射外科(SRS)已被确定为老年或危重患者的小肿瘤在界限清楚的情况下的一种替代手术治疗患者。SRS治疗后直径小于或等于3cm的小体积颅内脑膜瘤的局部控制与Simpson I级切除术相当。
两组回顾性研究发现,SRS或大分割放疗后肿瘤大小的缩小可以预测5年和10年后的长期肿瘤控制。使用13Gy以上剂量的10年无复发生存率分别为93.4%和95.7%。
颅底脑膜瘤治疗的主要问题是颅神经功能。因此,次全手术和SRS联合治疗的概念被越来越多地使用。我们对150例接受不同部位颅底脑膜瘤切除术和SRS治疗的患者进行了一项基于登记的分析,探讨了颅神经结局。19%的患者颅神经功能在SRS治疗后得到改善,10%的患者在SRS治疗后10年出现加重(deterioration)。随着时间的推移,1年后加重率为3.5%,3年后加重率为5.5%,5年后加重率为7%。
在高度精确的放射治疗领域,为了保留大体积肿瘤患者的颅神经功能,分割放射外科的概念在过去几年中得到了发展。图像引导,无框架技术促使有立体定向精度的多次治疗步骤。在一些研究中,这一原理已用于颅底脑膜瘤,特别是视神经周围肿瘤。通常使用两至5次分割,每次分割的剂量为4至10Gy,因此总剂量为18至25Gy。利用三个中心的汇总数据,比较了分割立体定向RT(中位数33次)和基于射波刀的大分割放射外科(中位数5次),发现在局部控制和毒性方面没有差异,因此短期大分割放射外科是一个方便的选择。
脊柱脑膜瘤的放射外科治疗的资料很少,可以采用单次剂量放射外科治疗或大分割的方式。
分割外照射放疗(RT)
分割外照射治疗仍然是脑膜瘤管理治疗措施中一个重要的组成部分。对于不能安全接受手术的脑膜瘤患者,或手术不完全切除后的患者,过去3年发表的几项大型回顾性研究证实了目前的EANO指南关于使用分割放疗(RT)所给出的III级证据,以及B和C级建议。从美国国家癌症数据库获得的从2004年到2014年7811例WHO2级患者和1936例WHO3级患者脑膜瘤接受手术切除和/或放疗(RT)的系列研究,2级脑膜瘤患者的5年总体生存率是75.9%,3级脑膜瘤患者的5年总体生存率是55.4%(P<0.0001)。在2级脑膜瘤患者中,大体全切除和术后分级放疗是生存改善的独立预测因素。
RTOG和EORTC已经发表了两个前瞻性II期试验的结果。NRG肿瘤/RTOG 0539试验的第一份报告显示复发1级或接受54Gy,30次分割调强放疗或3维(D)适形放疗(RT)的分割放疗(RT)治疗的新诊断大体全切除术后2级肿瘤等中间风险脑膜瘤患者的初始结果。主要终点为48例完全可评估患者,3年无进展生存期(PFS)为93.8%。3年总体生存率(OS)和局部失效率分别为96%和4.1%。接受大体全切除术的WHO 1级肿瘤复发患者和WHO 2级肿瘤患者的预后无显著差异。不良事件仅限于1级和2级。在同一试验的第二份临床结果报告中,Rogers等人显示,53例定义为新的或复发的WHO 3级脑膜瘤或任何切除范围的复发的WHO 2级脑膜瘤,或新诊断的WHO 2级肿瘤的高风险脑膜瘤患者接受IMRT治疗(60 Gy/30次分割),中位随访4.0年,3年的无进展生存率(PFS)为58.8%,局部控制率为68.9%,总体生存率(OS)为78.6%。约40%的患者发生了合并急性和晚期不良事件,CTCAE分级为1至3级,除了一例单一的与坏死相关的死亡。
使用相同的3年无进展生存率(PFS)>70为主要终点;在EORTC 22042-26042 II期研究中,有56例新诊断的WHO 2级脑膜瘤患者接受了大体全切除后再进行分割放疗得到评估。估计的3年无进展生存率(PFS)、总体生存率(OS)和局部失败率分别为88.7%、98%和14.3%,14%的患者观察到3级或以上的晚期毒性。值得注意的是,与NGR/RTOG试验相比,该试验中积累的患者接受了较高剂量的辐射治疗,以2.0Gy分割放射60Gy。
美国和欧洲的试验均表明,在毒性可接受的中、高风险脑膜瘤患者中,分割放疗具有潜在的益处;然而,早期辅助放疗是否能降低WHO 2级脑膜瘤全手术切除后肿瘤复发的风险,这个问题仍然没有答案。此外,在DNA甲基化和分子谱分析领域,可以根据临床病理特征预测患者的个体预后,从而预测复发的可能性,并识别可以从辅助治疗中获益的高危肿瘤。使用放疗可以避免进一步的外科手术,但必须权衡长期毒性的潜在风险,包括但不限于神经认知功能障碍、垂体功能减退和继发性、辐射诱导的肿瘤。为这些病人III期组间试验(ROAM/ EORTC 1308,ISRCTN71502099)在2016年被激活,在观察和辅助RT之间随机化,这个活跃的研究有190名患者的累积目标(accrual target),目前超过60%的病人在英国,爱尔兰,西班牙,瑞士,意大利,比利时,法国和澳大利亚/新西兰累积。主要结局指标是无进展生存率(PFS)(即从MR上I得到肿瘤复发证据的时间),次要结局指标包括评估放疗的毒性、生活质量、神经认知功能、进行二线治疗的时间、总体生存率(OS)和获得的每质量校正生命年增量成本(QALY)。美国目前正在招募一项类似的试验,名为NRG-BN003 (NCT03180268)。
利用美国国家癌症数据库,最近的一篇综述论述了任何类型的放射治疗在脊柱脑膜瘤中的作用。在2004-2015年10458例脊柱脑膜瘤患者中,268例接受过任何类型的放疗;131例患者接受手术加放射治疗,137例患者仅接受放射治疗(其中61%为放射外科)。大的肿瘤大小和“交界性”(“borderline”)或“恶性”组织学与增加使用RT相关。似乎与总体生存期没有关联,但在交界性和“恶性”肿瘤亚群中,放射治疗(RT)与死亡率降低相关。
药物治疗
脑膜瘤药物治疗的作用仍然不明确,没有绝对的对照临床试验以建立合理的建议(there are no positive controlled clinical trials to base sound recommendations on. )。然而,对于手术切除或放疗不再可行的患者,通常考虑对脑膜瘤进行全身补救性治疗(systemic salvage therapy)。经典的细胞毒性药物通常不具有有效性。在EORTC 1320试验中,对于局部治疗方案已用尽的WHO2级或3级肿瘤患者,也可以发现所使用的曲贝替定(trabectidin)没有优于医生最佳选择。偶有报道脑膜瘤对药物的部分反应,特别是使用多激酶抑制剂的。此外,使用贝伐单抗可以减缓脑膜瘤的生长动力学,这表明就一般而言,靶向VEGF和其他激酶依赖通路的全身系统治疗可能是有用的。然而,大多数现有研究的解释受到几个因素的限制,特别是患者的数目少,大多数研究的回顾性设计,患者群体与肿瘤类型和既往治疗的异质性,缺乏比较治疗组或可靠的历史基准有效参数,以及缺乏标准化的应答标准。一些反复出现的分子异常表明可能对特定抑制剂敏感,但尚未完成脑膜瘤靶向治疗的临床试验。
WHO 1级脑膜瘤
羟基脲(Hydroxyurea)、替莫唑胺、伊立替康(irinotecan)、干扰素-α、善宁(sandostatin)LAR、帕瑞肽LAR、伊马替尼(imatinib)、厄洛替尼(erlotinib)和吉非替尼(gefitinib)已经在手术切除和放疗失败的WHO 1级脑膜瘤中进行了回顾性和单臂II期研究,没有相关有效性。在一项随机III期试验中,米非司酮(gefitinib)未能显示无失效或总体生存的优势。现有研究中的6个月无进展生存率(PFS-6)和总体生存期(OS)分别为0%至67%和7至13个月。没有一种研究药物显示出明显的临床相关有效性,足以推荐其作为常规临床使用。如果有蛋白激酶AKT抑制剂,可考虑用于AKTE17K突变脑膜瘤患者。
WHO 2级和3级脑膜瘤
多种药物包括羟脲、环磷酰胺/阿霉素/长春新碱(cycophosphamide/adriamycin/vincristine)化疗、干扰素-α、醋酸甲孕酮(megestrol acetate)、醋酸甲羟孕酮(medroxy-progesterone acetate)、奥曲肽、善宁LAR、帕曲肽LAR、伊马替尼、厄洛替尼、吉非替尼、瓦他拉尼(vatalanib)、舒尼替尼(sunitinib)和贝伐单抗在WHO 2级和3级脑膜瘤患者的回顾性研究和小型前瞻性研究中,已经进行了评估。对于术后或放疗后复发或进展的患者,8个月无进展生存率(PFS-6)从0%到64%,中位总体生存期(OS)从6个月到33个月。最有希望的结果被报道为抗血管生成化合物,包括贝伐单抗、瓦他拉尼和舒尼替尼。然而,这些来自非对照研究的结果需要在前瞻性对照试验中得到证实,然后才能推荐在WHO2级和3级脑膜瘤患者中临床使用这些化合物。
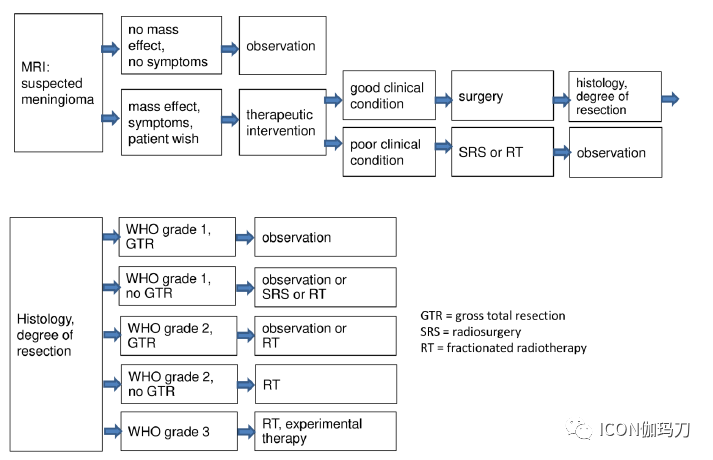
图2中显示治疗算法的概述。
图2:WHO组织1-3级脑膜瘤的治疗管理建议。
![]()




