《Pituitary》 杂志 2021年6月26日在线发表意大利University of Padova的Filippo Ceccato , Laura Lizzul, Giacomo Voltan,等撰写的《阿那曲唑作为对卡麦角林耐药的分泌泌乳素的垂体腺瘤的补充治疗:男性患者的真实经验Anastrozole as add-on therapy for cabergoline-resistant prolactin-secreting pituitary adenomas: real-life experience in male patients 》(doi: 10.1007/s11102-021-01165-0.)。


引言
分泌泌乳素的腺瘤(PRLoma)可以表现为大的侵袭性肿瘤,伴有细胞增殖标志物的增加。一线治疗方法是多巴胺激动剂(DAs)治疗;然而,已有报道尤其是男性患者存在对多巴胺激动剂的耐药。雌激素诱导泌乳素细胞复制和分泌PRL:已在少数患者中报道过使用抗雌激素治疗分泌泌乳素的腺瘤(PRLoma)患者。我们报道使用芳香化酶抑制剂(the aromatase inhibitor)阿那曲唑 (anastrozole,ANA) 作为补充疗法(add-on therapy)治疗对DA耐药的男性PRLoma患者的经验。
分泌泌乳素(PRL)的腺瘤(PRLomas)是最常见的垂体腺瘤。通常,它们表现出良性的临床过程,并对多巴胺激动剂(DA)治疗,尤其是卡麦角林(CAB)治疗,在PRL分泌、性腺功能恢复和体积缩小方面有反应,特别是在治疗后短时间内PRL水平为≦1 μg/L。一些患者即使在停药后也能获得持续的缓解。然而,10%的患者存在对多巴胺激动剂的耐药性,定义为未能使PRL水平正常化或达到>50%的肿瘤体积缩小。在男性中,PRLomas的发生率几乎是女性的10倍,更常见的是大腺瘤,具有较高的PRL水平(>1000 μg/L),具有进袭性行为和对多巴胺激动剂的耐药。由于这些方面,2017年世界卫生组织(WHO)将男性泌乳素瘤(prolomas)归类为进袭性垂体腺瘤的一种变体。对于有高剂量DAs治疗耐药的部分进袭型腺瘤,治疗是个难题:在手术或放疗失败后,最近有人建议采用生长抑素类似物(奥曲肽或帕瑞肽)、酪氨酸激酶抑制剂(拉帕替尼,一种口服表皮生长因子受体抑制剂)或烷基化药物化疗(替莫唑胺)治疗。
尚不清楚,性别差异是否反映诊断被延误或有不同的细胞发病机制。PRL的合成和分泌受雌激素、促甲状腺激素释放激素、表皮生长因子和多巴胺的控制。PRL与性激素的相互作用是复杂的:雌激素通过垂体肿瘤转化基因(PTTG)诱导泌乳素细胞复制;抗雌激素治疗可以在切除卵巢的大鼠中逆转它,提示选择性抗雌激素治疗在垂体肿瘤中的作用。Munemura等的研究表明,在大鼠中,雌激素通过解偶联G蛋白的多巴胺受体,对PRL的分泌有刺激作用。在人类中,类似的发现也被一名男性到女性变性患者在接受雌激素治疗期间有泌乳素腺瘤(PRLoma)的生长所证实。此外,睾酮可以芳香化成雌二醇(be aromatized to estradiol),使男性肿瘤在细胞增殖方面具有优势。在男性中,有在对多巴胺激动剂耐药的进袭性泌乳素腺瘤中存在较低的雌激素受体表达的报道。
到目前为止,尝试试用一些选择性雌激素受体调节剂(SERMs),已经得到描述,但没有很好的结果。芳香化酶抑制剂(ARIs)可抑制睾酮向雌二醇的转化,并可在泌乳素细胞增殖中发挥作用。2002年,一名男性PRLoma患者接受CAB治疗后,PRL进一步降低,与非甾体性ARI 阿那曲唑(anastrozole ,ANA)相关。Heidari等人最近报道了另一例接受患者芳香化酶抑制剂(ARIs)来曲唑(letrozole),结果相似。考虑到这些单独观察到的在男性患者中采用ARIs和DAs联合治疗所发挥的协同作用,我们分享了对4例男性患者长期采用CAB + ANA治疗的经验。
材料和方法
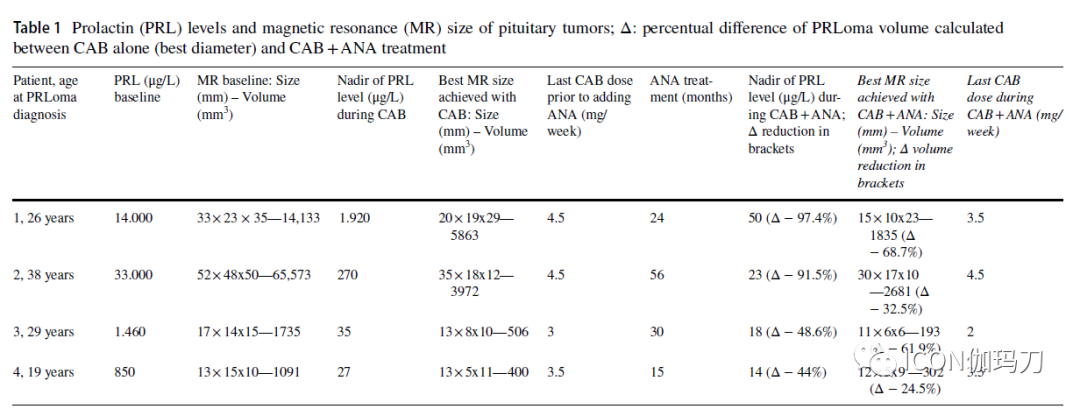
我们描述了4例男性PRLoma(中位直径26mm, PRL 7730 μg/L),诊断时年龄26、38、29和19岁。他们对卡麦角林(CAB, >2 mg/周)耐药。将阿那曲唑(ANA) 1 mg/天补充到卡麦角林(CAB)的最大耐受剂量中,持续至少1年。在基线时、CAB + ANA联合治疗6个月后及之后每12个月进行磁共振检查。
结果
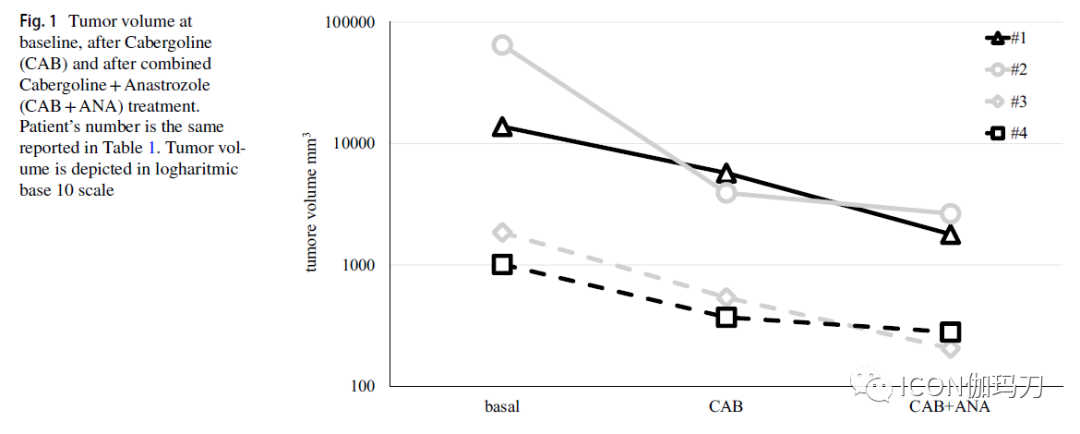
所有患者在接受CAB + ANA后,PRL水平均下降(平均- 70%,范围- 44/- 97%),1例PRL水平达到正常化。所有患者的肿瘤大小都缩小(平均- 47%,范围- 24.5/- 68%)。没有严重的不良反应的报告,已观察到两例有中度体重的增加。
讨论
对有多巴胺激动剂(DA)耐药的泌乳素腺瘤(PRLoma)患者的治疗是让人头疼的。在一般情况下,DA治疗,被推荐为主要的治疗,在高达80%的患者中达到生化缓解。神经外科不仅适用于进袭性(aggressive)或大的肿瘤,也适用于非侵袭性腺瘤,因为神经外科有能力实现持续缓解。然而,垂体手术后的并发症(垂体功能低下、感染和脑脊液漏)限制了其指证,在某些患者中,不能完全切除腺瘤,尤其是有海绵窦侵袭时。
已经提出几个定义来描述对DAs的耐药,其中一个被广泛接受的是指采用2 mg/周的卡麦角林(CAB)治疗下,未能使PRL水平正常化,并减少肿瘤体积(至少50%)。在这种情况下,最常见的临床管理是提供经蝶手术(TNS)或如果能耐受增加DA的剂量。
2000年首次报道了一例年轻男性患者使用阿那曲唑(ANA)治疗对DA耐药的巨大PRLoma。起先使用溴隐汀后(PRL分泌的结果不变,无腺瘤缩小),开始CAB治疗并增加至21mg /周,实现部分内分泌控制。由于PRL降低后性腺功能减退没有恢复,我们尝试了3次睾酮替代治疗,观察到PRL水平升高。因此,我们开始了选择性芳香化酶抑制剂(ARIs) (阿那曲唑ANA, 1 mg/ 天)治疗,并延长到54个月,实现了PRL水平的下降和CAB剂量的逐步减少(至5.5 mg/周)。随后,发表了另一个病例报告,描述了来曲唑(letrozole)(2.5 mg/天)作为溴隐汀和睾酮+ hCG(人绒毛膜促性腺激素)的补充治疗,患者为36岁男性,有对多巴胺激动剂耐药的泌乳素瘤,伴有中枢性腺功能减退和不育症。经过32个月的联合治疗,PRL下降了75%,精子计数提高导致自然妊娠。这一证据促使我们在治疗不成功或患者拒绝神经外科手术后,选择对DA治疗耐药性的大/巨泌乳素腺瘤(PRLomas)男性患者,提供一种联合使用CAB和ANA的方法。我们报告了4例患者的经验,他们接受联合CAB(最大耐受剂量)+ 1mg ANA治疗至少一年。在我们的系列研究中,我们观察到对CAB + ANA的广泛反应(PRL分泌从-44%到- 97%,平均-70%);1例患者PRL水平完全正常化。在以前发表的病例报告中,未见PRL水平正常化的报道。考虑到肿瘤体积,平均缩小47%(缩小范围从-25%到-69%)。对于其他垂体腺瘤患者(如分泌GH的),有至少≧20%的肿瘤体积缩小被认为是有效终点。鉴于在对DA敏感的患者中,CAB对分泌PRL大腺瘤的典型减少通常接近60%,我们的经验显示了有希望的结果,并为对DA耐药患者的前瞻性研究铺平了道路。在我们的系列中,我们没有观察到对CAB的完全耐药;然而,在所有患者中,最高耐受剂量的CAB (范围3 - 5 mg/周)只能实现PRL水平的亚正常化和肿瘤负荷的轻度降低。联合ANA使2例患者(患者1开始使用较低的剂量,患者2在随访中减少了剂量)的CAB剂量减少(1 mg/周),并增加了治疗依从性。大且有进袭性的泌乳素瘤(PRLomas)的男女比例为9:1,因此我们至少可以考虑对手术缓解可能性降低的腺瘤进行联合治疗。
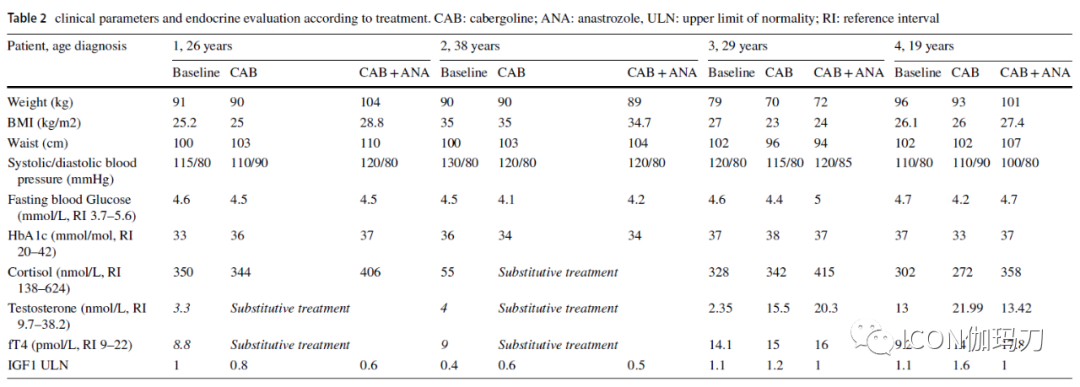
在之前的第一例报道中,睾酮替代疗法(通过芳香化雌二醇)可以促进PRL水平的上升或腺瘤的生长。患者#1和#2表现为中枢性性腺功能减退(继发于手术并有PRL水平升高);他们的睾酮水平保持在正常范围的下限,使用经皮注射剂量足以恢复性功能。患者3如预期的,在PRL降低后睾酮水平正常。最近有报道称,ARIs可作为中枢性性腺功能减退症患者的超适应证治疗,尤其是在睾酮治疗不能作为替代治疗(保留生育能力、前列腺癌、红细胞增多症、血小板增多症和严重心血管疾病)的情况下。然而,无论是在性腺功能正常的患者,还是在2例术后性腺功能减退的患者(经皮睾酮治疗)中,我们没有观察到在ANA治疗后雄激素水平显著升高。在CAB + ANA治疗期间,睾酮替代剂量没有改变。两名性腺正常的患者的促性腺激素水平在ANA治疗后没有明显变化。
在我们的系列中,高剂量CAB治疗(至少>2毫克/周)是一个选择标准,因此DA相关的副作用是一个值得关注的问题。体位性低血压在麦角洐生物DA中并不少见,4例患者中有2例限制了高剂量CAB的使用。我们没有观察到任何新起病的心脏瓣膜病(使用CAB下,由5HT2B受体介导的的三尖瓣反流的发生率增加)或冲动控制障碍和性欲亢进(更常见于男性,特别是当前吸烟者或睾酮水平高的患者)。ANA耐受性良好,无常见的急性副作用(如恶心、头痛、关节痛、肝功能标志物改变)。在基线、CAB治疗期间和CAB + ANA联合治疗后评估垂体功能。我们没有观察到新发病的垂体功能低下或对替代治疗的修改(a modification in the substitutive treatment)。在我们的研究中,我们没有观察到在联合ANA治疗后收缩压(SBP)、舒张压(DBP)和高血压(HT)的变化。在2例患者(#1和#4)中,我们记录了ANA后随着身体质量指数(BMI)的上升和腰围的增大而出现的合理体重增加。在整个随访期间,所有患者的空腹血糖和糖化血红蛋白(Hb1Ac)水平均保持正常。在研究过程中,脂质谱没有显示出一致的变化。我们只研究男性的CAB + ANA关联;尽管如此,ARI也被用于治疗雌激素受体阳性的绝经后乳腺癌女性,具有众所周知的安全性:关节痛、肌肉疼痛和僵硬(stiffness)、瘦体重(lean bodymass)减少、情绪波动(mood swings,)、认知和执行功能下降、潮热和盗汗(hot flashes, and night sweats)。虽然进袭性泌乳素瘤(prolomas)在男性中更常见,但在绝经后的女性中也应该考虑DAs和ARIs的联合应用。
手术治疗PRLomas对于微腺瘤或鞍内大腺瘤是有效的:当大的医疗中心的外科医生实施TNS手术时,缓解率提高,并且对于年轻患者可能是一种经济有效的选择。对于大的或侵袭性腺瘤患者,术后症状-肿块或肿瘤残余引起的增高的PRL水平升高:需要高剂量CAB治疗,副作用风险增加。在我们的病例系列中,我们描述了两种不同类型的患者:#1和#2在手术失败后存在大的、侵袭性PRLoma,需要替代治疗策略以控制疾病,并(在大小和PRL分泌方面)取得了显著的结果。患者#3、#4病灶较小、侵袭性较低,且使用CAB后,PRL水平接近正常水平。他们均拒绝TNS,其中一个患者CAB不能耐受。在这些患者中,治疗决定是一个难题,我们认为应该授权垂体肿瘤卓越中心的多学科团队讨论这些病例。
雌激素对男性的矿物质代谢(mineral metabolism)和骨骼健康至关重要。雌激素决定了青春期骨伸长和骨骺闭合的加速(bone elongation at puberty and epiphyseal closure),骨骼比例和峰值骨量的实现,成年期骨量的维持,以及通过调节骨的形成和吸收与雄激素的相互作用来维持骨量(maintenance of bone mass)。在我们的研究中,我们没有观察到ARI治疗对骨质量和代谢的负面影响。我们在#2患者中观察到,自ANA开始以来,骨吸收标志物逐渐增加,脊柱x线排除椎体塌陷,DXA扫描显示骨量减少。在这种特殊情况下,我们还必须记住氢化可的松替代治疗(20mg /天)和未治疗的生长激素缺乏作为骨损伤的伴随因素。其余3例患者未出现任何骨代谢损伤:需要进一步更大的队列研究来研究长期ARI治疗对骨折风险的影响。
在肢端肥大症患者中,CAB可用于单药治疗或与生长抑素类似物相关:它是一种低成本的口服治疗,在部分患者中有效;然而,关于其疗效的证据却很少。,如最近所报道的,在我们的队列中,在CAB中加入奥曲肽LAR导致了PRL水平和腺瘤大小方面的显著反应;然而,发生肝功能异常导致中止生长抑素类似物。雌激素拮抗生长激素受体的功能,降低肝脏IGF-1的合成:口服,但不经皮,雌激素给药降低循环IGF-I。观察到的选择性雌激素受体调节剂他莫昔芬(tamoxifen)和雷洛昔芬(tamoxifen)对IGF-I的抑制似乎与口服雌激素观察到的抑制相对应:2018年报告的一项随机非盲研究称,雷洛昔芬可以降低肢端肥大症患者的血清IGF-1水平。据我们所知,在肢端肥大症患者中没有使用ARI(单独或联合CAB)的报道,因此在选定的部分患者中应该考虑使用ARI。
我们知道这项工作的一些局限性。首先,没有对照组的观察和自然的设计(spontaneous design)。其次,小的异质性队列伴垂体功能低下作为混杂因素。
总之,我们描述使用CAB和ANA联合治疗的有效方法。这种方法可以更好地控制PRL水平,缩小肿瘤大小,没有严重的不良事件。对于患有泌乳素腺瘤(PRLomas)的男性或绝经后女性,对DAs耐药,不适合或不愿意接受神经外科手术,尤其是当存在医源性垂体功能低下的高风险时,应考虑使用该药物。
结论
在多巴胺激动剂治疗中添加芳香化酶抑制剂(阿那曲唑ANA)可以改善泌乳素水平的控制和诱导肿瘤退缩。




