2020年12月接诊一例来自辽宁沈阳的3岁女性患儿(身高:106cm,体重:16kg),主诉:走路不稳1月余,进行性加重。患儿一月前无明显诱因出现走路不稳,当地医院初步诊断为“髋关节积液”行保守治疗未见明显好转。进一步检查发现颅内巨大占位性病变,遂来我院就诊。门诊查体示:神清语利,自主体位,生长发育正常,神经系统查体阴性;头颅CT示:左侧额顶枕巨大占位,室管膜瘤?头部MRI示:左侧额顶枕叶巨大不规则囊实性混杂性信号影,边界欠清晰,大小约89×110x85mm,增强扫描可见强化,室管膜瘤?PNET?
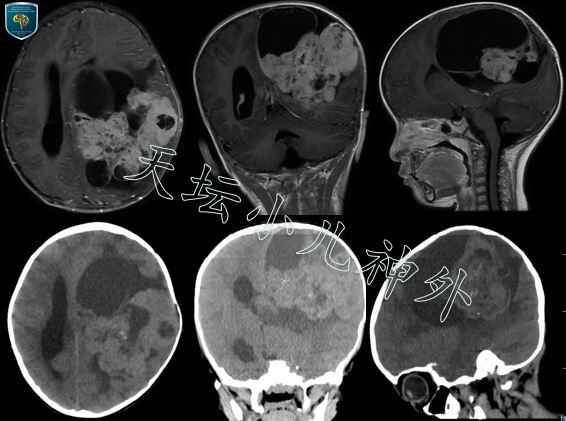
图1: 术前CT显示:左侧额顶枕巨大占位;MRI显示:左侧额顶枕叶巨大不规则囊实性混杂行信号影,边界欠清晰,增强扫描可见强化,室管膜瘤?PNET?
患儿幼小,瘤体巨大,充分交待手术风险后,完善术前检查,于2021年1月5日全麻下行左侧颞顶枕开颅肿瘤全切除术。患儿右侧卧位,神经导航引导下行边长9cm马蹄形切口,硬脑膜张力高,导航及超声定位肿瘤边界,囊腔穿刺减压后打开硬膜,见肿瘤色灰红、质地软韧不均、多囊腔、内含清亮淡黄色囊液,充分内减压后游离肿瘤囊壁,前至侧裂、后至枕叶、内至大脑镰,肿瘤与大脑镰、下矢状窦,下至小脑幕,左侧脑室开放,瘤体突入,与脑室内结构无粘连,瘤体基底位于大脑镰及三角区脉络丛,血供来源于侧裂血管、颞角、三角区脉络丛、及部分大脑后动脉分支,电凝切断血供、充分游离后肿瘤镜下全切,毗邻结构保护完好。手术顺利,术中出血约 500 ml,输异体红细胞390ml,血浆 200 ml,术后安返ICU监护。
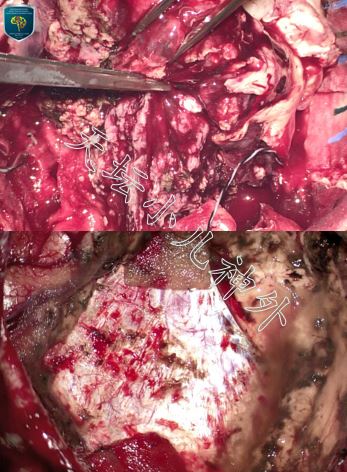
图2. 术中所见:术中见肿瘤色灰红、质地软韧不均、多囊腔,与脑室内结构无粘连,瘤体基底位于大脑镰及三角区脉络丛,血供来源于侧裂血管、颞角、三角区脉络丛、及部分大脑后动脉分支,电凝切断血供、充分游离后肿瘤镜下全切。
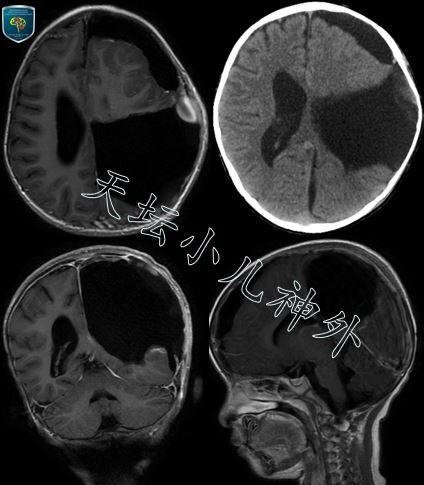
图3:术后复查头颅CT/MRI显示肿瘤切除满意。
患儿术后神清、精神好,右侧肢体肌力IV级,余神经系统查体阴性。术后病理回报示:间变性脑膜瘤(WHO Ⅲ级),形态不典型; 免疫组化:GFAP(+),Olig-2(局灶+),Ki-67(约10%,灶状50%),Syn(弱+),CD99(+),EMA(散在核旁点状+),CK(-),Fli-1(-),L1CAM(-),MyoD1(-),LCA(散在+),NeuN(-),NF(-),HMB45(-),Melan A(-),SALL4(-),SSTR-2(-),STAT6(-),INI-1(+),PR(-)。术后患儿恢复好,术后三周顺利出院,继续后续治疗。
治疗体会
儿童脑膜瘤占儿童颅内肿瘤0.4–4.6%,远低于成人脑膜瘤在中枢神经系统肿瘤中30%的占比1。其中,约60%的儿童脑膜瘤患者合并神经纤维瘤病II型(NF2)2。2017年WHO最新分型将脑膜瘤分为三级,I级:经典型,含内皮型、纤维型、过渡型(混合)、 砂粒型、血管瘤型、分泌型、微囊型、富淋巴-浆细胞型、化生型;II级:非典型,含透明细胞型、脊索瘤型; III级:间变性/恶性肿瘤,含横纹肌样型、乳头型3。
在儿童脑膜瘤中,WHO I 级占比81%,II级占比10%,III级占比9%4,5。因此,相较于成人,儿童脑膜瘤恶性发生率高达20%(WHO II-III),常合并囊性变、肉瘤变、瘤内出血,脑室内多发(可起源于脉络丛、中间帆蛛网膜细胞)、缺少“鼠尾”征,发现时往往瘤体巨大、更具侵袭性6-10。
手术全切是决定脑膜瘤患者预后的最重要因素11。若有手术残留或WHO III级的患者,及时进行术后放化疗可明显延长无进展生存期。质子治疗儿童高级别脑膜瘤已有报道,可以较好控制肿瘤复发,一定程度上提高了5年生存率。但由于技术新、病例少,还需要更多数据进行更准确的疗效分析12。针对间变性脑膜瘤(WHO III级),成人手术全切后接受放/化,5年和10年无进展生存率分别为50%和40%;5年和10年总体生存率为61%和40%13。儿童患者未有相关研究,普遍认为儿童的预后较成人更差。在基因水平,有研究表明CDKN2A和9p21染色体的联合缺失可能与高级别转化有关,复发率高、预后差14。
本例患儿瘤体巨大而症状轻微,影像学与临床表现明显不符,考虑肿瘤生长缓慢,颅压渐进增高而患儿逐步适应;瘤体与左侧脑室关系密切,首先考虑低级别室管膜瘤。但病理显示高级别脑膜瘤,Ki-67局灶高达50%,与最初判断大相径庭,确实令人吃惊。儿童脑膜瘤发病率低,间变型更为少见,本例几乎无临床症状,实属罕见。幸亏治疗及时,肿瘤手术全切,尽早进入后续治疗,以期获得良好预后。
参考文献
1. Gao X, Zhang R, Mao Y, Wang Y (2009) Childhood and juvenilemeningiomas. Childs Nerv Syst 25(12):1571–1580.
2. Halliday, D., Parry, A., & Evans, D. G. (2019). Neurofibromatosis type 2 and related disorders. Current Opinion in Oncology, 31(6), 562–567.
3.Apra, C., Peyre, M., & Kalamarides, M. (2018). Current treatment options for meningioma. Expert Review of Neurotherapeutics, 18(3), 241–249.
4. Kotecha, R. S., Junckerstorff, R. C., Lee, S., Cole, C. H., & Gottardo, N. G. (2011). Pediatric meningioma: current approaches and future direction. Journal of Neuro-Oncology, 104(1), 1–10. doi:10.1007/s11060-010-0503-3.
5.Claus EB, Bondy ML, Schildkraut JM, Wiemels JL, Wrensch M,Black PM (2005) Epidemiology of intracranial meningioma.Neurosurgery 57:1088–1095).
6. Zwerdling T, Dothage J. Meningiomas in children and adolescents. J Pediatr Hematol Oncol. 2002;24:199–204.
7. Gump WC (2015) Meningiomas of the pediatric skull base: a review. Journal of neurological surgery Part B, Skull base 76:66–73.
8. Baumgartner JE, Sorenson JM (1996) Meningioma in the pediatric population. J Neuro-Oncol 29:223–228.
9. Kobata H, Kondo A, Iwasaki K, Kusaka H, Ito H, Sawada S (1998) Chordoid meningioma in a child. Case report. J Neurosurg 88:319–323.
10. Li, Z., Li, H., Jiao, Y., Ma, J., Wang, S., Cao, Y., & Zhao, J. (2017). Clinical features and long-term outcomes of pediatric intraventricular meningiomas: data from a single neurosurgical center. Neurosurgical Review, 41(2), 525–530.
11. Masalha W, Heiland DH, Survival and Prognostic Predictors of Anaplastic Meningiomas. World Neurosurg. 2019 Nov;131:e321-e328. doi: 10.1016/j.wneu.2019.07.148.
12. Noel G, Habrand JL, Mammar H: Highly confor-mal therapy using proton component in the management of meningiomas:Preliminary experience of the Centre de Protontherapie d’Orsay.Strahlenther Onkol178:480–485, 2002.
13. Sughrue ME, Sanai N, Shangari G, et al. Outcome and survival following primary and repeat surgery for World Health Organization Grade III meningiomas. J Neurosurg 2010;113:202-9.
14. Perry A, Banerjee R, Lohse CM, Kleinschmidt-DeMasters BK, ScheithauerBW: A role for chromosome 9p21 deletions in the malignant progression ofmeningiomas and the prognosis of anaplastic meningiomas.Brain Pathol12:183–190, 2002.





