胶质母细胞瘤(WHO IV级)是中枢神经系统原发性肿瘤中最为恶性的一种类型,患者的中位生存期不到2年。即使经过标准治疗即最大程度的安全手术切除、替莫唑胺(TMZ)同步放化疗及辅助化疗,几乎所有胶质母细胞瘤患者都会在随访过程中复发,包括局部复发和少见的沿脑室系统和软脑膜的播散等。复发患者目前没有公认有效的标准治疗方案。贝伐珠单抗是一种抗血管内皮生长因子(VEGF)的单克隆抗体,可作为复发胶质母细胞瘤的治疗方案之一。免疫治疗对一些恶性肿瘤如黑色素瘤和非小细胞肺癌有显著效果。中枢神经系统长期以来被认为是免疫豁免状态,但近期研究发现中枢神经系统也有免疫系统结构及功能,开启了免疫治疗对胶质母细胞瘤治疗的探索时代。目前有多项针对复发胶质母细胞瘤的临床试验正在进行中。但是,去年Reardon等发表的第一项该领域三期临床试验(CheckMate 143)[1]文章指出,抗PD-1抗体(纳武单抗)相比于抗VEGF抗体(贝伐珠单抗)并不能显著提高复发胶质母细胞瘤患者的生存期。
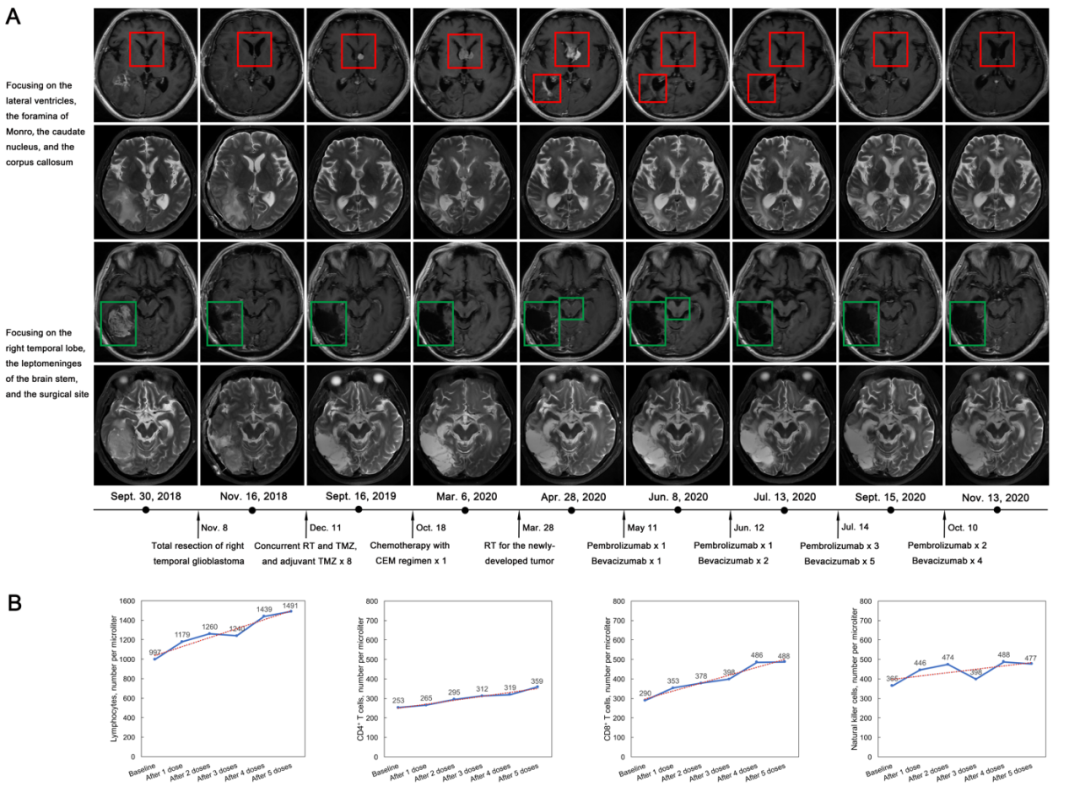
对于复发胶质母细胞瘤,单用抗PD-1免疫治疗的失败促使我们开始尝试联合应用抗PD-1和抗VEGF治疗。我们介绍一例联合应用抗PD-1(潘博丽珠)和抗VEGF(贝伐珠单抗)诱导IDH野生型、MGMT启动子非甲基化、高突变负荷、POLE基因突变的颅内多发转移的复发胶质母细胞瘤达到完全缓解的病例。患者为57岁男性,右颞叶胶质母细胞瘤接受肿瘤全切(Figure 1A),之后接受了30程共60Gy的分割放疗同步TMZ化疗及8程TMZ辅助化疗,在最后一次TMZ化疗后的复查MRI发现左侧Monro孔附近增强灶,考虑为脑室内播散转移灶。之后对患者采用卡铂、依托泊苷、甲氨蝶呤(CEM)方案化疗,但仅一程化疗后,患者因严重肺部感染而停止化疗。再次复查MRI显示增强灶继续增大,范围累及透明隔、胼胝体及左侧尾状核头,我们之后对该转移病灶进行了30Gy共15次的放疗。但是,该转移灶在放疗后仍进行性增大,且手术野周边、脑干周围软脑膜、右侧脑室后外侧壁、第四脑室后壁等处出现了新发的强化灶。我们对患者的肿瘤标本进行了二代测序发现:超高突变负荷(515.9/Mb);POLE基因14号外显子错义突变且该突变是驱动基因突变(c.1381T>C(p.Ser461Pro)),其与Bouffet等[2]报道的一致且对抗PD-1治疗反应好。既往研究显示,抗PD-1治疗对高突变负荷肿瘤的效果较好,且有POLE突变的高级别胶质瘤预后更佳[2-5],因此我们组织了MDT讨论后,开展了潘博丽珠(100mg每月一次)合用贝伐珠单抗(200mg每两周一次)的治疗。令人欣喜的是,仅1程联合治疗后,患者左侧Monro孔处肿瘤即缩小了90%;第2程联合治疗后肿瘤和颅内其他强化转移灶完全消失。患者在7个月随访中未出现新发病灶且T2/Flare像保持了稳定状态,根据iRANO标准可定义为完全缓解(CR)。随访期间未产生药物副反应。
抗PD-1治疗可以激活中枢神经系统的免疫监视机制并诱导肿瘤中免疫细胞浸润[5]。抗VEGF治疗抑制肿瘤新生血管的同时也可以缓解抗PD-1治疗引起的脑水肿。本病例中,虽然难以完全排除再次放疗以及贝伐珠单抗对CR结果的推动作用,但本结果确已证实抗PD-1联用抗VEGF疗法对高突变负荷且POLE突变的复发胶质母细胞瘤的有效性,接下来的临床试验有待进一步开展。
血脑屏障可阻止外周血免疫细胞进入中枢神经系统发挥杀灭肿瘤的效应。抗PD-1治疗可同时提升肿瘤微环境和机体中的抗肿瘤免疫反应[6]。本病例中伴随肿瘤体积减小,包括T细胞和NK细胞在内的多种外周血细胞数量持续上升(Figure 1B);另外,外周血细胞毒性CD8+T细胞的数量反超CD4+T细胞,使CD8/CD4比值最高升至1.35。外周血免疫细胞数量增加与抗肿瘤免疫效应增强是否相关需要进一步研究证实。
第一作者简介
郭晓鹏
北京协和医院神经外科
通讯作者简介
王裕
北京协和医院神经外科
北京协和医院神经外科副主任医师、硕士研究生导师,医学博士,留美博士后,中国医师协会脑胶质瘤专业委员会全国委员、中国医师协会脑胶质瘤专委会分子诊疗专业委员会委员,中国胶质瘤协作组成员、北京医学会神经外科转化医学学组委员、世界华人医师协会智慧医疗委员会委员、北京抗癌协会神经肿瘤青委会委员。主要致力于脑胶质瘤、脑转移瘤等颅内恶性肿瘤的多模态影像引导的精确神经外科手术切除,以及放疗、化疗、靶向治疗、免疫治疗、生物治疗在内的综合治疗。与此同时还擅长影像引导下综合应用立体定向技术、神经导航技术、神外机器人辅助技术进行颅内病变精确活检手术,以期最小的代价获取病理诊断,指导患者下一步治疗。目前在研多项省部级基金课题,担任国内外多本期刊的审稿专家。
团队领导简介
马文斌
北京协和医院神经外科
北京协和医院神经外科主任,主任医师,教授,博士研究生导师,中华医学会神经外科分会神经肿瘤学组委员,中国抗癌协会胶质瘤专业委员会副主任委员,北京医学奖励基金会脑转移瘤专业委员会主任委员。擅长开展恶性脑肿瘤的综合治疗,对恶性胶质瘤/转移瘤的化疗、分子靶向治疗、耐药复发及基因治疗研究等有较深入研究;在微创神经外科领域,开展影像引导下-术中电生理检测下-唤醒麻醉下重要皮层及白质纤维束功能区病变切除,并对多模式影像学融合(如PET/CT、fMRI、MRI、CT)神经导航有所心得。现任中华外科杂志通讯编委,中华神经外科杂志及中国神经精神疾病杂志审稿专家。在国外研修期间,对垂体瘤的克隆分析研究颇深,在著名杂志《CANCER》上首先报道多激素分泌性垂体泌乳素腺瘤大多数起源于单克隆,并在《Hormone Research》杂志上发表有关垂体TSH腺瘤合并增生的临床及基础研究结果;上述研究对垂体腺瘤的发生研究具有一定的指导意义,为此获日本东北医学会特别奖,获中华医学会联合主办中青年奖学金优秀论文二等奖。主持国家自然科学基金课题“自杀基因疗法治疗脑胶质瘤的实验研究”,部分成果在第三届中-日-法国际神经外科会议上宣读。负责开展恶性胶质瘤化疗的临床药物实验。在《中华神经外科杂志》等核心期刊上发表十余篇,作为编者参与编写《脑肿瘤的化学治疗》《垂体腺瘤手术图谱》《神经外科诊疗常规》《临床内分泌外科学》等,作为副主译参与翻译《神经外科手术学》《垂体腺瘤临床治疗指南》等,作为译者参加翻译《神经外科学》《威廉姆斯内分泌学》《帕金森并及运动障碍疾病的手术治疗》等。
参考文献
1.Reardon DA, Brandes AA, Omuro A, et al. Effect of nivolumab vs bevacizumab in patients with recurrent glioblastoma: the checkmate 143 phase 3 randomized clinical trial. JAMA Oncol. 2020;6(7):1003–1010.
2.Bouffet E, Larouche V, Campbell BB, et al. Immune checkpoint inhibition for hypermutant glioblastoma multiforme resulting from germline biallelic mismatch repair deficiency. J Clin Oncol. 2016;34(19):2206–2211.
3.Erson-Omay EZ, Çağlayan AO, Schultz N, et al. Somatic POLE mutations cause an ultramutated giant cell high-grade glioma subtype with better prognosis. Neuro Oncol. 2015;17(10):1356–1364.
4.Lukas RV, Rodon J, Becker K, et al. Clinical activity and safety of atezolizumab in patients with recurrent glioblastoma. J Neurooncol. 2018;140(2):317–328.
5.Johanns TM, Miller CA, Dorward IG, et al. Immunogenomics of hypermutated glioblastoma: a patient with germline POLE deficiency treated with checkpoint blockade immunotherapy. Cancer Discov. 2016;6(11):1230–1236.
6.Cloughesy TF, Mochizuki AY, Orpilla JR, et al. Neoadjuvant anti-PD-1 immunotherapy promotes a survival benefit with intratumoral and systemic immune responses in recurrent glioblastoma. Nat Med. 2019;25(3):477–486.










