本文将以具体案例的形式,呈现多模式影像对颈动脉非急性闭塞介入再通治疗策略的指导价值。
首先申明:笔者工作的机构,无MOMA和球囊指引导管近端血栓保护装置,所有颈动脉闭塞介入再通治疗均是基于远端血栓保护装置而实施。
本文由两部分组成,即案例呈现和总结讨论。限于篇幅,案例着重于呈现多模式影像评估和介入治疗经过,其他从简。
第一部分:案例呈现
【基本信息】
男,69岁。
主诉:发作性左侧肢体麻木乏力3天。
既往脑梗死,吸烟。
神经体查:未及明确阳性体征。
【术前多模式影像】
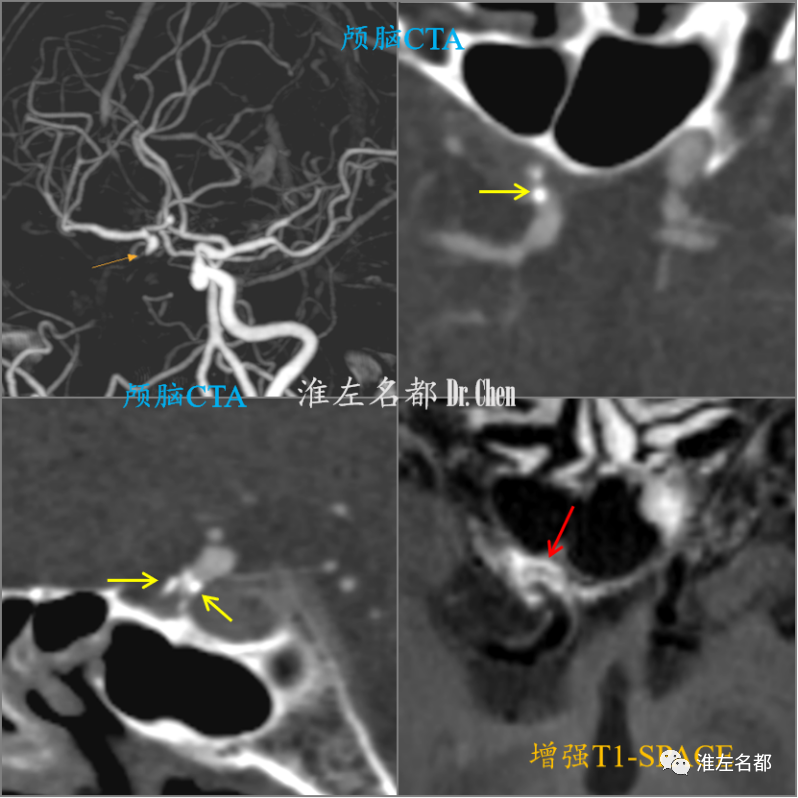
△颅脑CTA示右侧颈内动脉闭塞,闭塞远端位于床突上段(橙箭),CTA多平面重建图像于闭塞远端检测到钙化(黄箭),提示粥样硬化病变;管壁高分辨MRI(增强T1-SPACE)于右侧颈动脉闭塞远端检测到偏心强化斑块(红箭)。
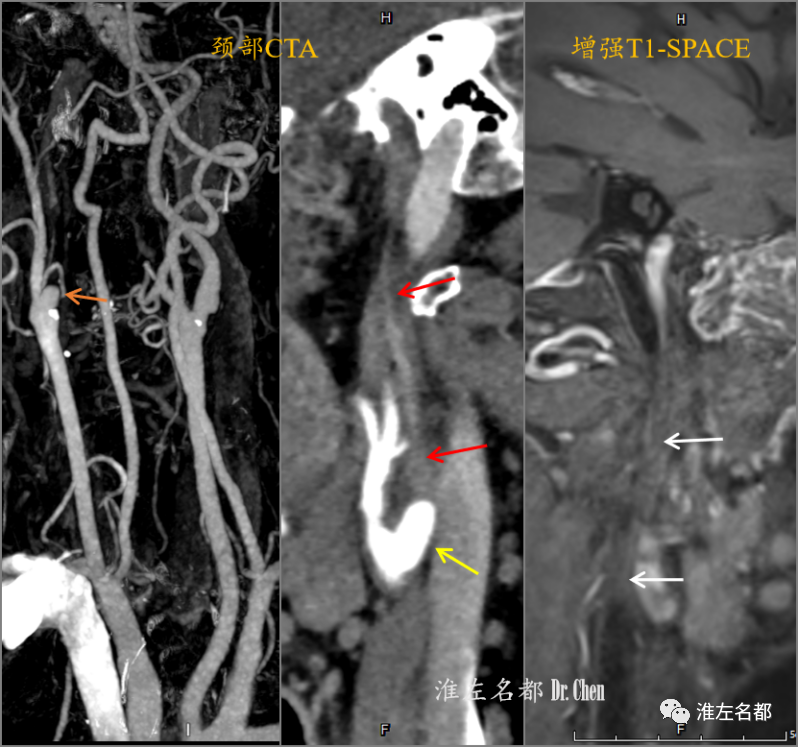
△颈部CTA示右侧颈内动脉起始部闭塞(橙箭),但多平面重建图像未能于起始部检测到低密度斑块征象(黄箭),且颅外段颈动脉血管轮廓塌陷细小(红箭);塌陷细小的颅外段闭塞颈内动脉在T1-SPACE增强序列上呈无强化的条索状低信号(白箭)。
【介入治疗经过】
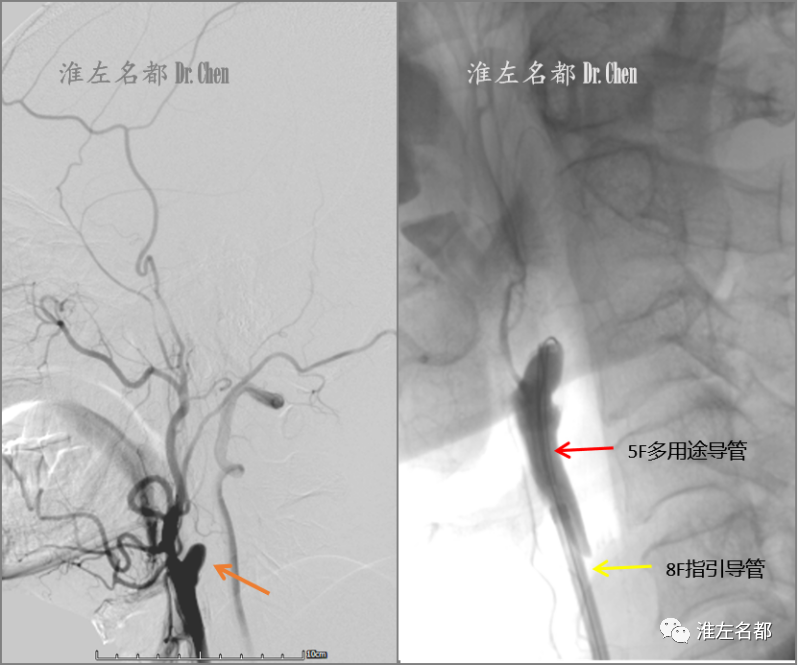
△采用同轴技术将8F指引导管头端送至右侧颈总动脉远段(黄箭);5F多用途导管(125cm,Cordis;红箭)头端抵近闭塞残端,经多用途导管推进微导丝(.014”,300cm, Command,雅培),但微导丝无法突破残端组织。
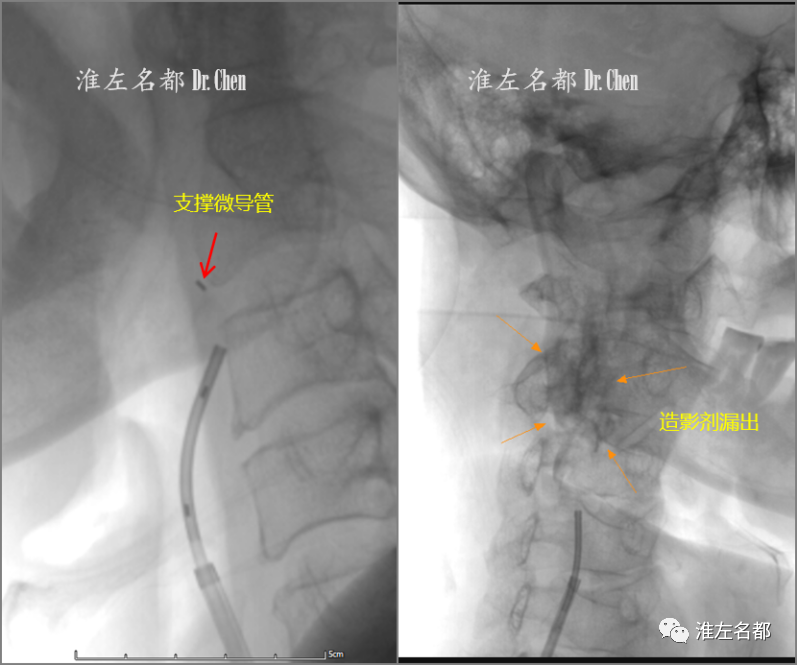
△加用支撑微导管(TrailBlazer,EV3;红箭)以增强支撑力,最终突破残端组织,但经支撑微导管推注造影剂后,造影剂弥散进入颈部结缔组织(橙箭),提示微导管头端在闭塞段颈内动脉外,故终止手术。
备注:患者术中和术后生命体征平稳,无诉颈部不适。
【基本信息】
男,52岁。
主诉:左侧肢体无力10天。
既往高血压,吸烟。
神经体查:左侧中枢性面舌瘫,左侧上、下肢轻瘫实验阳性。
【术前多模式影像】
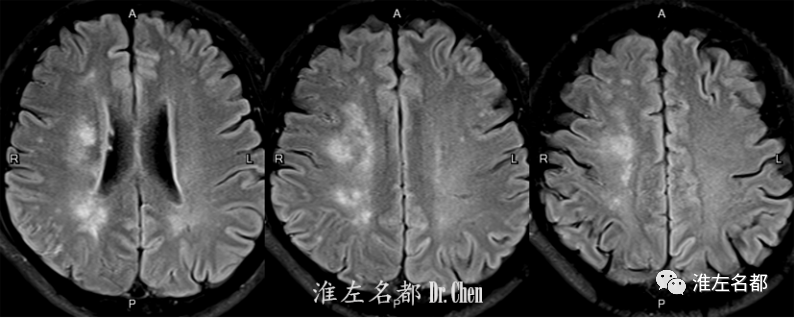
△FLAIR:右侧内部分水岭梗死。
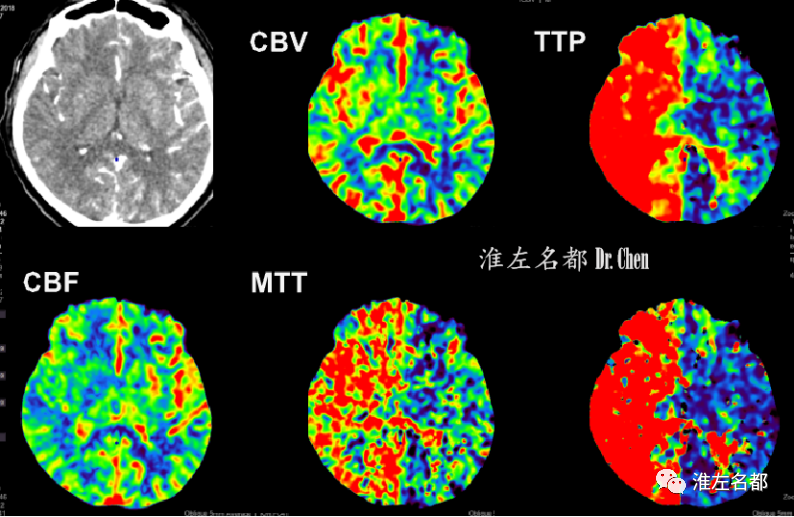
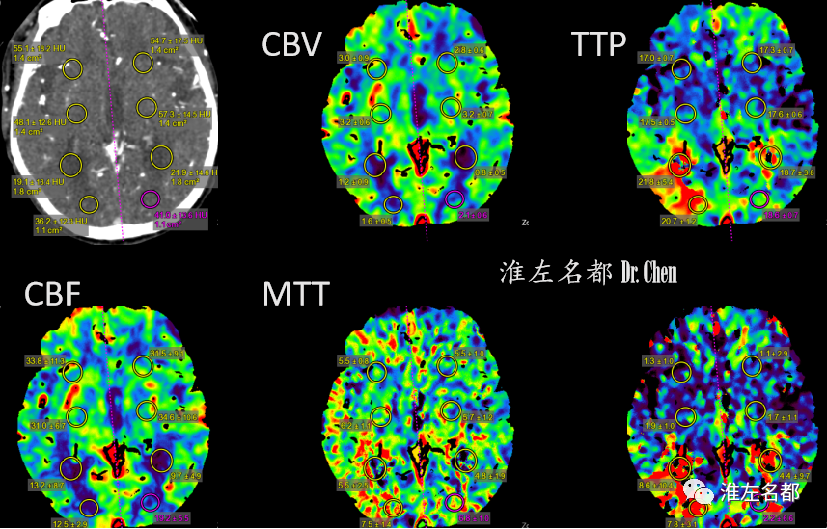
△脑CTP:右侧半球TTP显著延长,CBF较左侧降低,局部CBV较左侧增高。
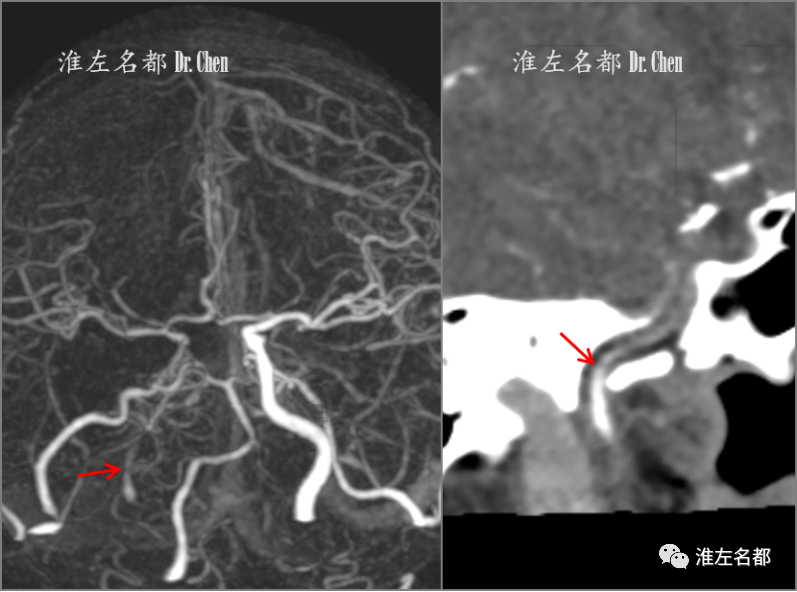
△颅脑CTA:右侧颈内动脉闭塞,并见造影剂经侧支循环逆流至岩骨段(红箭)。
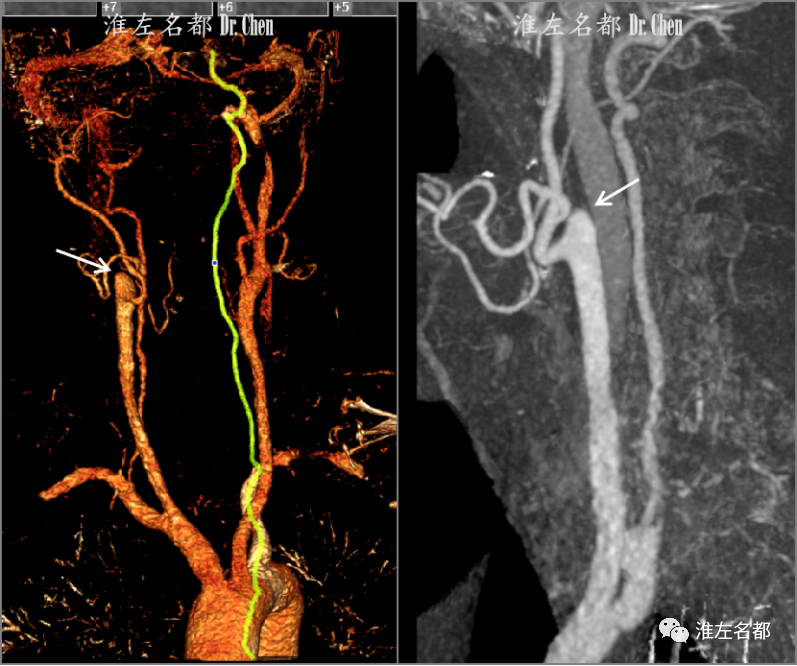
△颈部CTA:右侧颈内动脉起始部闭塞(白箭)。
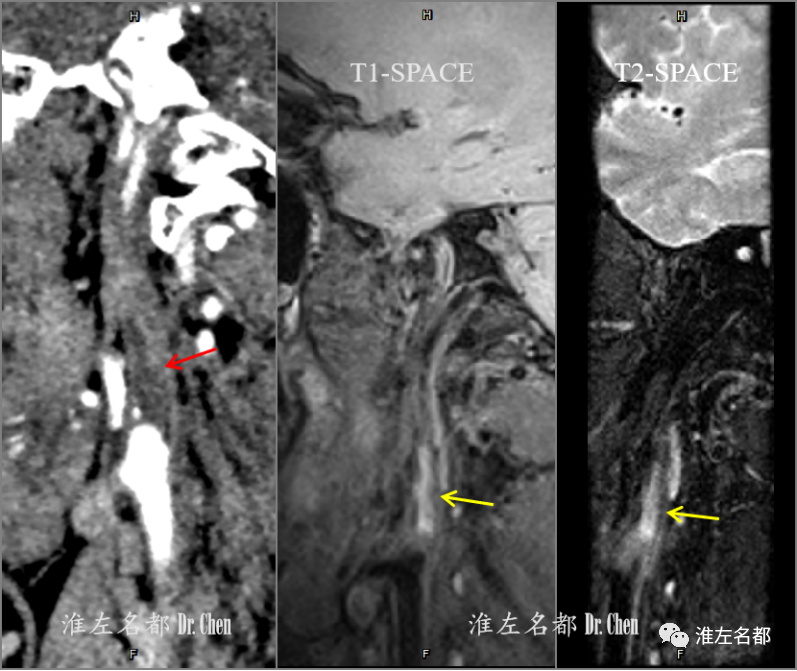
△CTA多平面重建图像:右侧颈内动脉起始部低密度斑块伴颗粒样高密度钙化(红箭);高分辨T1和T2-SPACE:右侧颈内动脉起始部斑块可见片状高信号(提示斑块内新近出血)。
【介入治疗经过】
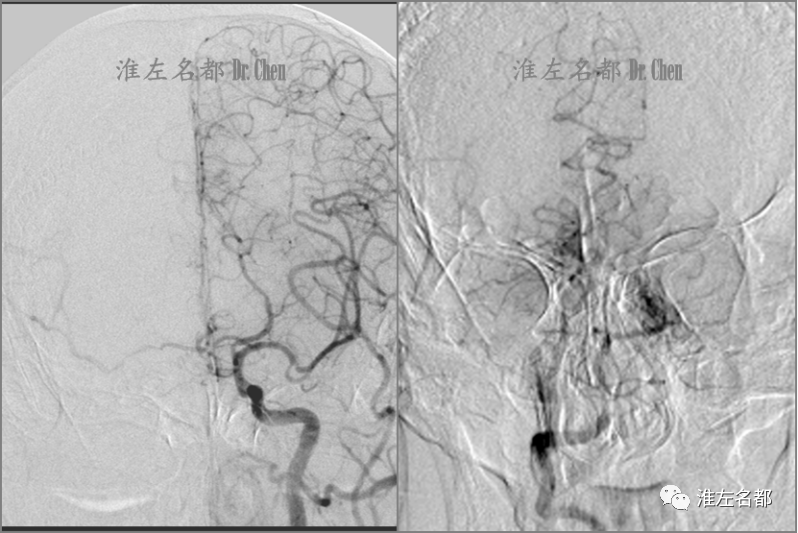
△左侧颈动脉造影:左侧大脑前动脉经前交通动脉少量代偿右侧前循环血流(左图);椎动脉造影:右侧大脑后动脉经软脑膜侧支循环部分代偿同侧前循环血流(右图)。
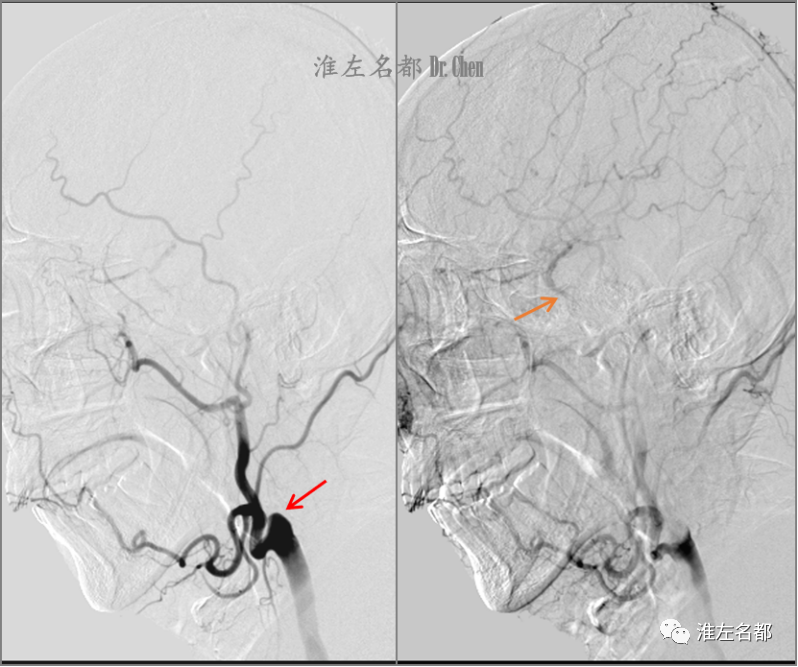
△经右侧颈总动脉造影可见右侧颈内动脉近端闭塞(红箭),同侧颈外动脉经眼动脉部分代偿闭塞远侧颈内动脉血流,并逆流至海绵窦段(橙箭)。
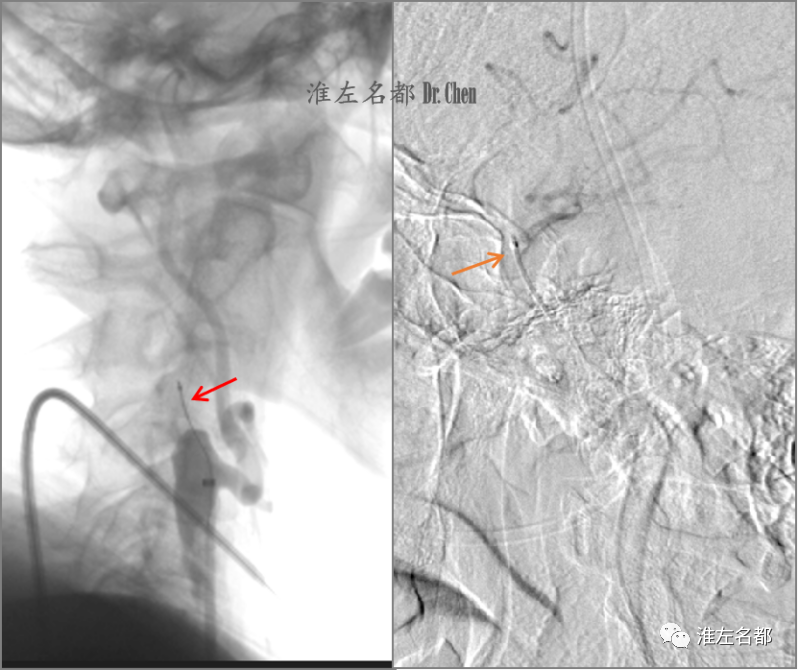
△同轴技术将6F长鞘头端送至右侧颈内动脉远端,在微导管(135cm,Renegade HI FLO 2.7-3.0,波科)配合下微导丝(.014”,300cm,Command,雅培)数次尝试后即进入并顺利通过斑块闭塞段(红箭),经微导丝将微导管头端送至海绵窦段(橙箭),造影证实位于真腔。
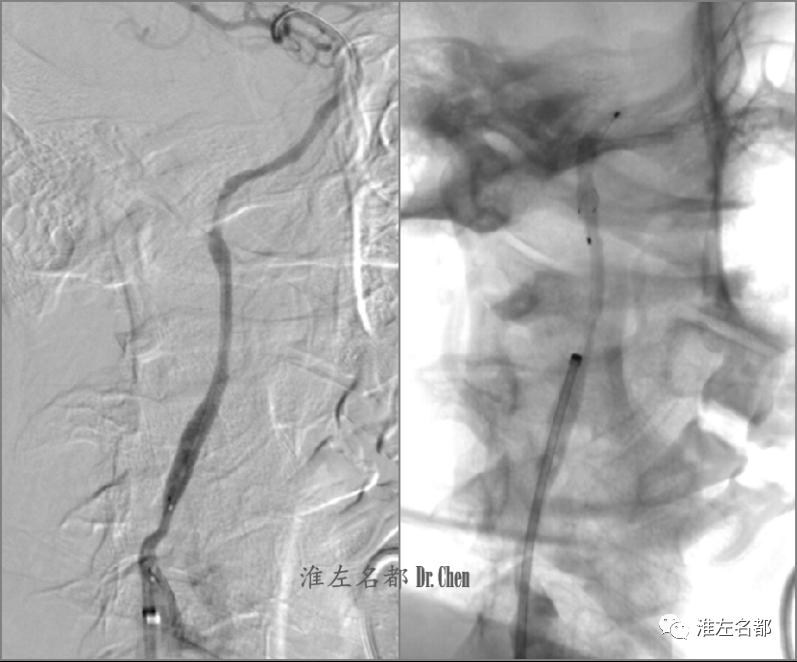
△交换导丝(.014”,300cm,Transend)头端至于右侧MCA M2,撤出微导管,以小球囊(2.0*12mm)扩张颅外段颈内动脉,造影可见右侧颈内动脉起始部狭窄,远侧管腔通畅,但轮廓显影稍不规则(左图);经微导丝于右侧颈内动脉颅外段远端释放保护伞(Spider,5.0mm)。
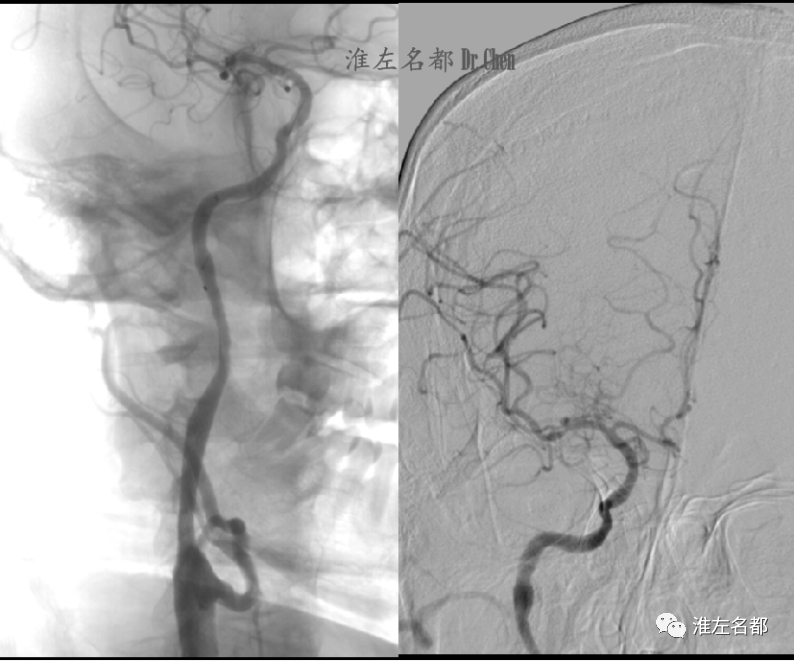
△于右侧颈内动脉狭窄处植入颈动脉支架(Wallstent,9*40mm),以5.0*20mm球囊后扩后造影示无明显残留狭窄(左图);颅内分支动脉显影良好(右图)。
【术后影像复查】
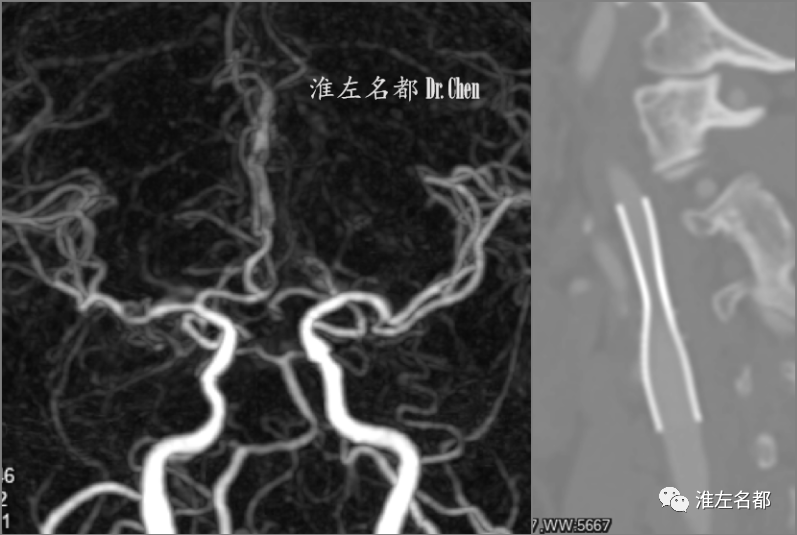
△术后第二日,复查CTA:右侧颅内前循环显影良好;右侧颈内动脉支架展开形态佳,管腔通畅。

△术后第二日,复查脑CTP:双侧半球灌注基本对称。
【基本信息】
男,51岁。
主诉:左侧肢体乏力5个月。
既往糖尿病,吸烟和饮酒。
神经体查:左侧中枢性面舌瘫,左上、下肢肌力5级-,左侧痛触觉较右侧减退。
【术前多模式影像】

△FLAIR:右侧额叶陈旧性梗死。
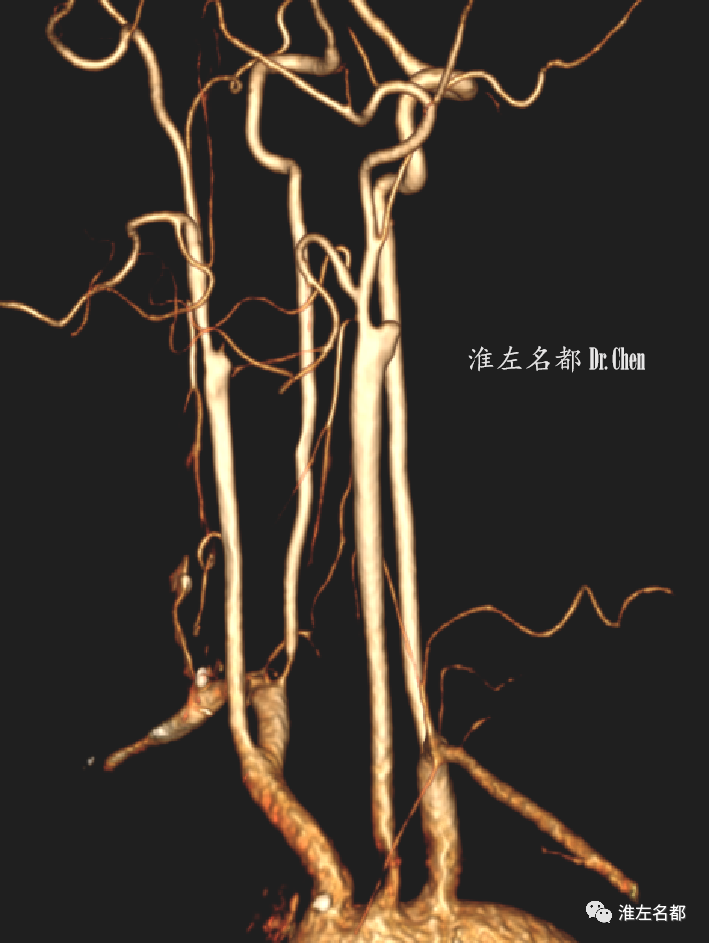
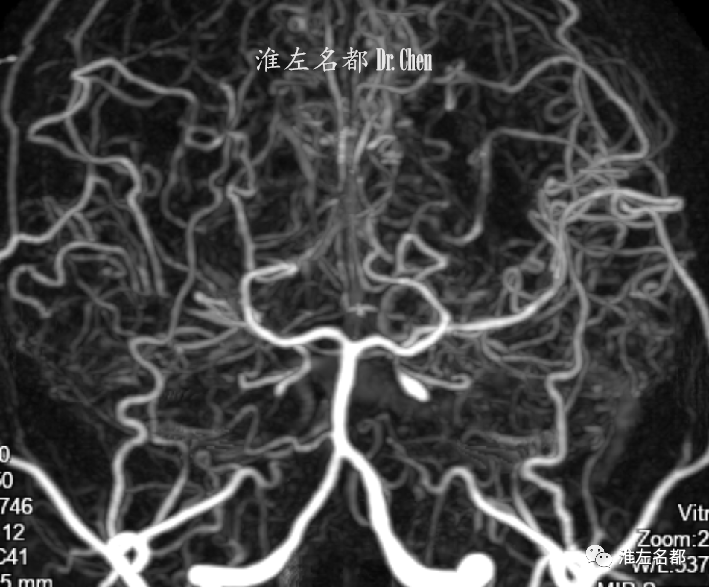
△颈部和颅脑CTA:双侧颈内动脉近端闭塞,侧支循环可逆流至双侧颈内动脉海绵窦段。
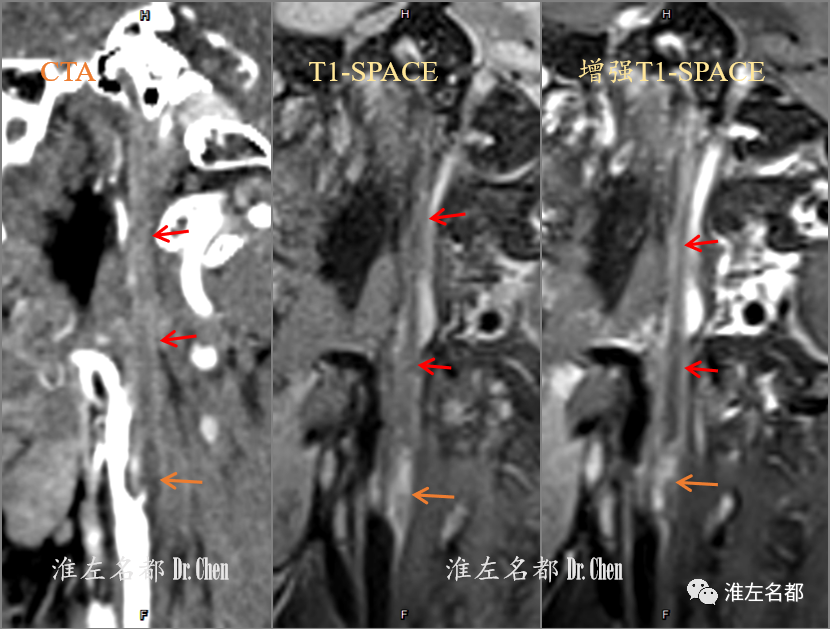
△CTA多平面重建图像:右侧颈内动脉近端低密度斑块(左图,橙箭),并见一小残端,闭塞斑块以远血管轮廓塌陷(红箭);高分辨T1-SPACE平扫(中图)和增强(右图):右侧颈内动脉近端斑块呈高低混杂信号,并见局部显著强化(橙箭),闭塞斑块以远血管轮廓塌陷,呈无强化的低信号(红箭)。
【介入治疗经过】
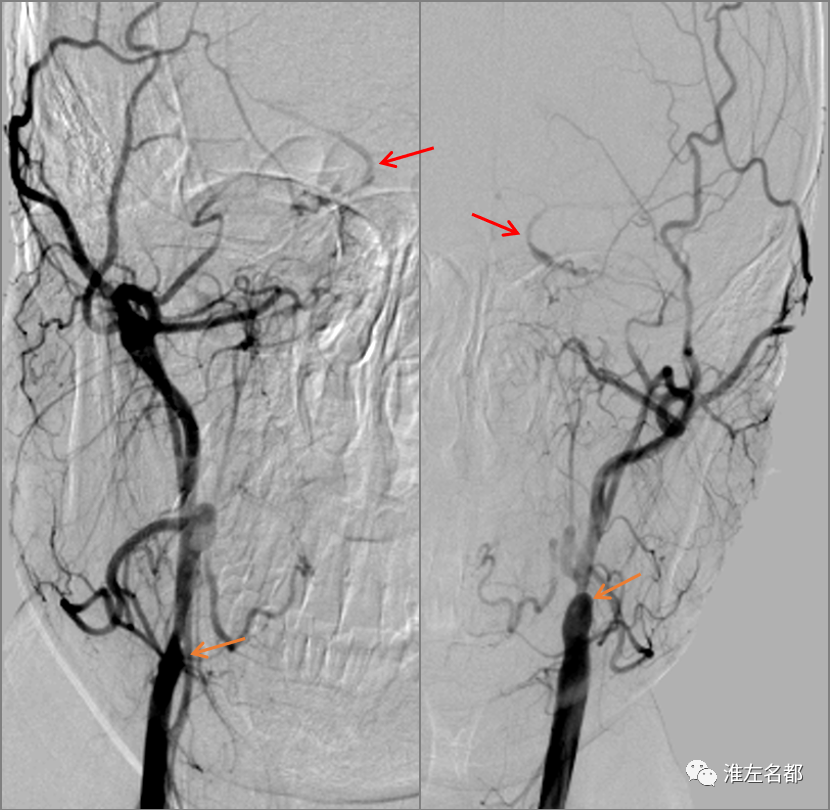
△DSA示双侧颈内动脉近端闭塞(橙箭),侧支循环可逆流至双侧颈内动脉海绵窦段(红箭)。
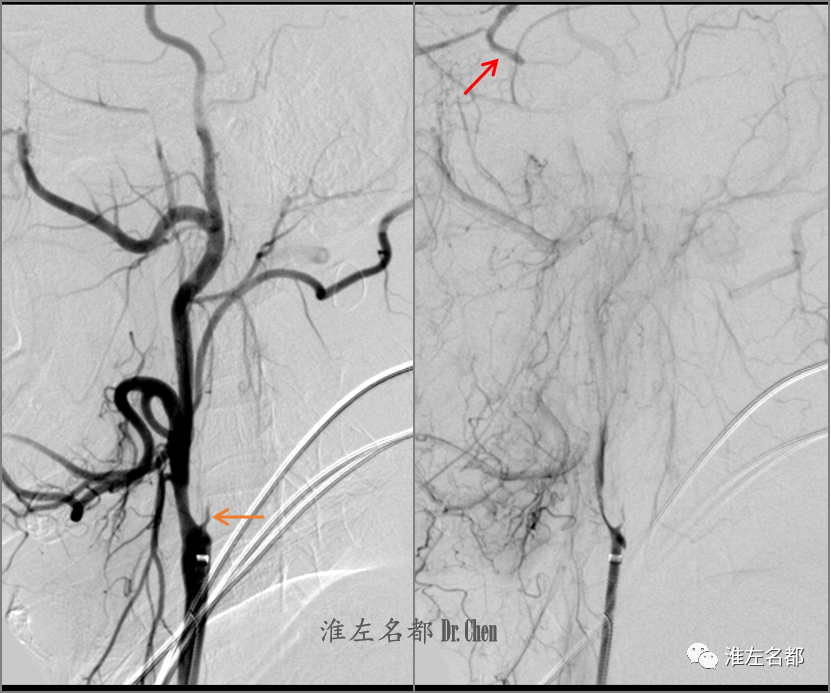
△同轴技术将6F长鞘头端送至右侧颈总动脉远端,造影示右侧颈内动脉近端闭塞,可见一细小线样残端(橙箭),侧支循环可逆流至右侧颈内动脉海绵窦段(红箭)。
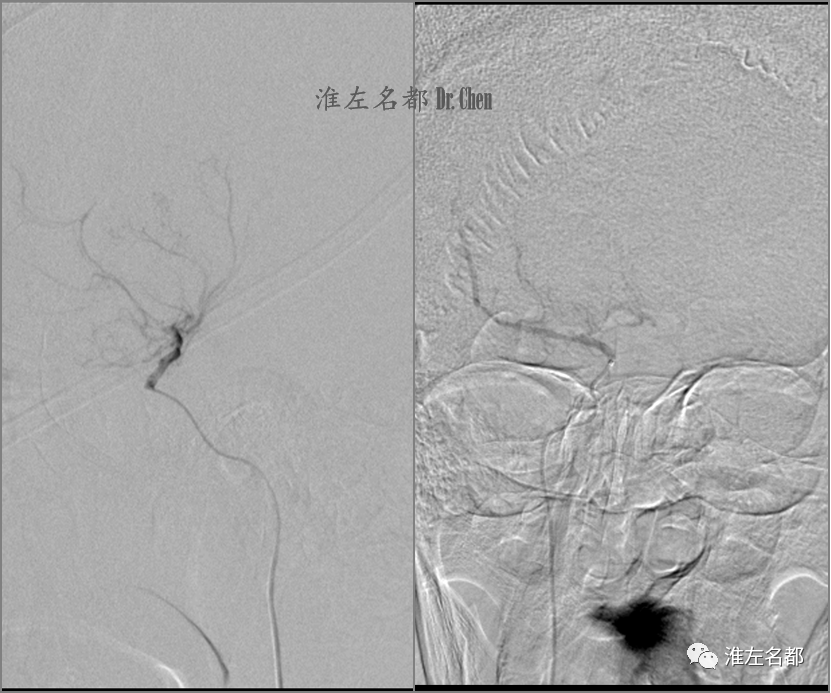
△微导丝(.014”,300cm,Command)在微导管(135cm,Renegade HI FLO 2.7-3.0)配合下快速通过右侧颈内动脉起始部闭塞斑块,并将微导管头端送至海绵段,造影证实位于真腔。
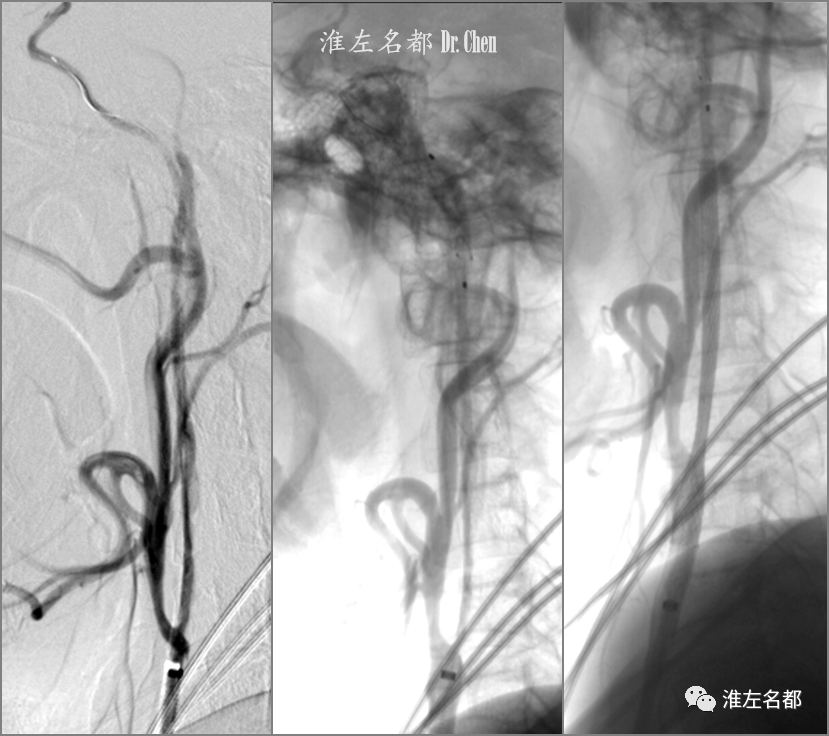
△将交换微导丝(.014”,300cm,Transend)头端经微导管送至右侧颈内动脉末端,撤出微导管,以小球囊(2.5*12mm)扩张右侧颈内动脉海绵窦段-起始部,造影可见右侧颈内动脉闭塞再通;于右侧颈内动脉颅外段远端植入保护伞(Spider,4.0mm);植入颈动脉支架(Wallstent,9*40mm)后造影示右侧颈内动脉颅外段形态可,无明显残留狭窄。
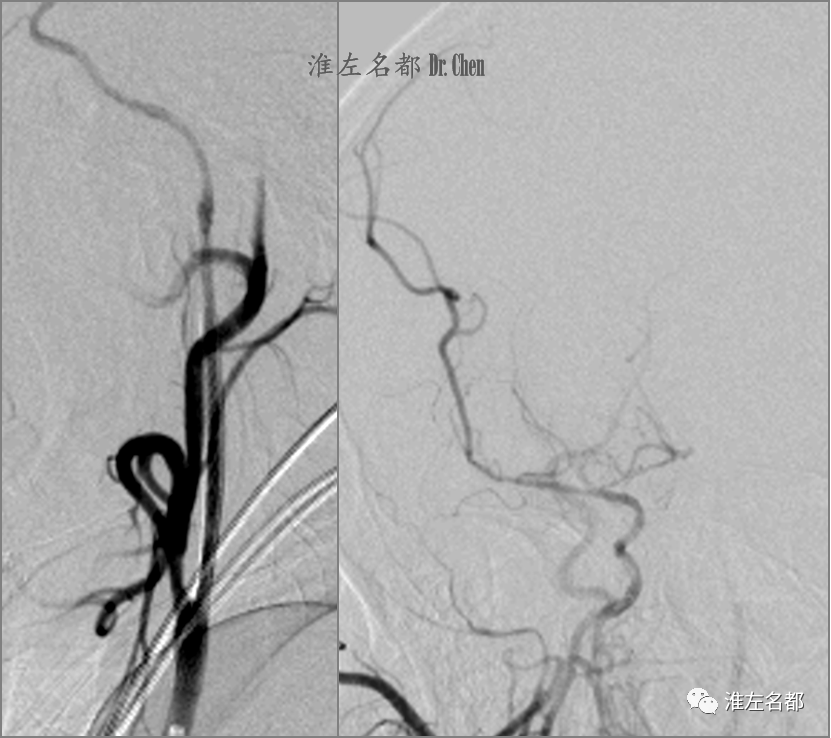
△回收保护伞后造影示右侧颈内动脉全程显影良好,大脑中动脉主干纤细,分支部分显影。
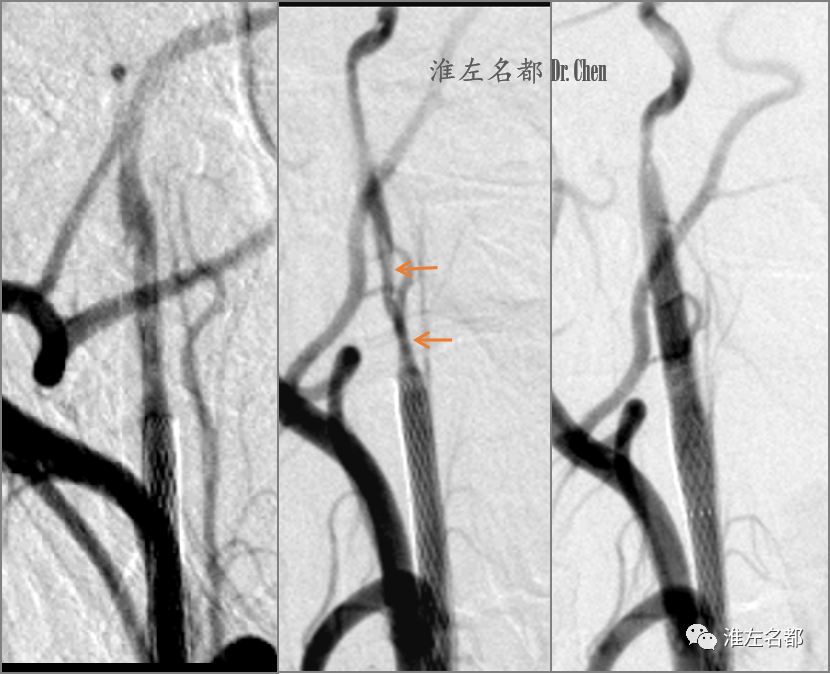
△回收保护伞后观察10分钟造影示支架未覆盖的局部颅外颈内动脉管腔塌陷(中图,橙箭),于该处植入自膨式支架(Protege,6*40mm)后管腔恢复(右图)。
【术后影像复查】
△术后第二日,复查CTA示右侧颈内动管腔通畅,颅内分支显影优于左侧。
备注:患者术后第二日自诉左侧肢体无力疲劳感有明显改善。
男,54岁。
主诉:反应迟钝6天,言语不能3天。
既往糖尿病和高同型半胱氨酸血症,长期吸烟。
神经体查:记忆、计算力下降,言语理解和表达能力下降;右下肢肌力4级+。
【术前多模式影像】
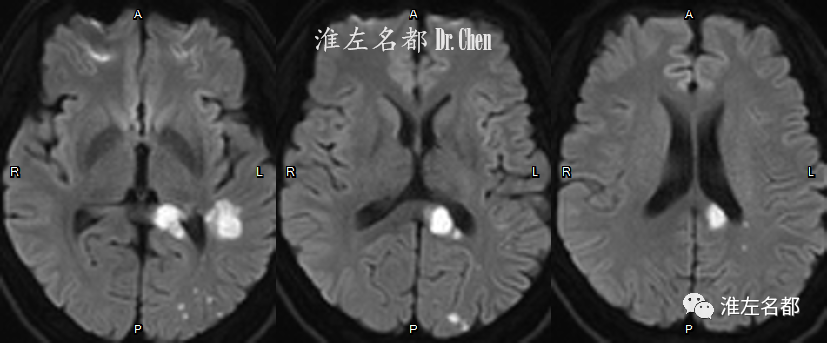
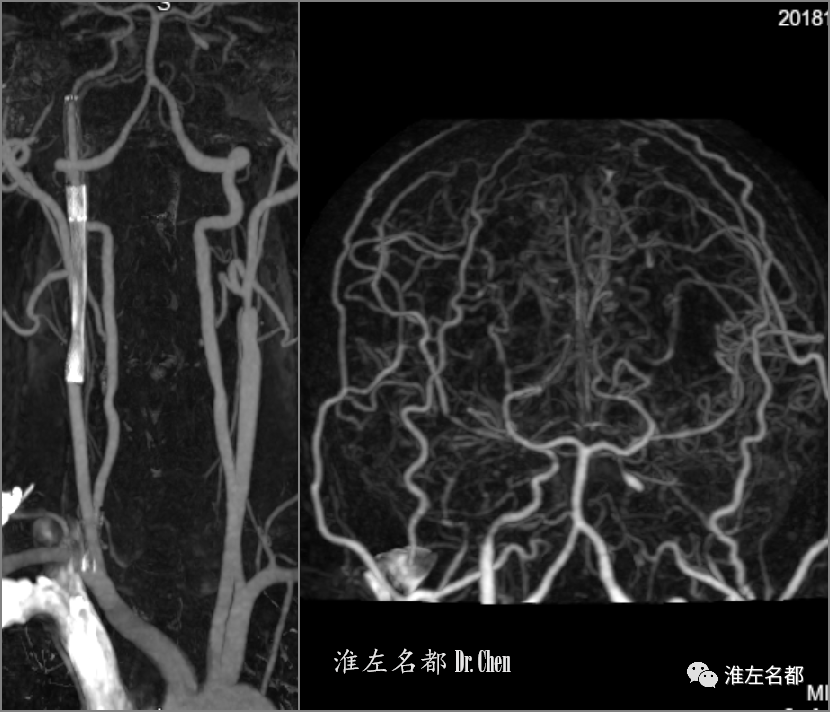
△DWI:左侧半球多发急性梗死。
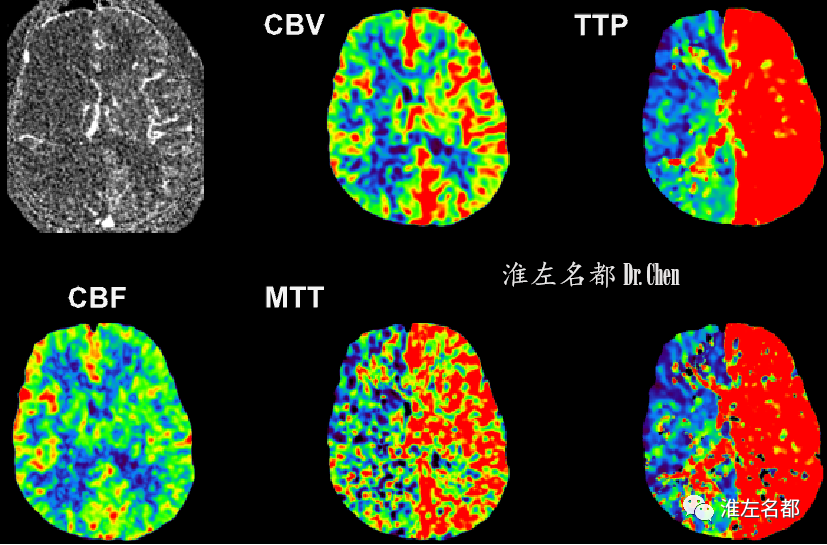
△脑CTP:左侧半球TTP较右侧显著延长,CBV较右侧增高,而CBF较右侧稍降低。
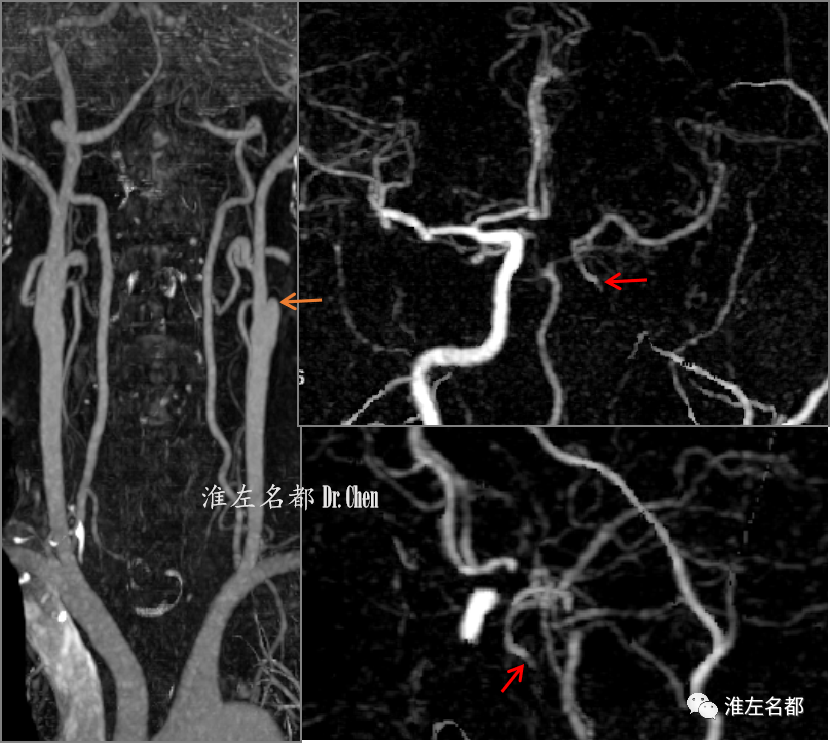
△CTA:左侧颈内动脉起始部闭塞(橙箭),侧支循环逆流至左侧颈内动脉海绵窦段(红箭)。
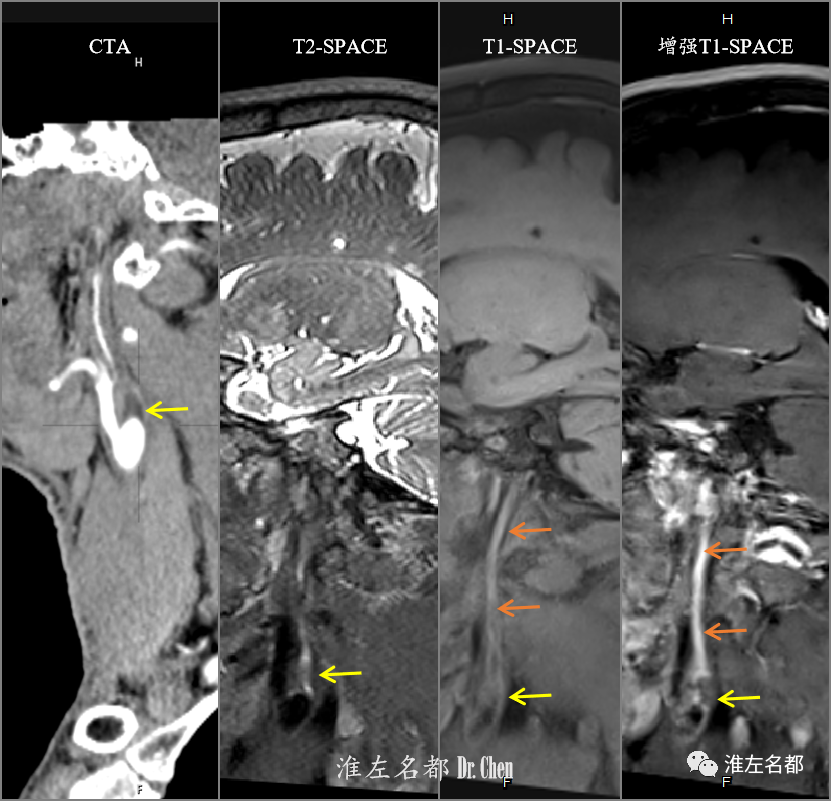
△CTA多平面重建图像于左侧颈内动脉起始部检测到低密度闭塞斑块(黄箭)。高分辨序列T2-SPACE、T1-SPACE平扫和增强显示闭塞斑块呈混杂T2信号,等T1信号,并见局部强化(黄箭);闭塞斑块远侧颈内动脉轮廓塌陷,呈等T1信号,并显著强化(橙箭)。
【介入治疗经过】
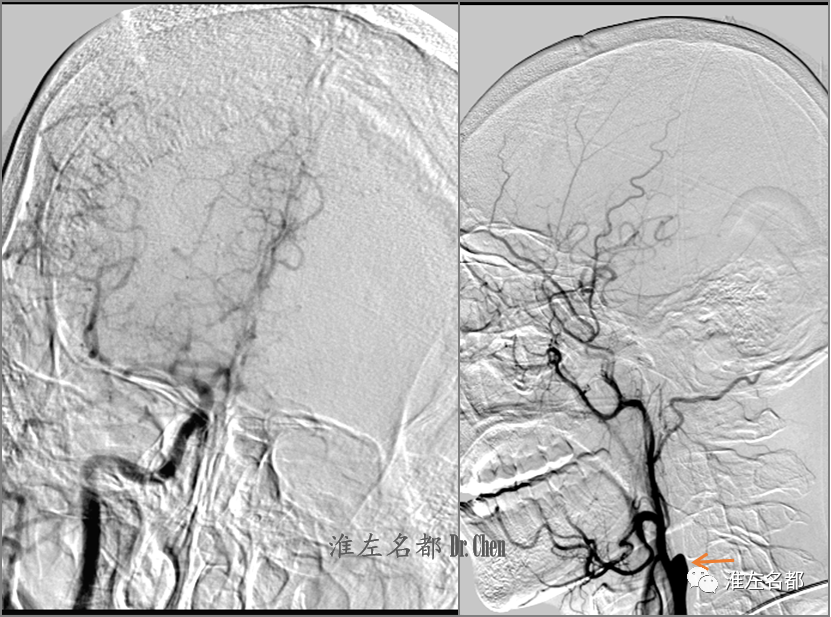
△右侧颈动脉造影示右侧大脑前动脉经前交通部分代偿左侧大脑前动脉血流(右图);左侧颈总动脉造影示左侧颈内动脉起始部闭塞(左图,橙箭),颈外动脉经眼动脉部分代偿闭塞远侧颈内动脉及其分支血流,并逆流至海绵窦段。
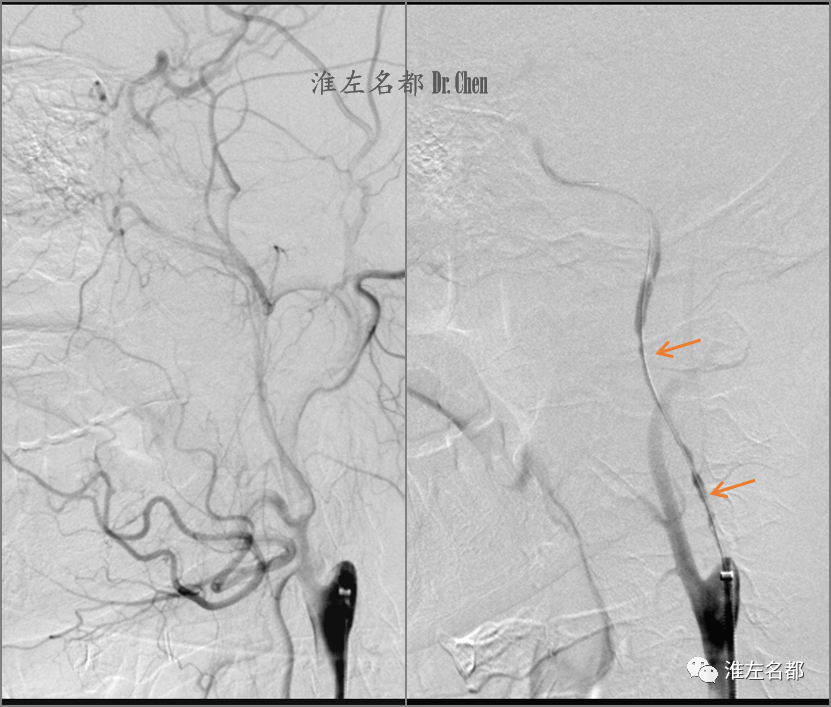
△同轴技术将6F长鞘头端送至左侧颈总动脉远端,造影示左侧颈内动脉近端闭塞,侧支循环可逆流至海绵窦段(左图);微导管(135cm,Renegade HI FLO 2.7-3.0)配合下,微导丝(.014”,300cm,HI-Torque Command)经数次尝试后即通过闭塞斑块,并顺利送至海绵窦段,微导管沿微导丝送至岩骨段后撤回,造影见闭塞颈内动脉可见前向血流,颅外颈内动脉长段严重狭窄(橙箭)。
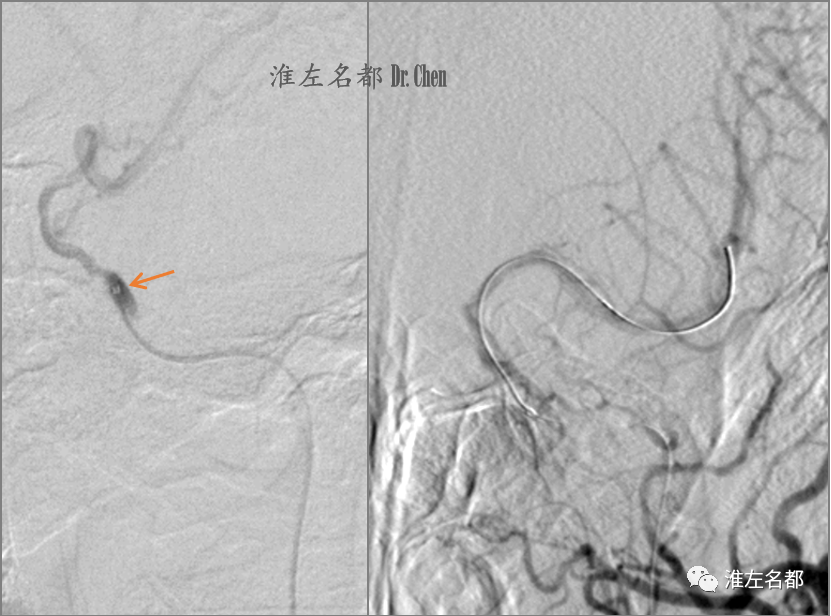
△沿微导丝将微导管头端送至海绵段,造影证实位于真腔(橙箭);撤出微导丝,将交换导丝(.014”,300cm,Transend)头端送至左侧MCA M2段后撤出微导管。
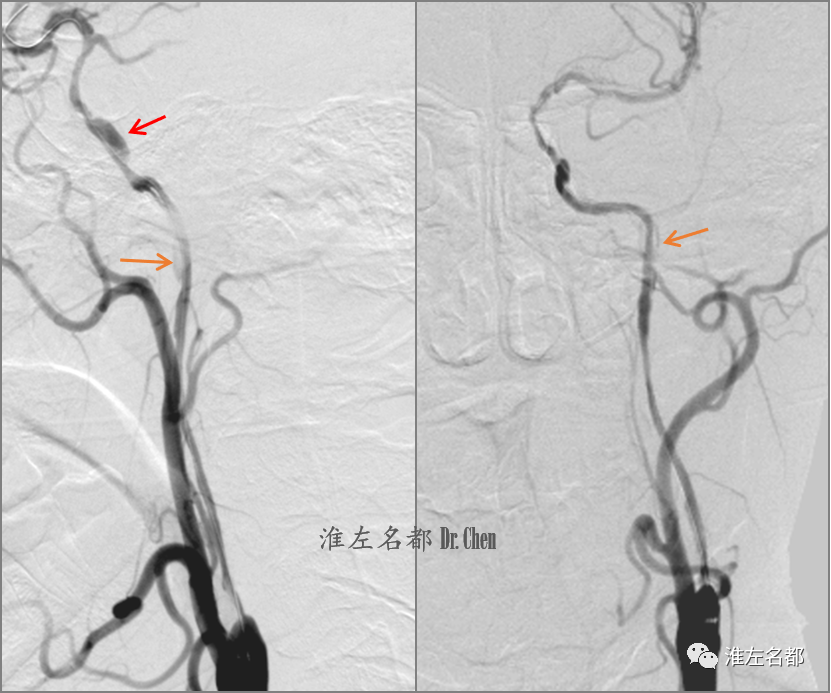
△用小球囊(2.0*15mm)扩张左侧颈内动脉海绵窦-起始部,造影示海绵窦段(红箭)和岩骨段上升部(橙箭)夹层。
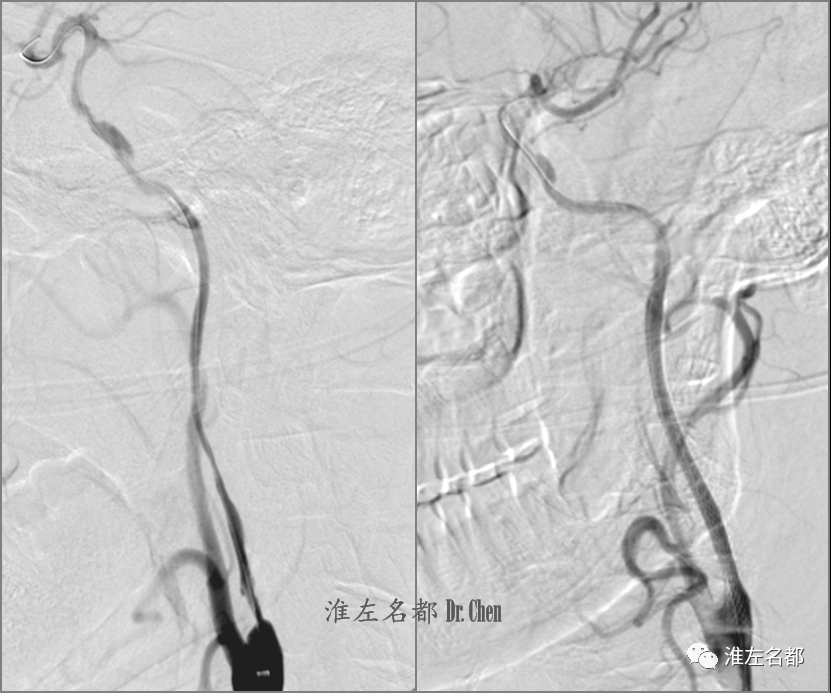
△用3.0*30mm球囊扩张颈内动脉岩骨段-起始部,造影示管腔狭窄较前稍改善,岩骨段夹层消失(左图);于左侧颈内动脉颅外段植入颈动脉支架(Wallstent,7*50mm),并以4.0*30mm球囊后扩,造影示颅外段颈内动脉管腔重建良好。
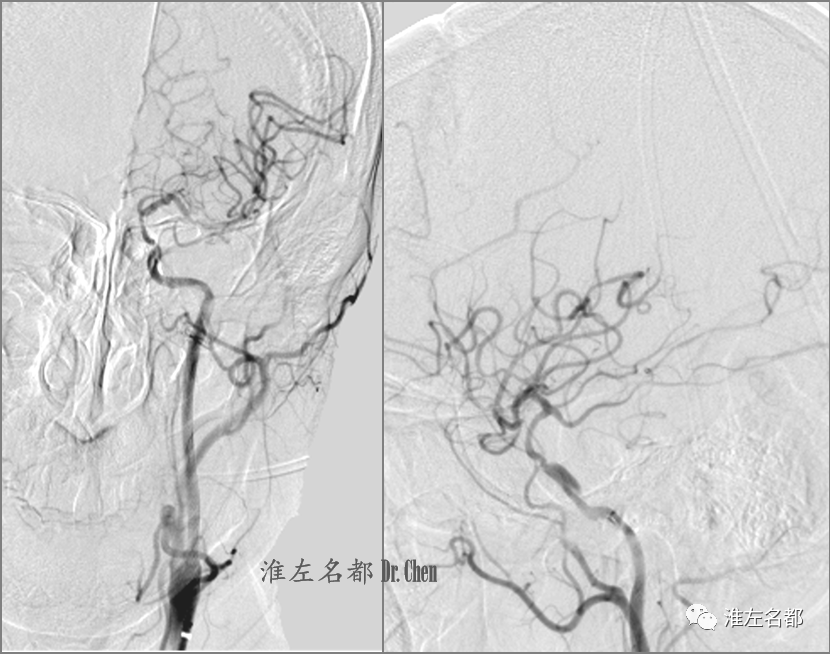
△DSA示左侧前循环颅内分支显影良好,左侧颈内动脉海绵窦段夹层。
【术后影像复查】
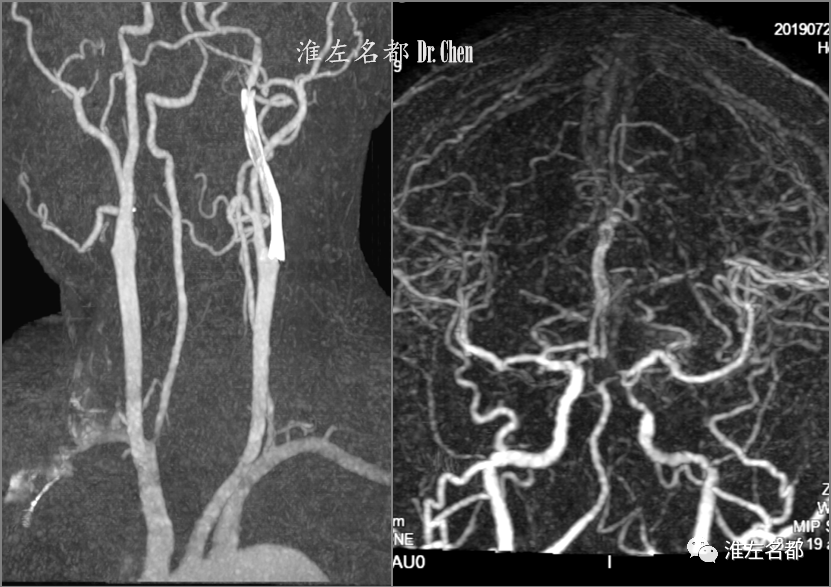
△术后第二日,复查CTA:左侧颈内动脉管腔通畅
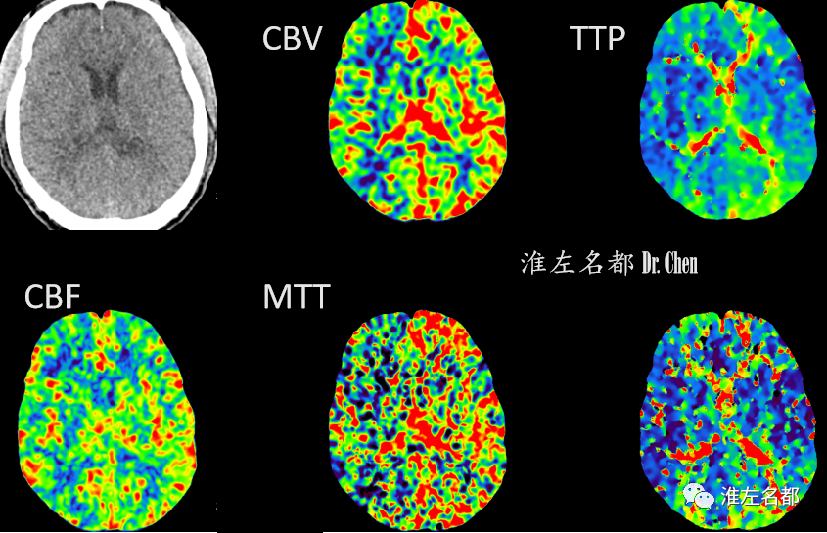
△术后第二日,复查脑CTP:双侧半球灌注基本对称。
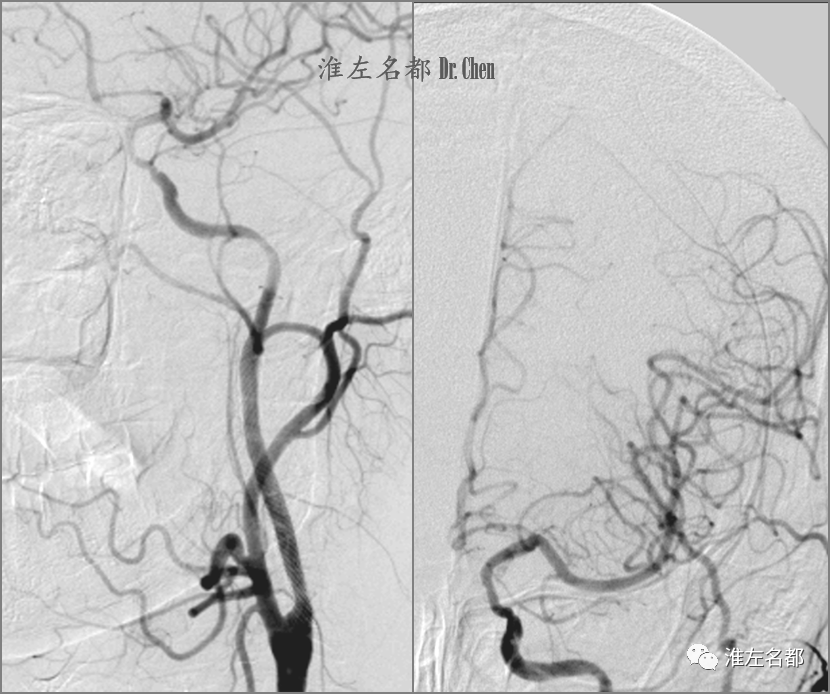
△术后第3个月,复查DSA:左侧颈内动脉支架通畅。
备注:术后第3个月,患者记忆力、计算力和语言理解力基本恢复正常。
【基本信息】
男,76岁;2019-06-03入院。
主诉:行走不稳约4年,加重伴反应迟钝约7月。
简要病史:
2015年始无明显诱因下出现行走不稳,当地医诊断脑中风,治疗好转出院。
2018年10月出现右上肢活动障碍,能在床边移动,但无力抬起,反应较前迟钝,当地医院住院诊治,好转出院。
2018年11月中旬出现“不能言语、右侧肢体活动障碍”再次至当地医院住院诊治,好转出院;家属发现其反应迟钝、记忆力下降明显。
为进一步诊治遂至我院就诊,拟“脑小血管病”收入我科。
既往高血压多年,不规律服用降压药。
神经体查:认知功能降低,右侧肌力5级-。
【入院前影像】
2019-5-24
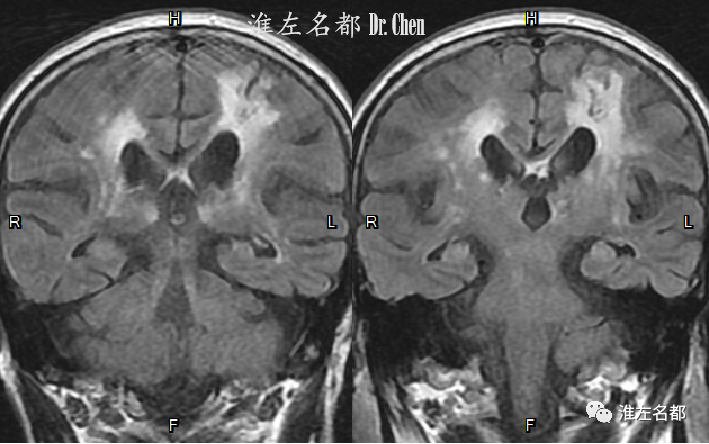
△FLAIR:双侧脑室旁和皮质下脑白质改变,左侧皮质分水岭区陈旧性脑梗死。
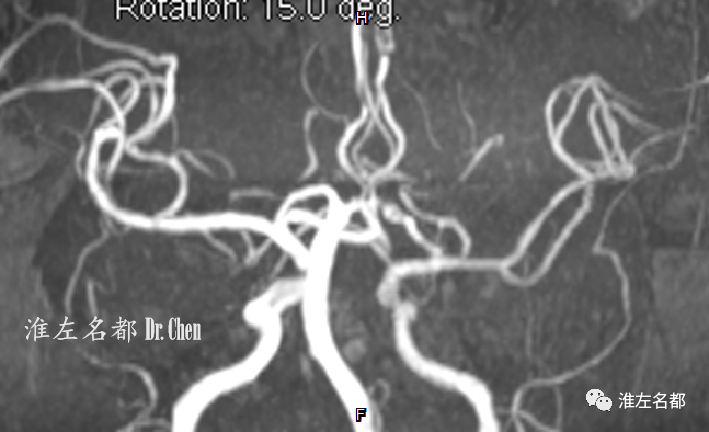
△3D-TOF-MRA:左侧颈内动脉及其分支管腔通畅,但较右侧细小,且信号强度降低,提示左侧颅外颈动脉存在限制血流的严重狭窄。
【入院后影像】
2019-6-11
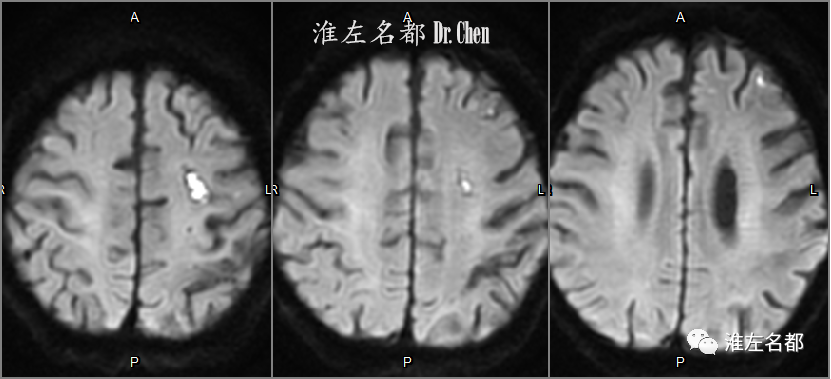
△DWI:左侧半球多发急性小梗死灶。
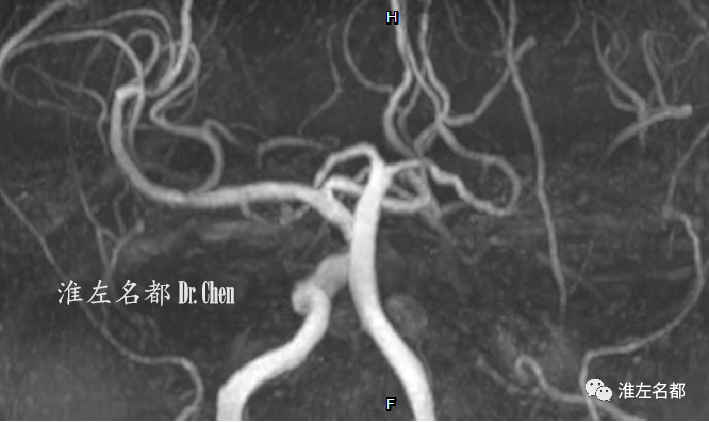
△3D-TOF-MRA:左侧颈内动脉闭塞,左侧大脑中动脉主干及其分支显影差。
入院后常规药物治疗,但患者认知继续降低,言语和自主活动逐渐减少;进而卧床不起,嗜睡,大小便失禁,右侧肌力5级-。
2019-6-17
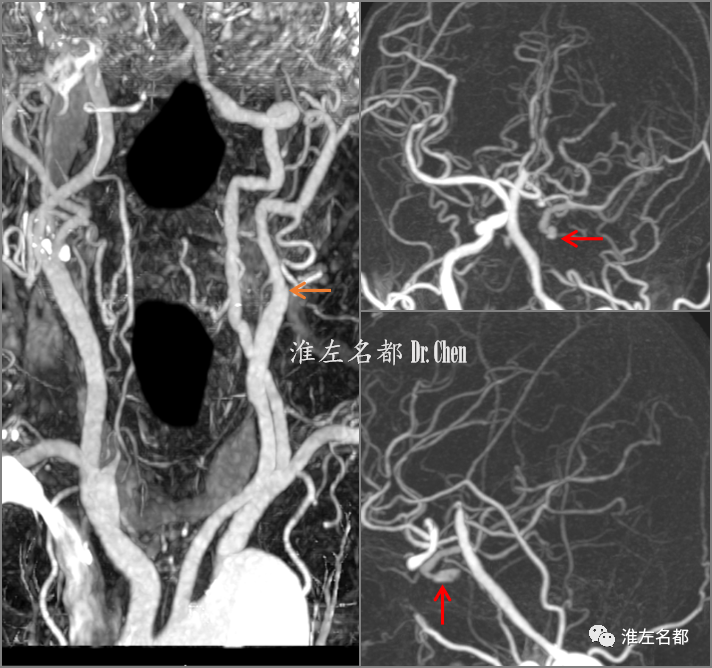
△CTA:左侧颈内动脉起始部闭塞(橙箭),侧支循环可逆流至左侧颈内动脉海绵窦段(红箭)。
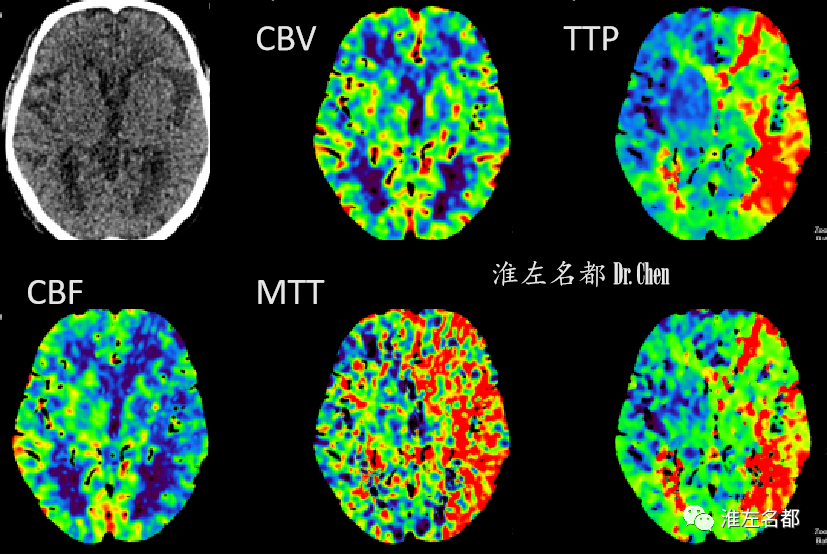
△脑CTP:左侧半球大范围TTP显著延长,并CBF降低。
2019-6-20
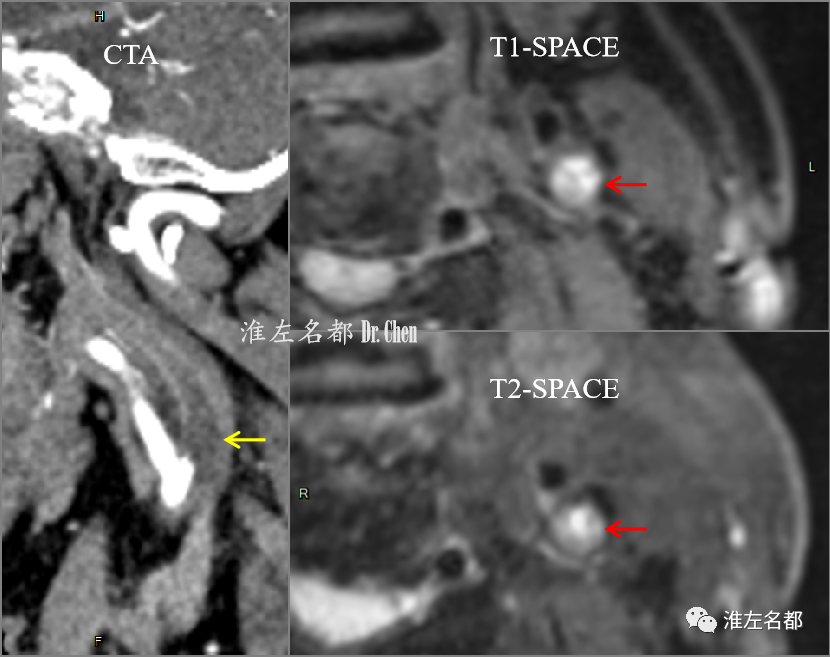
△CTA(2019-6-17)多平面重建图像示左侧颈内动脉起始部低密度斑块(黄箭);管壁MRI(高分辨T1/T2-SPACE):左侧颈内动脉起始部斑块内出血高信号(红箭)。
△高分辨T1-SPACE多平面重建图像:左侧颈内动脉海绵窦段-起始部闭塞管腔内充满高信号亚急性血栓影(红箭)。
【介入治疗经过】
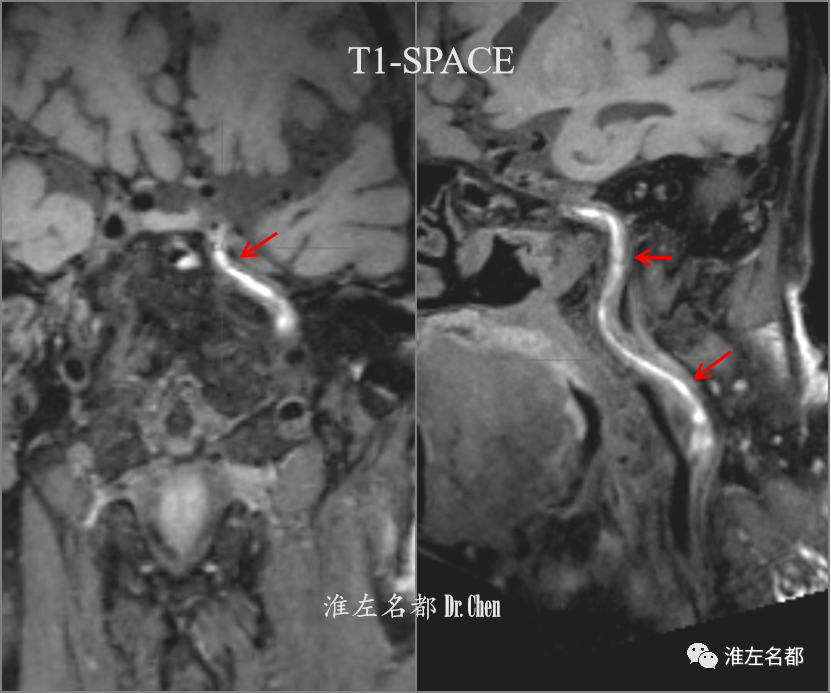
△DSA示左侧颈内动脉起始部闭塞(红箭)。
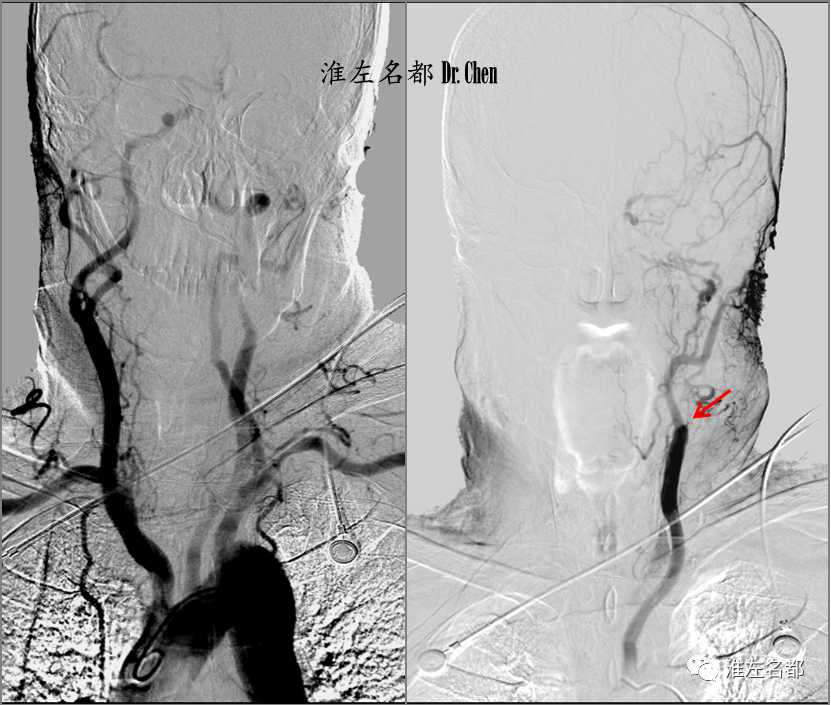
△同轴技术将6F长鞘送至左侧颈总动脉远端,造影示颈内动脉近端闭塞(红箭),侧支循环可逆流至海绵窦段(橙箭)。
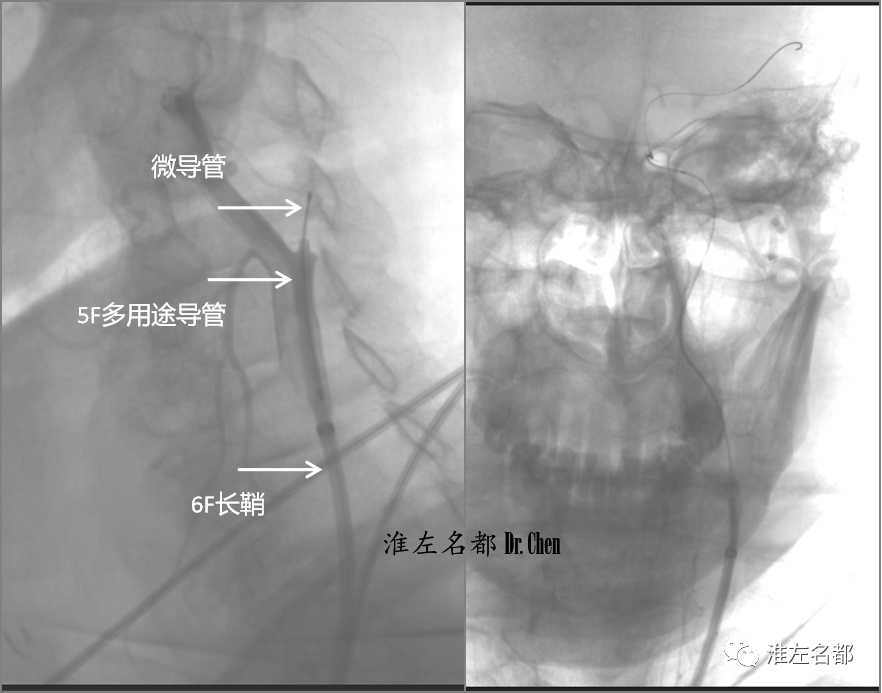
△以5F多用途导管(125cm,Cordis)抵进颈内动脉闭塞(左图);微导丝(.014”,300cm,Command)在微导管(Rebar 27)配合下顺利通过近端闭塞斑块并到达海绵窦段,沿微导丝将微导管送至海绵窦段,造影证实在真腔后,将交换导丝(.014”,300cm,Transend)送至MCA M2段后撤出微导管(右图)。
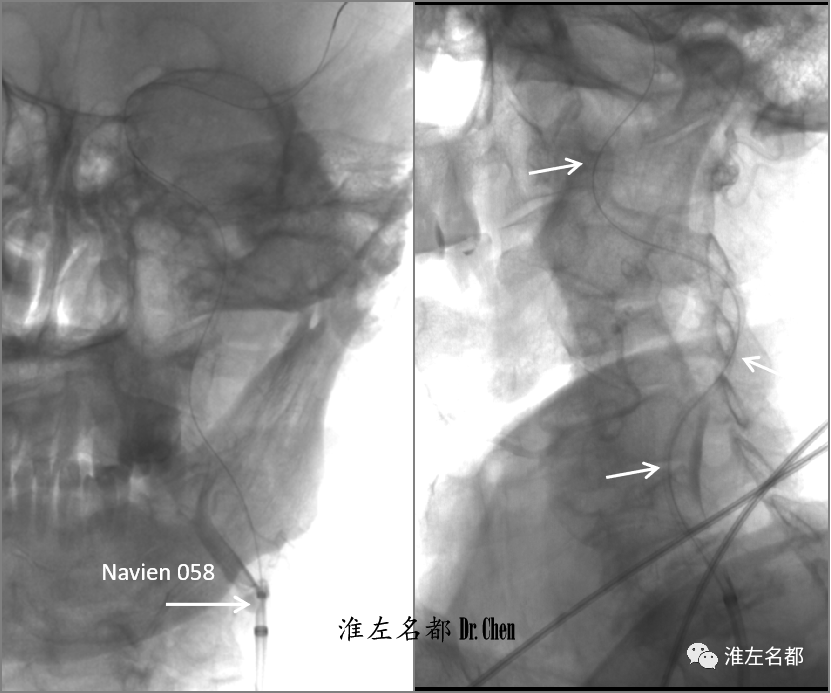
△沿微导丝送入中间导管(Navien 058),中间导管头端抵进闭塞(左图);以小球囊(2.0*15mm)扩张左侧颈内动脉近端闭塞斑块后,将中间导管推进到闭塞颈内动脉海绵窦段(右图),撤出小球囊。
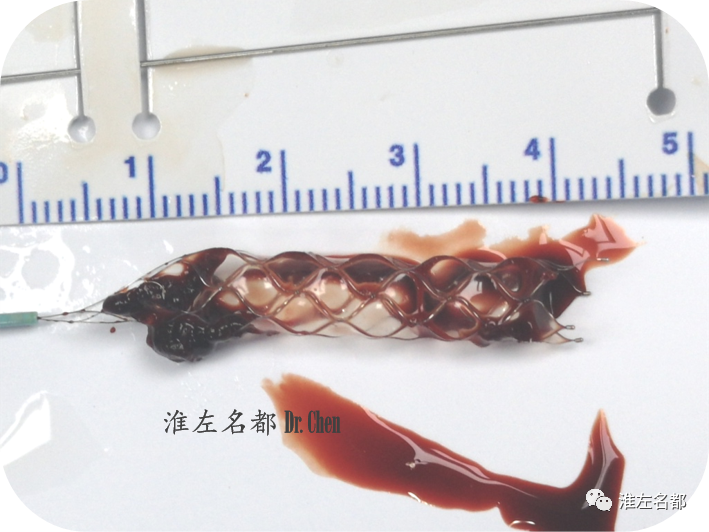
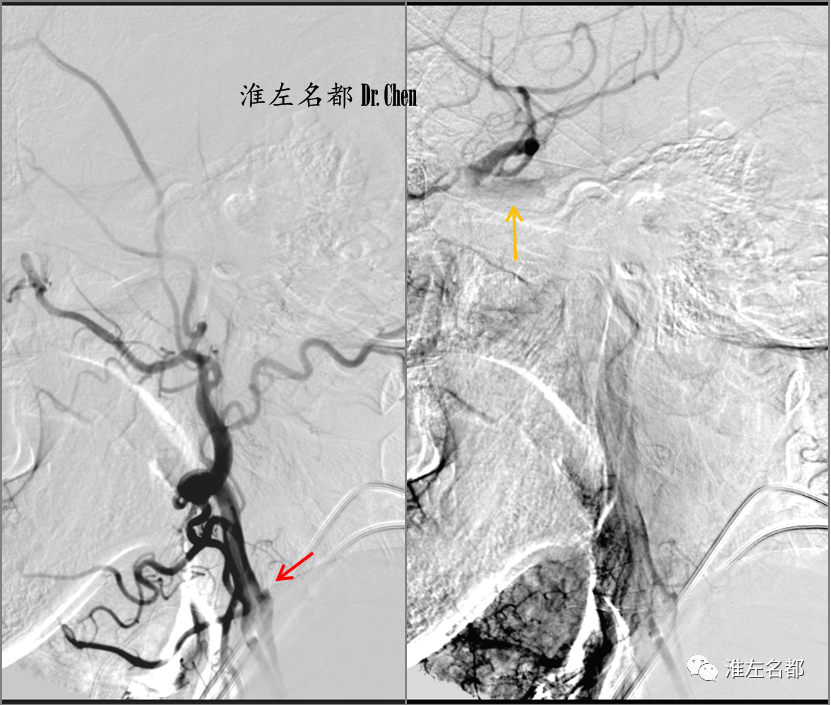
△以中间导管逐次抽吸海绵窦段-颅外段颈内动脉,但仅吸出少许血栓;将中间导管置于颅外段中部,用微导丝将微导管(Rebar 27)送至海绵窦段,经微导管将取栓支架(S AB 6*30mm)释放于颈内动脉海绵窦段-岩骨段-颅外颈内动脉远端;等待约8分钟后,以SWIM技术回收支架,中间导管推至岩骨段;支架取出数块较大的红色血栓。
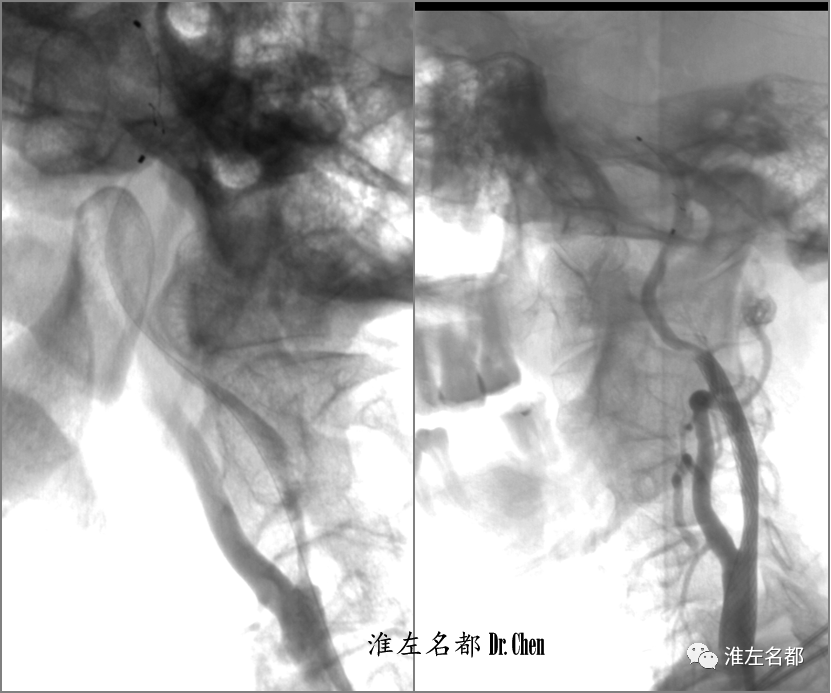
△通过中间导管释放保护伞(Spider 5.0mm),撤出中间导管,造影示左侧颈内动脉恢复前向血流,颈内动脉近端狭窄(左图);于狭窄处植入颈动脉支架Wallstent- 9*40mm(右图)。
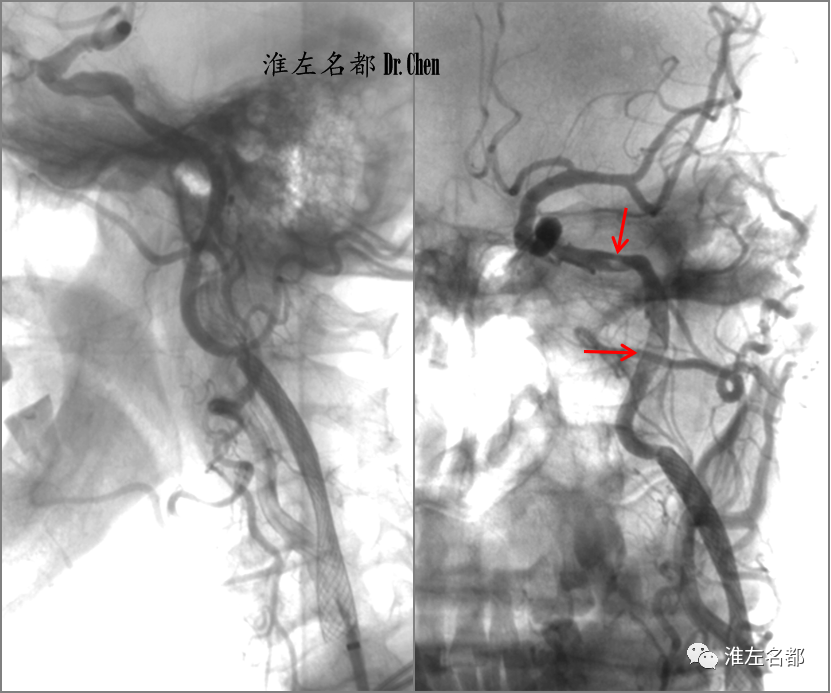
△回收保护伞后(伞内未见捕获物)造影示:颅外颈内动脉远端和岩骨段附壁血栓充盈缺损(红箭)。
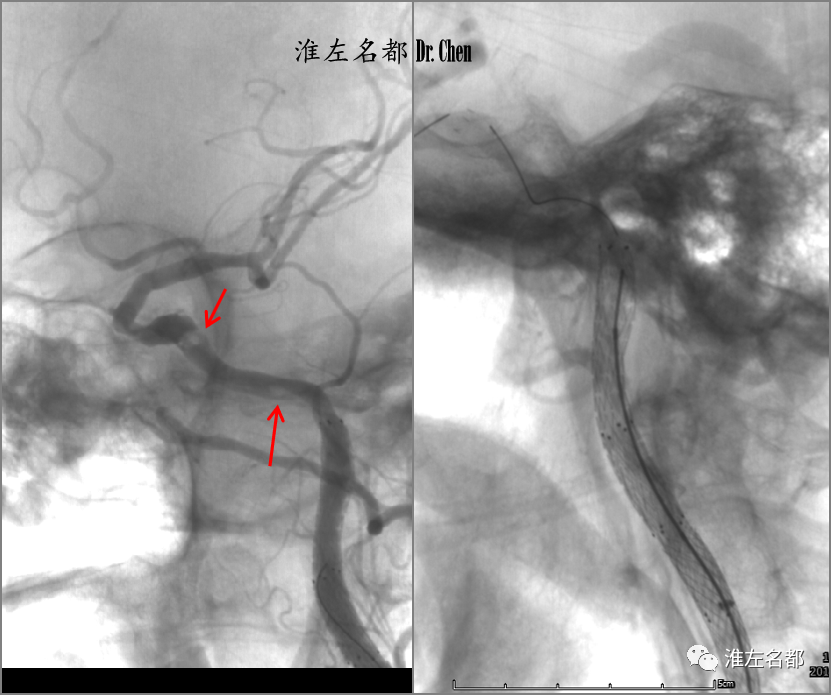
△于颅外颈内动脉中远段植入两枚自膨式颈动脉支架(Protege,6*40mm和6*30mm)后造影示:岩骨段和海绵窦段附壁血栓充盈缺损(左图,红箭);再于海绵窦段和岩骨段植入颅内自膨式支架,EP 4.5*37mm(右图)。
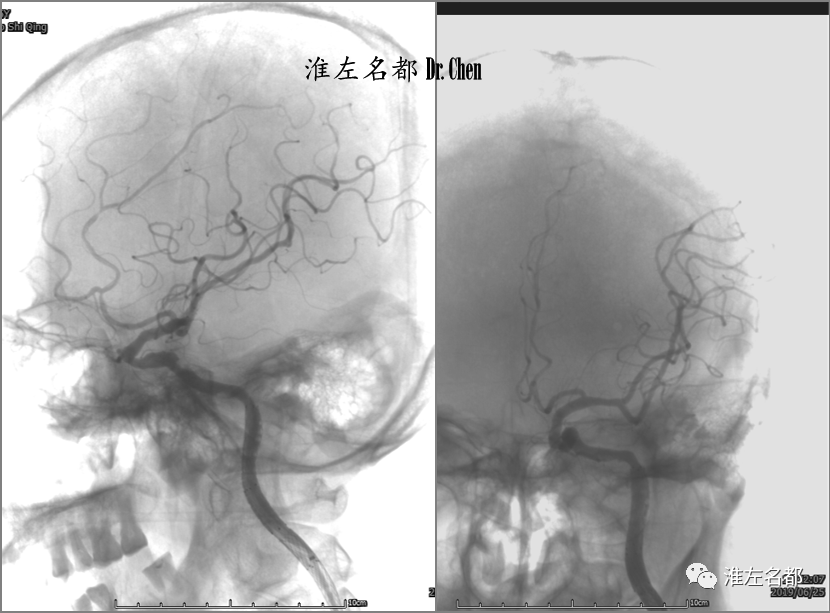
△造影示海绵窦段和岩骨段附壁血栓受压,管腔轻度狭窄,颅内血管显影良好。
【术后影像复查】
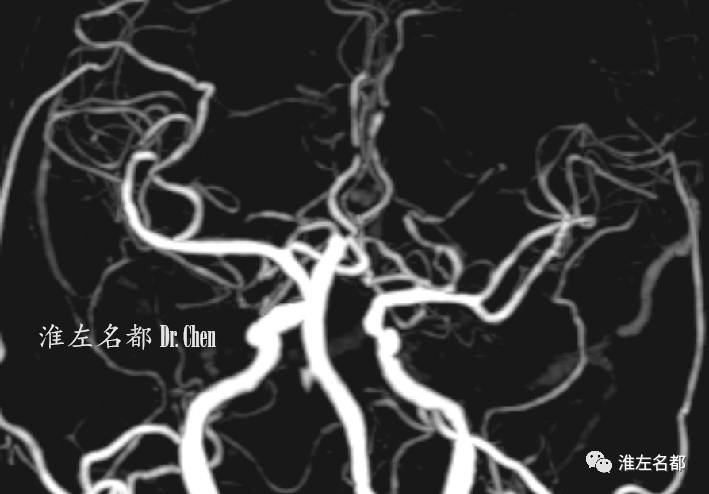
△术后复查CTA:左侧颅内前循环显影良好。
△术后复查脑CTP:双侧半球灌注基本对称。
第二部分:总结讨论
微导丝/微导管选择
颈内动脉起始部闭塞斑块介入再通治疗的微导丝/微导管选择原则还不明确,具体情况主要决取于介入医生经验习惯,以及医疗机构的器械备货。
一些术者首选头端较软的神经导丝,根据尝试结果逐渐升级微导丝头端的硬度。微导管选择亦是如此,大部分术者偏爱外径细小的神经微导管。
然而,类似于冠状动脉和远端的外周动脉,颅外颈内动脉解剖上属中型动脉,具有较厚的管壁;其起始部闭塞斑块介入再通的微导丝/微导管策略可部分借鉴冠脉或下肢动脉闭塞介入再通的经验原则。
笔者习惯首选头端硬度中等的外周Command微导丝(.014”,300cm,HI-Torque Command,雅培)尝试通过颈内动脉起始部闭塞斑块,一般先在距头端5mm左右塑一约30度的折角,此部分主要方便导丝头端嵌入斑块;根据需要可在距头端稍远处再塑一复合弯曲,以利于方向操控。除便于快速嵌入和通过闭塞斑块外,首选头端偏硬微导丝和头端塑一折角的,其他考虑还包括,微导丝通过斑块后即使进入内膜下,由于导丝较硬和头端短距离-小角度折角,不容易在内膜下打折和卷曲,往往在内膜下直行一段距离后回到真腔,不会造成严重的夹层而给后续治疗增加麻烦。
笔者首选外周微导管HI FLO(135cm,Renegade HI FLO 2.7-3.0,波科)是出于以下考虑:
①不同于神经微导管柔软的头端,此外周微导管头端偏硬,具有较强的支撑力,尤其是在起始部斑块较硬的情况下,可为微导丝提供较强的支撑力。
②该微导管头端外径是2.7F,后半部分直径是3.0F,决定了其推送性能优于一般神经微导管,尤其是在过质地偏硬斑块时具有优势。
需要注意的是,由于头端偏硬的特性,Command微导丝和HI FLO微导管最远操作到海绵窦段颈内动脉,均不宜进入床突上段。微导管到达海绵窦段后,如有需要,笔者会使用神经交换导丝(一般选Transend)进入颅内分支血管,撤出微导管进行后续操作。
外周支撑微导管头端坚硬锐利,容易穿透到血管外(案例1),不建议尝试。
颈内动脉起始部斑块病理特征和导丝通过性
据文献报道,无残端或残端显影平坦的颈内动脉起始部闭塞,介入治疗时导丝通过较为困难。然而,管壁高分辨MRI为此打开了另外一扇门,其通过显示起始部斑块或组织特性,为介入医生提供了新的思路。
本文案例表明(案例1),如果病变位于颅内,近端管腔长时间塌陷萎谢,最终闭塞,其近端也可呈现为一平坦的残端。管壁高分辨MRI可明确上述特殊类型颈内动脉闭塞。案例1患者闭塞近端高分辨MRI未发现斑块组织,且颅外闭塞段塌陷萎缩,呈无强化的T1低信号;表明长时间闭塞后,正常血管结构消失,已经演变为坚韧的纤维结缔组织,所以常规微导丝/微导管技术难以突破闭塞残端就不足为奇了。此类病例可能就不适合介入再通治疗,介入医生术前可应用高分辨MRI加以鉴别。
本文表明,导丝通过颈内动脉起始部斑块的难易程度主要取决于斑块的组织特性,高分辨MRI在鉴别斑块组织特性方面极具价值。本文案例2和5高分辨MRI提示斑块内出血,案例3和4高分辨MRI显示混杂信号,且局部强化;此两种情况表明斑块质地相对松软,使用一定硬度的导丝还是比较容易快速通过的。
案例2和4残端平坦,按照一般经验推测导丝通过难度较大,但实际情况恰恰相反。案例5患者左侧颈内动脉近端闭塞几乎无残端,高分辨MRI提示斑块内出血,此斑块松软,多用途导管头端可轻易嵌入斑块内,为微导丝/微导管通过提供指向性和额外支撑力。
值得重视的是,本文案例2-5患者颈部CTA多平面重建图像提示颈内动脉近端闭塞斑块主体均呈低密度(相对于邻近的肌肉组织),这个指标也可能提示斑块脂质成分占比高,组织松软,导丝容易通过。
另外,无创影像学可明确近端斑块闭塞范围,为术中判断导丝是否越过斑块段提供参考。
闭塞段高分辨MRI表现和血栓保护技术
颈内动脉非急性闭塞择期介入治疗最担心的并发症是术中颅内动脉血栓栓塞。遗憾的是,目前常规术前评估难以明确闭塞段管腔是否存在血栓、血栓范围、血栓时期等重要问题;然而,管壁高分辨MRI在获取此类信息方面独具优势。
本文案例2-4患者,管壁高分辨MRI于闭塞段颈内动脉管腔内均未发现血栓,这类病人栓塞风险小,微导丝通过和小球囊扩张后,如果颅外颈内动脉远端血管床情况良好的话,放置远端血栓保护装置即可(案例2和3);
如果颅外颈内动脉远端血管床合并夹层,为避免二次损伤,不使用远端保护装置可能也是安全的(案例4)。
在管壁高分辨MRI显示闭塞段存在新近血栓时,使用血栓保护装置是必须的,但采用何种策略还不明确,同时还要考虑到联合应用导管抽吸等血栓清除技术。
闭塞段新近血栓的处理策略
本文案例5是一闭塞段颈内动脉管腔新近血栓形成的极端病例,闭塞斑块以远管腔亚急性血栓一直延伸到海绵窦段。此种情况下,远端血栓保护装置失效;近端保护装置在闭塞近端开通情况下,可能也难以完全清除如此广泛的高负荷血栓,难以确保操作过程中不发生栓塞事件。
另外,笔者单位无近端血栓保护装置。为此,笔者先以小球囊扩张近端斑块,而后跟进中间导管直至海绵窦段,试图用抽吸技术尽量清除闭塞段管腔的血栓,但仅吸出少量血栓,可能是这些亚急性血栓相对坚韧粘滞的原因。
事已至此,笔者又尝试在海绵窦段-颅外颈内动脉远端植入取栓支架,并使用SWIM技术取出大块血栓;而后经中间导管释放远端血栓保护装置,于颈内动脉植入支架,实现闭塞再通后回收保护伞。尽管此后造影显示多处附壁血栓充盈缺损,但未发生栓塞事件,表明导管抽吸结合支架取栓可能在清除颈内动脉闭塞段新近血栓方面具有价值,也是一潜在的技术策略。笔者以为,在近端血栓保护装置情况下应用上述血栓清除技术可能更安全。
闭塞开通后附壁血栓的处理策略
本文案例5,安全开通闭塞颈内动脉后造影发现多处附壁血栓充盈缺损,为防止血栓脱落栓塞,最终植入支架覆盖血栓。然而,业界对于这些附壁血栓是否需要植入支架处理是有争议的;不少术者经验表明此类附壁血栓即使不作处理,栓塞的可能性也较小。希望以后业界能有更深入的探讨。
闭塞段颈内动脉高分辨MRI表现和再通后管腔回缩
这个问题极少被提及过,本文案例3患者闭塞颈动脉开通后,术中在支架未覆盖的远侧颅外颈内动脉出现逐渐管腔回缩狭窄。推测原因可能是:该闭塞段颅外颈内动脉高分辨MRI显示轮廓塌陷、T1低信号、无强化;提示由于长时间闭塞,局部管壁萎谢、滋养血管逐渐消失,演变为具有较强韧性的结缔组织;术中球囊扩张后如未植入支架,则短时间内组织回缩,管腔狭窄,此时需支架补救。
反之,案例2和4,虽然管壁高分辨MRI显示闭塞段颅外颈内动脉塌陷,但闭塞开通后未出现管腔回缩。推测原因可能是:这两例闭塞颈内动脉高分辨T1呈等信号,且显著强化;提示闭塞时间不长,管壁滋养血管正常,预示开通后管壁功能可得到快速恢复。
微导管首过效应在颈动脉闭塞介入再通的应用
急性脑卒中血管内介入治疗中,微导管首过效应用于鉴别颅内大动脉闭塞是否是原位粥样硬化病变所致。然而,本文案例4表明微导管首过效应技术在颈内动脉非急性闭塞介入再通治疗中可能还是有其价值所在的。经过微导管扩张后,闭塞段颈内动脉有可能出现前向血流,有利于快速判断管腔情况;尤其是缺少术前高分辨MRI评估时,笔者推测微导管首过效应阳性可能是闭塞段管腔无血栓的一个潜在判断指标,但还需更多的病例实践加以验证。
关于在闭塞段微导管造影的考虑
不少术者在操作过程中会经微导管于闭塞段进行造影,以了解局部血管情况。然而,笔者的习惯是根据术前无创检查了解的闭塞远端位置,术中在微导管越过闭塞远端位置时才会造影,以判断是否在真腔;这是出于以下考虑:
①如果微导管在闭塞段位于内膜下,此时经微导管造影则会导致局部夹层扩大,给后续操作增加难度。
②如果闭塞段存在新近血栓,尤其是微导管头端位置附近有血栓,经微导管造影时势必会冲击血栓,可能导致血栓移位脱落,加大了栓塞事件风险。
③因笔者术前进行了详尽的多模式影像评估,尤其是管壁高分辨MRI,对闭塞段颈内动脉的情况心中有数,如:是否合并血栓、血栓位置和范围、血栓形成的大致时间等,术中一般不需要通过微导管造影来了解闭塞段血管信息。
综上所述,对于颈动脉非急性闭塞,介入再通术前多模式影像评估(尤其是管壁高分辨MRI)有助于深入细致地了解其解剖和病理机制,为合理制定手术预案提供关键信息。作为开展此项治疗技术的介入医生而言,理应掌握术前多模式影像评估技术的正确实施和合理解读,并能切实运用到指导手术策略的制定中去,达到个体化诊治的现实目标。
颈动脉非急性闭塞介入再通治疗是一新兴的神经介入领域,问题纷繁复杂,很多疑问悬而未决。笔者是在自身有限的实践探索基础上进行本文写作的,心中自明肯定存在很多疏漏、错误和肤浅之处,望能得到同行的批评指正,以期在业务上能更进一步。当然,肯定存在其他不同的技术范式,希望能百花齐放,百家争鸣。
![]()




