
《Journal of Neurosurgery》 2021年5月 7日在线发表University of Southern California的Ben A Strickland, Shane Shahrestani, Robert G Briggs, 等撰写的《静默性垂体促肾上腺皮质激素细胞腺瘤:临床特征、长期预后和疾病复发的处理。Silent corticotroph pituitary adenomas: clinical characteristics, long-term outcomes, and management of disease recurrence》(doi: 10.3171/2020.10.JNS203236. )。
目的
静默性促肾上腺皮质激素细胞腺瘤(SCAs)是一种独特的无功能垂体腺瘤(NFAs),显示促肾上腺皮质激素(ACTH)免疫组化阳性,不引起库欣病。静默性促肾上腺皮质激素细胞腺瘤(SCAs)被猜测比标准的无功能垂体腺瘤表现出更具进袭性的行为。作者分析了他们医院对SCAs的手术经验,以确定侵袭性发生率、术后临床结果以及疾病复发和进展的模式。次要目标是确定在发生肿瘤复发和进展时的最佳治疗策略。
静默性促肾上腺皮质腺瘤(SCAs)是垂体肿瘤,呈促肾上腺皮质激素(ACTH)阳性,但不产生超量生化水平的ACTH或皮质醇。这些肿瘤约占所有促肾上腺皮质激素腺瘤的20%,占无功能垂体腺瘤(NFAs)的5.5%。2017年,世界卫生组织根据观察到的进袭性行为,将SCAs归类为高风险亚型。最近的垂体腺瘤重分类系统描述了7种形态功能类型和3个谱系,其中促肾上腺皮质激素属于受限制的垂体转录因子(TPIT)谱系。虽然SCAs通常被认为是NFA的一种独特亚型,但在患者人口统计学、肿瘤大小、海绵窦侵犯率、复发率等方面的数据却存在矛盾。由于SCAs的发病率低,需要免疫组化诊断,很多文献报道仅限于小的病例系列。较少的研究报告与SCA复发和进展相关的结果,这对于理解这种具有潜在进袭性的独特亚型垂体腺瘤的病理生理学是至关重要的。我们旨在通过描述我们在三级学术垂体中心管理SCAs患者的医院经验来解决这些问题。我们报告了据我们所知,在过去20年里通过手术治疗的最大的单中心SCA患者系列,以及与NFAs的比较队列。我们的目的是观察SCA患者的疾病侵袭性、进展和复发模式。我们进一步的目标是在有残余肿瘤或肿瘤进展的情况下最佳综合实践的策略。
方法
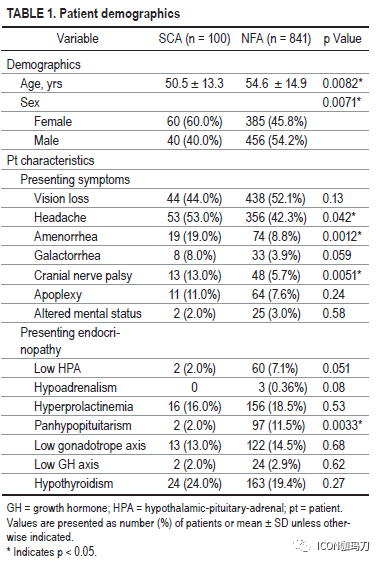
对2000年至2019年在作者所在医院接受手术治疗的100例SCAs患者和841例其他亚型NFAs患者进行回顾性分析。记录患者的人口统计学、肿瘤特征、外科和神经影像数据、内分泌病发生率和神经系统预后。对SCAs患者和标准NFA患者队列进行上述特征和结果的比较。
结果
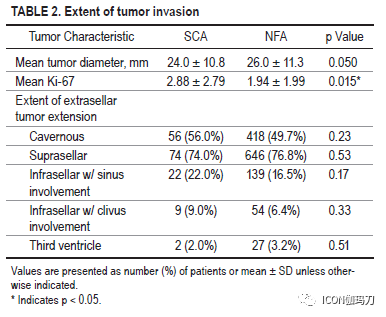
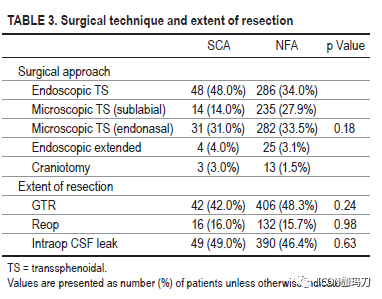
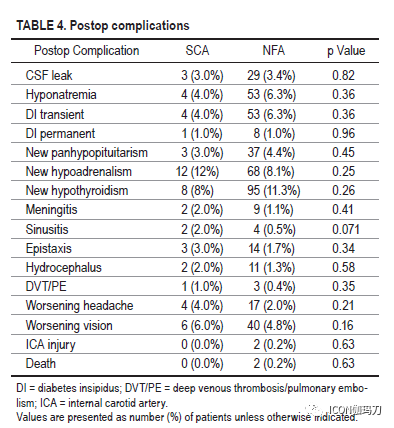
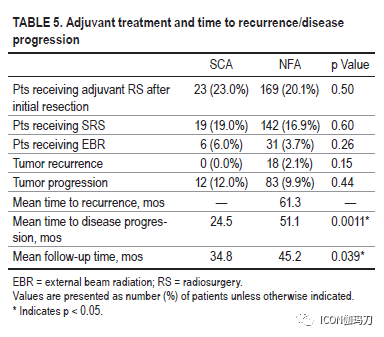
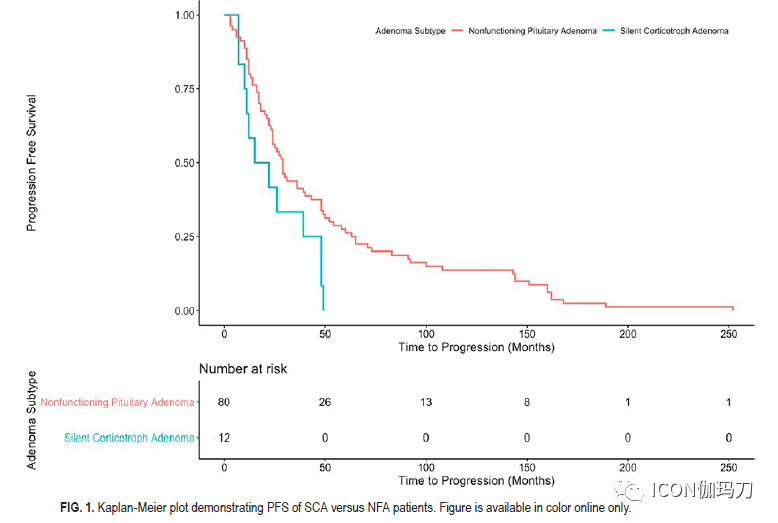
与NFA队列相比,SCA队列表现有颅神经障碍(13% vs 5.7%, p = 0.0051)和头痛(53% vs 42.3%, p = 0.042),尽管卒中发生率相似。SCA队列包括更高比例的女性(SCA 60% vs NFA 45.8%, p = 0.0071)和较年轻的发病年龄(SCA 50.5±13.3 vs NFA 54.6±14.9,p = 0.0082)。除了NFA患者术前全垂体功能低下发生率较高(分别为2% vs 6.1%;p = 0.0033),再手术率在队列之间具有可比性(SCA 16% vs NFA 15.7%, p = 0.98)。SCA患者的平均肿瘤直径为24±10.8 mm,而NFA患者为26±11.3 mm (p = 0.05)。SCA组海绵窦侵袭发生率较高(56% vs 49.7%),虽然这一结果没有达到统计学意义。两组在切除范围、术中脑脊液漏发生率、内分泌或神经系统结果以及术后并发症方面都无显著差异。SCA组Ki-67率(2.88±2.79)显著高于NFA组(1.94±1.99)(p = 0.015)。尽管在总体进展或复发率方面没有差异,但SCAs无进展生存期明显较低(24.5月vs 51.1个月,p = 0.0011)。在SCA队列中,33% (n = 4/12)接受治疗的肿瘤尽管接受了辅助放射外科,但仍出现进展。尽管进行了放射外科或多次手术切除,但仍有SCA进展队列的一半患者(n = 6)没有获得充分的肿瘤控制。
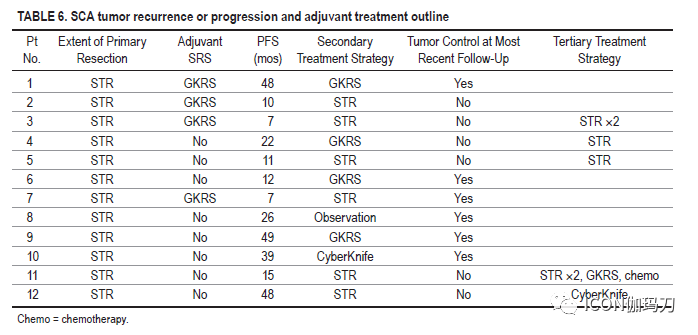
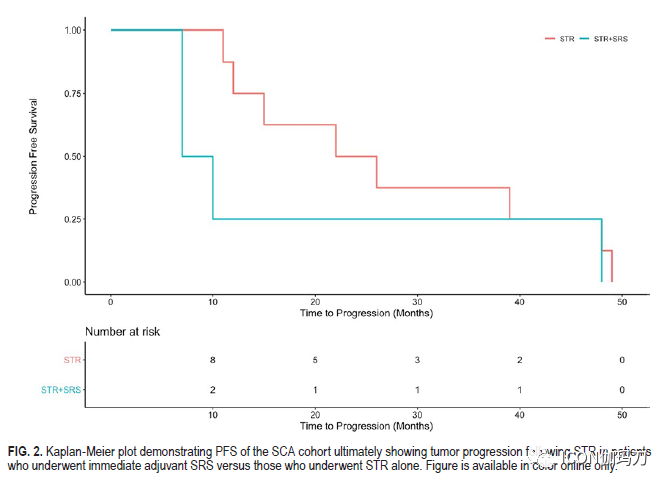
对所有接受二次手术的患者中,采用经蝶窦入路,并再次行STR手术。基于多学科会议,5名有进展的患者被推荐接受伽玛刀(GammaKnife)放射外科(GKRS;n = 4;患者1、4、6和9)或射波刀(CyberKnife)放射外科(n = 1;病人10)。在第二种形式的干预后,有进展的队列中的一半(n = 6)(患者1、6、7、8、9和10)患者的肿瘤得到了控制。这一组包括大多数(n = 4)接受放射外科进行肿瘤控制的患者,1例接受第二次STR治疗,1例接受观察。在这些患者中,尽管进行了第二种形式的干预,但仍有肿瘤进展,5例患者转诊进行了重复切除术(患者3、4、5和11),1例患者转诊进行了射波刀放射外科(患者12)。患者3继续进展,最终接受第四次切除术。患者11接受了两次进一步的切除术和伽玛刀(GKRS),最终使用替莫唑胺成功地抑制了病情进展。尽管进行了第二次切除,但患者2在病情进展后失访。SCA患者接受STR后立即辅助放射外科的PFS与单独STR相比无显著差异(p = 0.25)。SCA队列的进展和处理总结见表6和图2。
讨论
我们报告一个大型回顾性SCA患者队列与时间匹配的NFA患者队列比较的结果。我们的研究结果表明,SCAs是相对进袭性垂体腺瘤,具有较高的肿瘤进展倾向。这些数据证实了以前的研究结果,为使用SRS对残留SCA疾病进行更积极的干预提供了支持,特别是在年轻患者中。我们的研究结果与之前的研究结果一致,与NFA患者相比,SCA患者年龄较小,女性比例更高。这些队列之间可区分的临床差异是,在SCA队列中颅神经麻痹或头痛的发生率更高,闭经的发生率较高,起病时年龄较小,女性多见,而在NFA队列起病时全垂体功能低下的发生率较高。许多研究已经得出结论,在起病时肿瘤大小没有显著差异。虽然我们的结果接近有显著性(at the verge of significance)(p = 0.05),但它们至少提示了一种趋势,即在起病时,小虽然两者均为大腺瘤,SCA倾向于比NFA。尽管最近世界卫生组织根据转录因子对垂体腺瘤进行分类的标准是,TPIT对应于促肾上腺皮质激素细胞系,但仍缺乏大量令人信服的数据显示这些因子与临床行为之间的关联。同样,我们也没有转录因子数据来描述WHO新标准定义的现代零细胞腺瘤,这可能意味着在我们的NFA队列中存在一定程度的异质性。虽然我们的队列中缺乏转录因子分析数据,但通过几十年的随访和与(根据免疫组化结果分类)非SCA的 NFA队列的比较,仍然阐明了许多与SCA的临床和生物学行为相关的重要发现。正如跨越几十年的许多病例系列一样,我们最喜欢的手术方法已从显微外科过渡到内镜技术。此外,各组间发生术后神经功能障碍、内分泌失调或其他并发症的发生率相似。
任何关于SCA管理的讨论都必须集中在临床进袭性和复发/进展的风险上。首先通过对进袭性肿瘤的病例报告引起了对SCAs的注意。我们未能证明SCAs和对应的NFA之间的复发率或进展有差异。然而,有趣的是,SCA人群中在PFS方面的显著对比(striking contrast)。接受STR的SCA显示的PFS不到NFA人群的PFS的一半。此外,研究表明,SCAs更有可能侵袭海绵窦,合并估计在25%到40%之间。海绵窦侵袭估计可使进展的可能性增加3倍。我们的研究结果表明,海绵窦侵袭可能比预计的更为常见,本系列SCA肿瘤中有56%表现为海绵窦侵袭,虽然这与NFA队列相当。STR后的肿瘤进展主要是海绵窦受累,通常排除大体全切除(GTR)。然而,越来越多的证据表明,SCA在分子水平上具有更强的生物活性,增加了其观察到的进袭性和较快的复发或进展倾向。
一项研究根据ACTH染色程度将SCA患者分为两组。I型的ACTH呈弥散性阳性,与库欣病相似,而II型的ACTH染色程度较轻,主要发现包括与NFA相比,SCA I型和II型中促肾上腺皮质激素(ACTH的前体)阿黑皮素原(proopiomelanocortin ,POMC)水平升高。此外,与库欣病腺瘤相比,SCA缺乏负责POMC裂解成ACTH的酶PC1/3,尽管I型SCA相对于II型SCA高10倍。I型SCA倾向于表现出更进袭的临床过程,少数最终发展为库欣病。SCA相对具有进袭性的另一种可能解释是由于错配修复基因mutS同源6/2 (MSH6/2)和程序性细胞死亡配体1 (PD-L1)的表达。Uraki等比较了MSH6/2与肿瘤增殖和侵袭性相关的隐性腺瘤亚型的表达谱。Knosp 1级和2级被认为是无侵袭性的,而3级和4级被认为是有侵袭性的。与NFA或其他沉默性腺瘤亚型相比,SCA表现出显著较少的MSH6/2表达,这可能说明了其观察到的级进袭性行为的分子驱动因素。在我们的研究中,12%的SCA患者经历了中位时间24.5个月的进展。这些结果低于随访时间相当的文献中描述的其他大型SCA病例系列。在加州大学旧金山分校的系列研究中,在29个月的时间里,观察到27%的SCA肿瘤出现进展。同样,在Emory系列研究中,47%的病例在36个月的时间内观察到SCA出现进展。在这种情况下,术后密切监测肿瘤状态就变得至关重要。我们医院在一个多学科会议上进行了初步讨论,讨论进一步的切除术与放疗。根据肿瘤的形态和与视交叉和垂体的关系,年轻患者的大的、结节性的部分通常被转诊进行再次切除术,并经常为计划的SRS治疗调整术后靶区。我们很少在第二次干预失败后使用化疗药物,尽管在这个系列中有一例患者需要替莫唑胺。
最近的报道集中在切除后复发的SCA进行辅助放射治疗和放射外科治疗。虽然一些患者在辅助放疗后的复发率显著下降,但其他患者在结果上没有发现差异。的确,一份报告发现接受过放射治疗的病人复发率增加。其他人提出GTR后不需要放疗。我们同意这一观点,因为我们的SCA患者在经历GTR后没有出现复发。在STR后进展的SCA队列中,4例(33%)患者接受了辅助放射外科,但仍未能实现肿瘤控制。对于无法获得GTR的患者,我们医院的实践在多学科达成共识后保留了辅助放疗,特别是对有广泛的海绵窦受累者或术后影像学上有明显肿瘤再生长的患者。在初次STR后的情况下,对术后MRI扫描、肿瘤病理和标志物以及人口统计学特征进行多学科综述。对于具有ACTH阳性、Ki- 67标记指数高、海绵窦侵袭、年龄较轻、患者偏好等特点的进袭性肿瘤,在决定是否对肿瘤残余进行辅助放射外科治疗或对进展进行连续监测时,都要考虑到这些因素。我们修改了我们的实践,为SCA患者,特别是年轻患者,的残留疾病提供早期SRS治疗。在连续监测的情况下,新的体征或症状提示要早期成像和随访。患者教育在SCA患者的成功管理中起着关键作用。讨论呈现的症状和复发的风险是重要的,以促进患者的依从性和密切的随访。
研究的局限性:
目前研究的局限性包括作为单中心的回顾性队列分析,这是其固有的偏倚。此外,我们通过免疫组化染色对SCA进行了诊断,但没有按照最新指南的描述评估TPIT的表达,因为这不是研究开始时的标准做法。由于最初的经验是在常规分子检测之前,我们的手术队列中有相当一部分患者缺乏表达谱,这些数据将被纳入未来的研究中。SCA组的随访时间较NFA组短;然而,考虑到我们的观察,SCA倾向于有较低的PFS,这是一个较小的局限性。最后,我们的医院不定期筛查无库欣病特征的患者。虽然我们对筛查保持一个较低的门槛,但在缺乏临床库欣特征的情况下,我们保留了这种检测。由于SCAs本质上是静默的,这些患者缺乏库欣病的特征,表现更类似于NFA患者,表现为传统上由肿块占位效应(头痛、视觉障碍)引起的症状,表现为大腺瘤而非微腺瘤。
结论
静默性促肾上腺皮质激素细胞腺瘤(SCA)由一组独特的NFA组成。由于它们的发病率相对较低,目前缺乏足够的数据来指导对疾病进展或复发患者的管理,特别是涉及转录因子分析的情况。我们的手术系列是对单中心治疗的SCAs进行的最大的回顾性回顾,并证实了先前的研究结果,即与NFA相比,SCAs表现出更进袭的临床过程。特别是,次全切除术(STR)后的SCAs显示无进展生存率(PFS)明显降低。因此,对所有SCAs都应严格分析,以确保切除后正确的组织病理学诊断。此外,在疾病残留和/或有进展的病例中,尤其在较年轻的患者中,应尽早考虑进行SRS治疗。所有SCAs患者都应进行密切的长期随访。
在这项研究中,据作者所知,迄今为止评估SCAs预后的最大手术系列,结果表明SCAs比标准NFA具有更强的生物学的进袭性(biologically aggressive )肿瘤。SCAs患者的无进展生存期仅为其他NFA患者的一半左右。因此,对SCAs患者进行密切的神经影像学和临床随访是必要的,特别是年轻患者,对其残留病变应考虑术后早期开展辅助放射外科治疗。
END




