提示
“浙二神外周刊”不定期接收外院投稿,审核后发表。欢迎各专业同道联系我们,分享精彩病例、研究热点或前沿资讯。投稿请联系:shishi74@163.com
神经肿瘤是颅内常见病,主要包括神经上皮肿瘤、脑膜瘤、转移瘤及淋巴瘤等。自279期开始刊发神经肿瘤系列,与同道共享,欢迎大家批评指正和交流讨论。
病史简介
患者女,42岁,因“头痛头晕一周”于2021年1月26日入院。
患者一周前无明显诱因下出现头痛、呈持续性胀痛,伴头晕。无恶心呕吐、行走不稳、感觉变化。患者当地医院就诊,查头颅CT示:左顶枕叶颅内占位伴出血。为进一步治疗来浙大二院就诊。门诊拟:“左侧顶枕叶颅内占位伴出血”收治入院。
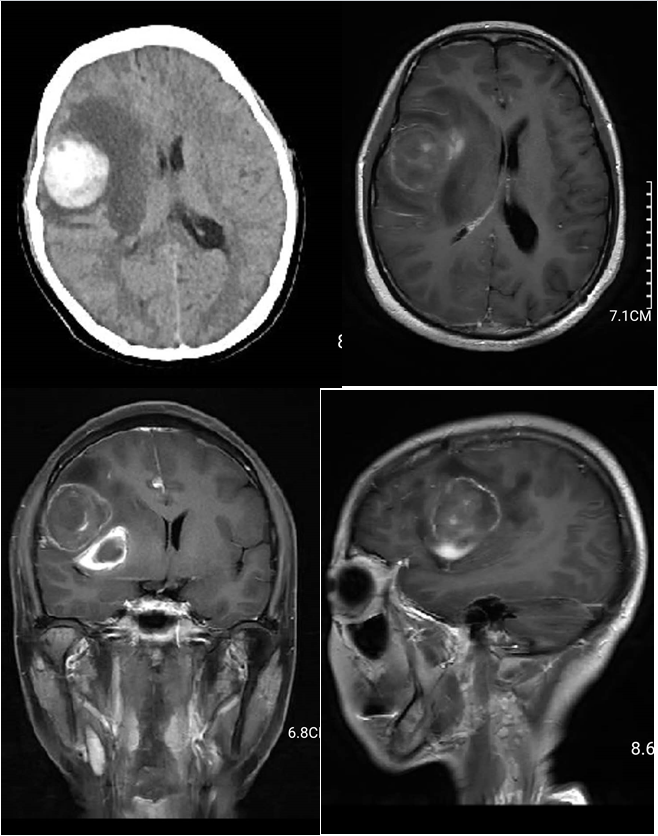
既往病史:体检发现肝内多发病灶,穿刺活检提示上皮样血管内皮细胞瘤,未做手术或放化疗等进一步治疗。入院查体:神志清,精神可,瞳孔等大等圆,对光反射灵敏,颅神经检查未见异常,四肢肌力V级,肌张力不高,右下肢感觉减退,双侧病理征未引出。入院查头颅CT及增强MRI提示:双侧大脑半球多发占位,考虑转移瘤,左顶较大病灶伴出血(图1)。胸部CT提示:两肺多发转移瘤;胸7椎体转移性骨质破坏。腹部CT检查提示:肝内大片低密度灶,请结合临床病史及肝脏增强检查;左侧髂骨及右侧坐骨骨质破坏,考虑转移;宫腔少许积液;盆腔积液。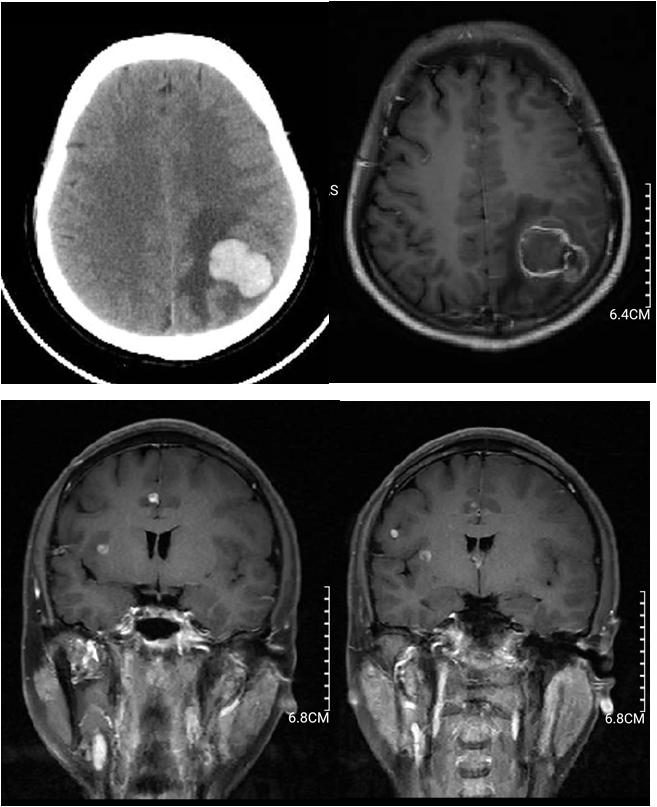
图1. 术前头颅CT及MR增强检查,显双侧大脑半球多发占位,考虑转移瘤,较大病灶伴出血。
实验室检查:血常规、血生化、肿瘤标记物等未发现明显异常。术前科室讨论:患者有头痛头晕及肢体感觉减退等症状,颅内多发病灶,左侧顶枕部病灶较大并有出血,建议行左侧顶枕部病灶切除术。遂于2021年1月29日行“开颅左侧顶枕部病灶切除术”。手术经过顺利,术后无新发神经功能障碍。术后复查头颅CT及MR增强显示肿瘤切除满意(图2)。
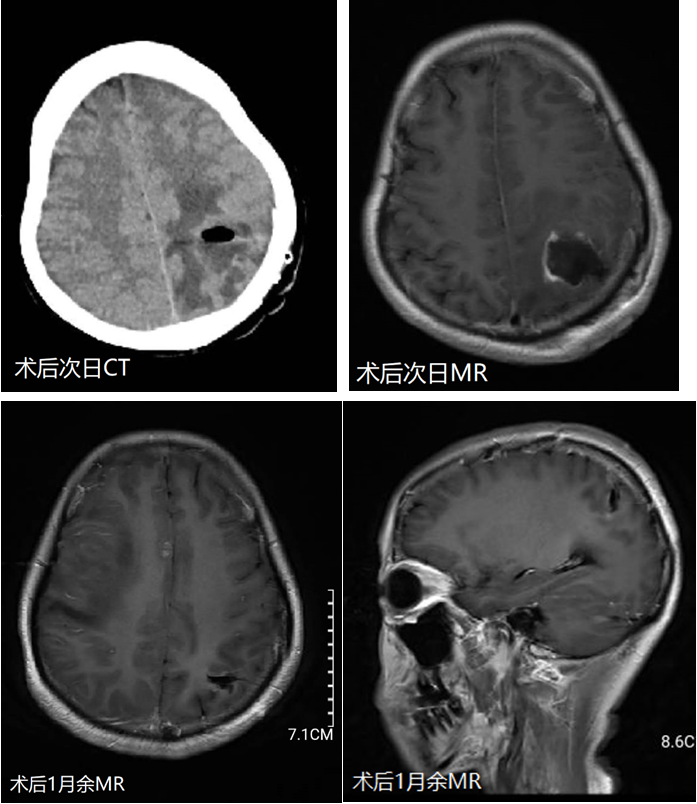
图2. 术后复查头颅CT及MRI,未见术区残余肿瘤。
术后病理回报:(左顶枕叶)见血湖及大片坏死,小血管增生,瘤细胞交织呈条索状、网状排列,结合患者病史,考虑上皮样血管内皮瘤(图3)。
免疫组化结果:CK-,CD34+,CD31+,ERG+,SSTR2+,EMA-,PR-,Ki67 10-20%,P53个别+。
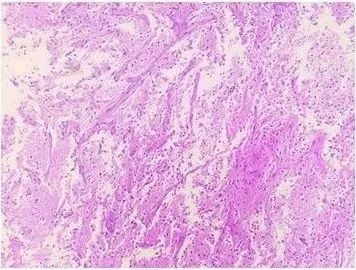
图3. 病理切片镜下形态。
术后患者一般情况良好,无新发神经功能障碍。浙大二院放疗科会诊,告知病情,放疗或化疗等治疗方案及可能效果。患者考虑暂不放疗或化疗,回家休养。
术后约1月余,患者再次出现头痛头晕。无恶心呕吐、行走不稳、感觉变化。再到当地医院就诊,头颅CT及MR提示:右侧颞叶占位伴出血。考虑患者以上手术史,门诊拟:“颅内多发占位,左侧顶枕叶肿瘤术后,右侧颞叶占位伴出血”收治入院。入院后查头颅CT及MR影像提示:颅内多发占位,左侧顶枕叶肿瘤术后,右侧颞叶占位伴出血(图4)。
图4. 第2次手术前头颅CT及MR增强影像。
2021年4月5日,再次开颅手术,切除右侧颞叶病灶。
术后病理诊断:(右颞)粘液玻璃样变的基质中见上皮样细胞,呈中度多形性,核圆形、卵圆形,包浆中等量至丰富,周围脑组织见陈旧性出血、小血管增生,结合免疫组化及病史,符合转移性上皮样血管内皮瘤(图5)。
免疫组化结果:GFAP-,Olig2-,CD68背景+,CD163-,S-100-,SOX10-,ERG+,CK-,CD34+,CD31+,CAM5.2+,TFE3-。
美国UCLA病理会诊诊断:恶性肿瘤,肿瘤细胞 CD31和ERG阳性,CD34局灶阳性。符合上皮样血管内皮瘤的病史。
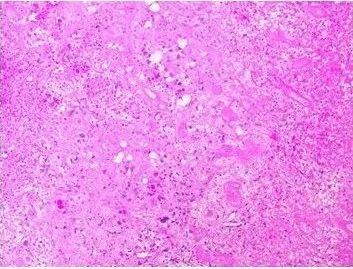
图5. 第2次手术后病理切片镜下形态。
术后患者一般情况良好,无新发神经功能障碍,复查CT及MR为术后改变(图6)。经放疗科会诊及家属商议后确定进一步放、化疗。
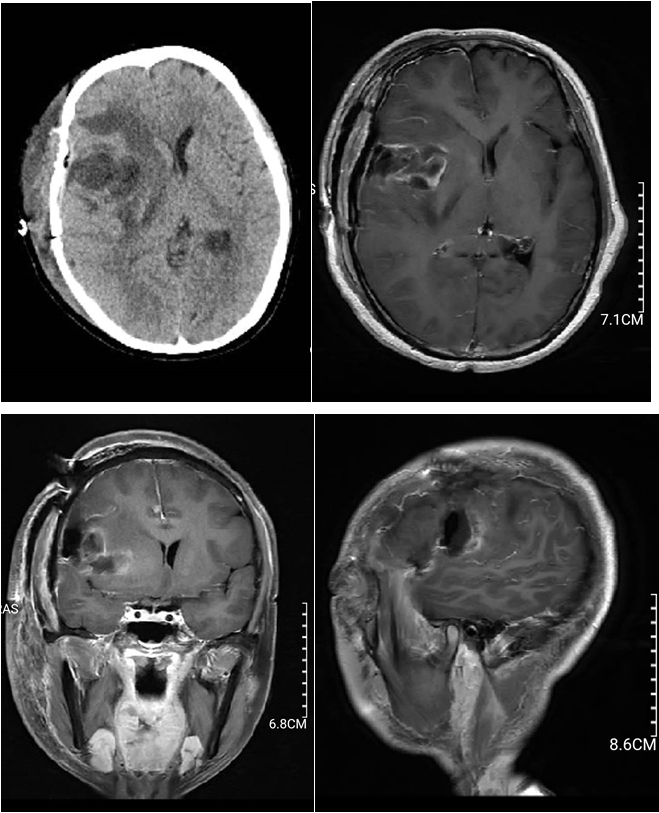
图6. 术后复查头颅CT及MRI肿瘤基本全切。
讨论
本例颅内多发病灶患者,根据病史及手术病理,确诊为上皮样血管内皮细胞瘤。有关颅内多发病灶的诊断和鉴别诊断,“浙二神外周刊”(第109期——颅内多发病变之多发性硬化一例)曾对颅内多发占位性病变的鉴别诊断进行了详细的描述。
上皮样血管内皮细胞瘤(epithelioid haemangioendothelioma,EHE)是一种罕见的血管源性肿瘤,其生物学行为和组织病理学介于血管瘤与血管肉瘤之间[1]。该肿瘤好发于四肢浅表和深部软组织,部分病例可发生于实质样器官,如肺、肝、甲状腺、脾脏、乳腺、胃肠道,其中发生于肺和肝脏者可呈多中心性,原发于颅内者更为罕见[2,3]。根据肿瘤细胞形态,血管内皮瘤分为4种类型,即上皮样型,梭形细胞型,乳头状型和Kaposi型,目前仅上皮样血管内皮瘤见于中枢神经系统[4]。2002年世界卫生组织(WHO)软组织肿瘤分类中,上皮样血管内皮细胞瘤属恶性脉管肿瘤。2007年WHO中枢神经系统肿瘤分类将上皮样血管内皮细胞瘤归于边缘性肿瘤,生物学行为属交界性或不确定性肿瘤。2016年WHO中枢神经系统肿瘤分类又将其重分类为WHO III级[1]。
上皮样血管内皮细胞瘤的主要病理学特征:(1)具有嗜酸性胞质的上皮样细胞;(2)瘤细胞排列成小巢状、索状或单个细胞侵入黏液性基质中;(3)超微结构具有吞饮小泡和内皮细胞基板及特征性Weibel-Palade小体;(4)免疫组织化学检测有内皮细胞标志物CD31、CD34、FⅧ和UEA21阳性反应[5]。
颅内上皮样血管内皮细胞瘤的临床表现主要与肿瘤部位相关,额叶、颞叶和顶叶是最常见的原发部位。临床表现一般无明显特异性,常以头痛、头晕、肢体乏力、恶心、呕吐等症状就诊[6,7]。
颅内上皮样血管内皮细胞瘤的影像学特点:CT平扫大多数因瘤内出血表现为高密度,肿瘤实质部分可呈等密度,周围低密度水肿影,增强后明显强化。MRI检查可以清楚显示肿瘤的范围,信号特点因出血产物的不同而表现各异。其T1、T2可以表现为低、等或高信号,增强后强化明显。还可见瘤内多个流空信号或条索状血管影像,提示血供丰富。部分瘤内可有囊变。DSA检查可见肿瘤由颅内、外血管双重供血,但以颅外动脉供血为主[8]。
颅内上皮样血管内皮细胞瘤需与其他颅内肿瘤相鉴别,如黏液样软骨肉瘤、脊索样脑膜瘤、心房黏液瘤颅内转移及其他颅内血管性肿瘤(上皮样血管瘤、血管周细胞瘤、血管母细胞瘤)。还需与其他颅内多发肿瘤鉴别,包括胶质瘤、淋巴瘤、转移瘤、生殖细胞瘤等。上述肿瘤均不表达内皮细胞标志物,可资鉴别。本例患者因颅内占位伴出血就诊,因既往有肝脏穿刺活检病理诊断,故术前颅内多发病灶首先考虑为上皮样血管内皮细胞瘤。术后病理也证实符合上皮样血管内皮细胞瘤的表现。
关于治疗上,由于疾病罕见,没有统一的治疗标准。目前手术切除仍是颅内上皮样血管内皮细胞瘤的首选治疗方法[9]。由于该肿瘤具有侵袭性生长和术后易复发的特点,应尽可能全切除肿瘤。对于术后残留肿瘤或无法切除的肿瘤可行辅助放疗和化疗[10]。有研究证实,术后辅助放疗,能延长影像学及临床复发时间,改善患者的预后[11]。也有使用卡铂加依托泊苷方案化疗,肿瘤完全缓解的报道[12]。然而这些疗效仍未得到完全证实。本例患者为颅内多发病灶,且患者肝脏内多发病灶不能手术切除,故后续拟进一步辅助放射治疗和药物化疗治疗。
综上所述,颅内上皮样血管内皮细胞瘤临床罕见,主要依靠病理明确诊断。由于肿瘤性质和细胞特异性,常规放射治疗并不敏感,也没有证实确定有效的化疗药物,因此,早期诊断和尽量手术全切仍是最佳治疗方法,预后不确定。对于多发和无法全切的病灶,可考虑辅助放射治疗和药物化疗治疗,但预后可能不佳。
[1] Rosenberg A, Agulnik M. Epithelioid Hemangioendothelioma: Update on Diagnosis and Treatment[J]. Curr Treat Options Oncol. 2018 Mar 15;19(4):19.doi: 10.1007/s11864-018-0536-y.
[2] Zheng J, Liu L, Wang J, et al. Primary intracranial epithelioid hemangioendothelioma: a low-proliferation tumor exhibiting clinically malignant behavior[J]. J Neurooncol. 2012 Oct;110(1):119-27.doi: 10.1007/s11060-012-0945-x[3] 米寅,刘宇琼,董美莲,等. 颅内上皮样血管内皮瘤一例报告并文献复习[J]. 中华肿瘤防治杂志,2020,27(7):566-571. doi:10.16073/j.cnki.cjcpt.2020.07.12.[4] 方军超,苏少波,孙翠云,等. 颅内上皮样血管内皮瘤二例报告并文献复习[J]. 中国现代神经疾病杂志,2015,15(9):746-751. doi:10.3969/j.issn.1672-6731.2015.09.012.[5] Parajon A,Vaquero J.Meningel intraeranial epithelioid heman gioendothelioma:case report and literature review. J Neuroorte01.2008.88:169.173.[6] 刘运炜,胡明斌,余念祖,等. 原发性中枢神经系统上皮样血管肉瘤1例[J]. 南昌大学学报(医学版),2020,60(4):104-106.doi:10.13764/j.cnki.ncdm.2020.04.023.[7] 刘清,幺立萍,谢华红,等. 肝上皮样血管内皮瘤临床特征分析[J]. 疑难病杂志,2020,19(9):917-920.doi:10.3969/j.issn.1671-6450.2020.09.013.[8] 丁勇,钱忠,心叶树,等. 颅内上皮样血管内皮细胞瘤1例报告[J].中华神经诶ing外科疾病研究杂志, 2012,11(1). [9] Tsuchiya T, Oya S, Mori H, et al. Multiple hemorrhagic intraparenchymal tumors spansenting with fatal intracranial hypertension: A rare manifestation of systemic epithelioid hemangioendothelioma. Surg Neurol Int. 2015 Oct 6;6:156.doi: 10.4103/2152-7806.166799. [10] Rosenbaum E, Jadeja B, Xu B, et al. Prognostic stratification of clinical and molecular epithelioid hemangioendothelioma subsets. Mod Pathol. 2020 Apr;33(4):591-602.doi: 10.1038/s41379-019-0368-8.[11] Drazin D, Gandhi R, Boulos AS, et al. Epithelioid hemangioendothelioma of the mastoid: resection for recurrence and adjuvant radiation with 8-year follow up. Case Rep Surg 2013;2013:469201.[12] Pinet C, Magnan A, Vervloet D, et al. Aggressive form of pleural epithelioid hemangioendothelioma: complete response after chemotherapy. Eur Respir J 1999;14:237-8.(本文由浙二神外周刊原创,浙江大学医学院附属第二医院周珂人主治医师整理,徐锦芳副主任医师审校,张建民主任终审)