
脑膜瘤是最常见的原发性中枢神经系统肿瘤,约占所有颅内肿瘤的三分之一。脑膜瘤根据世卫组织分型可以分为三级15个亚型,其中透明细胞脑膜瘤是脑膜瘤的一种罕见亚型。透明细胞脑膜瘤的组织学特点是由片状圆形或多边形的透明细胞及其周围的血管和间质胶原组成[1]。透明细胞脑膜瘤的侵袭性较强,复发率和死亡率较高[2],因此被归类为世界卫生组织(WHO)II级肿瘤[1]。透明细胞脑膜瘤患者具有比较特殊的临床特征,其发病年龄较低,女性倾向较高,位置多偏向于脊髓[3]。近年来,有关透明细胞脑膜瘤的分子遗传学特征正逐步被揭露,在其他脑膜瘤中常见的NF2突变在该亚型中很少见[4],反而编码SWI/SNF染色质重塑复合体的一个亚单位BAF57的SMARCE1基因的功能缺失突变在透明细胞脑膜瘤中频繁被报道[3,5]。尽管如此,有关透明细胞脑膜瘤的分子致病机制还缺乏全面的分子研究,透明细胞脑膜瘤是否仅仅是一种形态变异在原则上是否可以和SMARCE1突变联系起来仍不清楚。本文将为大家详细介绍SMARCE1胚系突变在透明细胞脑膜瘤中的研究进展。
01
SMARCE1分子的结构与功能:
SWI/SNF染色质重置复合物最初在酵母中被发现,它可以通过ATP以来的核小体破坏活性来促进转录因子与核小体模板的结合从而发挥转录激活作用[6]。SMARCE1(BAF57)是SWI/SNF复合物的一个亚基,它存在于所有的高等真核生物的SWI/SNF复合物中,但不存在于酵母中。SMARCE1可以与雌激素及雄激素受体相互作用,从而在类固醇反应中被招募到核受体靶点参与并调节核受体功能[7]。
SMARCE1的预测分子质量为47KDa,由411个氨基酸组成,其分子结构包含一个与DNA非特异性结合的高迁移率基因结构域(HMG)和一个类动蛋白螺旋结构域(KLCC domain),还有N末端富含脯氨酸的区域和C末端富含酸性残基的区域[8]。其中HMG结构域与DNA具有很强的结合活性,该结构域具有明显的弯曲,可以四向连接DNA,所以被认为是核小体的进出口点[9]。然而有研究表明,SWI/SNF复合物可以独立于BAF57与DNA结合,这意味着它可能在BAF复合物结合或脱离核小体的时候起到拓扑作用,或者该HMG结构域可以在SWI/SNF复合物识别靶的过程中提供额外的特异性,从而介导复合物与转录因子之间的相互作用[8]。SMARCE1蛋白的KLCC结构域及N末端富含脯氨酸的区域和C末端富含酸性残基的区域对SMARCE1蛋白参与SWI/SNF复合物的组装发挥重要的作用[10]。
SMARCE1蛋白对生物的发育有一定的影响,它可促进T细胞的发育与成熟过程,SMARCE1功能丧失可能导致CD4受体表达增加,CD8受体表达抑制[11]。SMARCE1还与骨骼肌的分化及细胞肌源性表达有关,SMARCE1蛋白可与肌肉卫星细胞(SCs)表达的转录抑制因子Teashirt-3(TSHZ3)合作调节MYOD活性以控制骨骼肌分化[12]。另外SMARCE1蛋白可抑制神经元特异基因在非神经组织中的表达,在非神经组织中,SMARCE1与co-rest相互作用招募BAF复合体,并与靶启动子的阻遏因子1(RE1)结合,从而抑制神经元特异性基因的表达在组织中的表达[13]。
在细胞周期的调控过程中,SMARCE1也发挥不可或缺的作用,SWI/SNF复合物可在细胞周期中作为细胞增殖的促进者或抑制剂,其具体功能受到特定环境或特定亚基调控的影响[14,15]。SMARCE1也可激活雌雄激素受体,募集SWI/SNF复合物到核内发挥作用。而且SMARCE1蛋白的含量是被严格控制的,自由或过量的BAF57可能会干扰BAF复合体的招募,并引发不想要的或显性负面效应,可能导致激素反应的不稳定或细胞生长障碍。
02
SMARCE1基因突变在肿瘤中的作用:
SMARCE1与肿瘤抑制和发生相关性不大,但它参与了雌激素驱动的致癌途径,在临床上偶尔与乳腺癌表型有关。SMARCE1基因突变最先在BT549细胞系中发现,它可通过上调CYLD(家族性圆柱瘤病)基因的表达,来诱导细胞凋亡[15]。在后续的相关研究中检测到一例乳腺癌细胞中的两个SMARCE1基因突变(BAF57BCMUT-A和BAF57-BCMUT-B),并产生两个截断蛋白,这两种突变蛋白不易被蛋白酶体降解,可以在COS-1和MCF-7细胞系中增强ER、AR介导的转录过程,促进细胞增殖,也可以与转录因子ETS2作用,调控BRCA1在MAF-7细胞中的表达[16]。
SMARCE1基因突变可能与较差的肿瘤预后相关。在乳腺癌中SMARCE1基因可通过调节降解基底膜的蛋白酶的表达来驱动原位癌的侵袭和转移[17]。SMARCE1表达的上调在前列腺癌中可能代表着更高的肿瘤分级,预后更差,在CRPC细胞中,SMARCE1可以在雄激素调控缺乏的情况下取代雄激素诱导AR靶基因的表达,这可能与肿瘤细胞的侵袭与转移相关,且其促进转移的机制与HIFIA和VEGF(血管内皮生长因子)无关。子宫内膜癌核型SMARCE1的高表达也预示着较差的预后,研究表明核型SMARCE1低表达患者的生存率明显好于核型SMARCE1高表达的患者[18]。
SMARCE1与肿瘤的药物敏感性也有关系。在卵巢癌中,SMARCE1水平越高,肿瘤细胞对顺铂、阿霉素和5-氟尿嘧啶的敏感性就越低[19]。在NSCLC中,SMARCE1的表达缺失可直接或通过下调CBX2基因表达抑制多梳复合体(PRC1)的表达,引起表皮生长因子受体(EGFR)表达增加,使肿瘤细胞对受体酪氨酸激酶受体(ALK/MET)抑制剂的敏感性降低[20]。
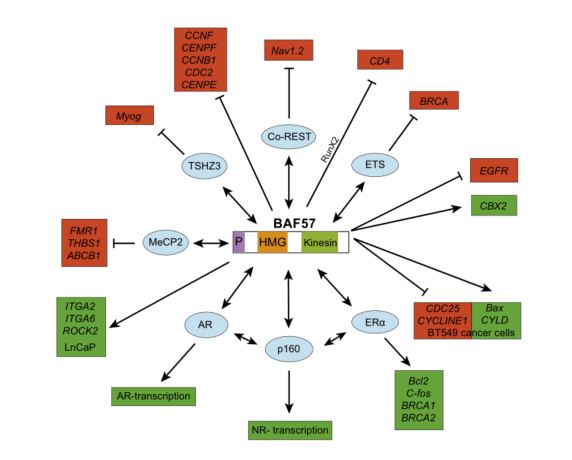
图1. SMARCE1蛋白的分子结构及功能。(引自图Lomeli, H. & Castillo-Robles, J. The developmental and pathogenic roles of BAF57, a special subunit of the BAF chromatin-remodeling complex. FEBS Lett 590, 1555-1569, doi:10.1002/1873-3468.12201 (2016))
03
SMARCE1基因突变在透明细胞脑膜瘤中的研究:
Smith, et al. [3]在家族性脊髓脑膜瘤中发现了SMARCE1的胚系功能缺失突变,在后续的研究中发现该突变在颅内透明细胞脑膜瘤中同样存在[5]。而且SMARCE1突变似乎仅限于这种特殊的表观遗传学类型的透明细胞脑膜瘤[21]。由于SMARCE1基因编码SWI/SNF复合体的一个亚单位BAF57,而SWI/SNF复合物已被证明在肿瘤发生中起着广泛的作用[22,23],因此目前普遍认为SMARCE1是透明细胞脑膜瘤的潜在致癌驱动因子[3]。Smith, et al. [4]在对10位CCM患者的基因检测中,区分出了其中的2名其他类型脑膜瘤,确定了SMARCE1突变筛查在辨别透明细胞脑膜瘤和其他组织类型中的作用。后续Tauziede-Espariat, et al. [21]对12个CCM肿瘤进行免疫组化和基因筛查,并对305个其他脑膜瘤和15个非脑膜瘤透明细胞神经系统肿瘤进行SMARCE1染色,确定了SMARCE1表达缺失在CCM中的敏感性和特异性,可作为辅助诊断的手段,这也对临床上诊断透明细胞脑膜瘤有很大的帮助。既往研究发现携带SMARCE1突变的透明细胞脑膜瘤患者的临床特征也与其他类型脑膜瘤不同,其通常以儿童和年轻人为好发人群,肿瘤位置多发于椎管内,并且似乎更易形成多发脑膜瘤[21],但由于其样本量较少,其临床特征还需要进一步的数据支持。
在最近的一篇研究中,通过对42例透明脑膜瘤患者进行DNA甲基化和表观遗传学分析后发现该亚型脑膜瘤存在一个非常显著不同的表观遗传学特征[24],鉴于先前在多种肿瘤类型中关于肿瘤表观基因组中起源细胞印记的研究[25-27],特征性的表观遗传学结果常常表明这些肿瘤起源于不同于其他脑膜瘤亚型广谱的前体细胞群体。然而有意思的是,在其他具有特征性改变的脑膜瘤亚型中,NF2,TRAF7/KLF4、BAP1等基因突变和YAP1融合都没有形成相同程度上截然不同的表观遗传学特征[28,29],这可能是由于SMARCE1本身是一个广泛的表观遗传调节因子,从而导致 SMARCE1突变的脑膜瘤DNA甲基化特征与其他脑膜瘤如此不同。
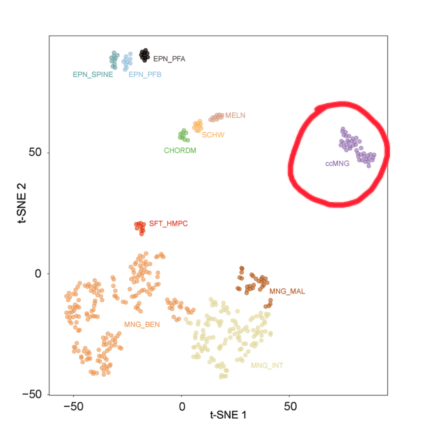
图2. 透明细胞脑膜瘤的DNA甲基化图谱。ccMNG(透明细胞脑膜瘤)(引自图Sievers, P. et al. Clear cell meningiomas are defined by a highly distinct DNA methylation profile and mutations in SMARCE1. Acta Neuropathol 141, 281-290, doi:10.1007/s00401-020-02247-2 (2021))

总结
透明细胞脑膜瘤是比较罕见的脑膜瘤亚型,其发病率低,但死亡率和复发率较高,目前除手术和放疗外还没有有效的治疗手段。近年来发现透明细胞脑膜瘤潜在的致病基因为胚系SMARCE1基因突变,且其表观遗传学特征表现与其他类型脑膜瘤截然不同,这可能预示透明细胞脑膜瘤的前体来源细胞与其他类型脑膜瘤不同,这还需要我们进一步的研究证实。从目前的数据来看,透明细胞脑膜瘤的女性倾向强烈、常出现在椎管内,且有多发倾向,但由于其样本量较少,我们还不能确定其较为准确的流行病学特征。随着我们对透明细胞脑膜瘤流行病学特征、分子致病机制和潜在治疗靶点进一步的研究,我们有望在不久的将来对透明细胞脑膜瘤的治疗制定更完善的方案。
参考文献
1 Komori, T. The 2016 WHO Classification of Tumours of the Central Nervous System: The Major Points of Revision. Neurol Med Chir (Tokyo) 57, 301-311, doi:10.2176/nmc.ra.2017-0010 (2017).
2 Zorludemir, S. et al. Clear cell meningioma. A clinicopathologic study of a potentially aggressive variant of meningioma. Am J Surg Pathol 19, 493-505 (1995).
3 Smith, M. J. et al. Loss-of-function mutations in SMARCE1 cause an inherited disorder of multiple spinal meningiomas. Nat Genet 45, 295-298, doi:10.1038/ng.2552 (2013).
4 Smith, M. J. et al. SMARCE1 mutation screening in classification of clear cell meningiomas. Histopathology 70, 814-820, doi:10.1111/his.13135 (2017).
5 Smith, M. J. et al. Germline SMARCE1 mutations predispose to both spinal and cranial clear cell meningiomas. J Pathol 234, 436-440, doi:10.1002/path.4427 (2014).
6 Hirschhorn, J. N., Brown, S. A., Clark, C. D. & Winston, F. Evidence that SNF2/SWI2 and SNF5 activate transcription in yeast by altering chromatin structure. Genes Dev 6, 2288-2298, doi:10.1101/gad.6.12a.2288 (1992).
7 Lomeli, H. & Castillo-Robles, J. The developmental and pathogenic roles of BAF57, a special subunit of the BAF chromatin-remodeling complex. FEBS Lett 590, 1555-1569, doi:10.1002/1873-3468.12201 (2016).
8 Wang, W. et al. Architectural DNA binding by a high-mobility-group/kinesin-like subunit in mammalian SWI/SNF-related complexes. Proc Natl Acad Sci U S A 95, 492-498, doi:10.1073/pnas.95.2.492 (1998).
9 Wattler, F., Wattler, S., Kelly, M., Skinner, H. B. & Nehls, M. Cloning, chromosomal location, and expression analysis of murine Smarce1-related, a new member of the high-mobility 365 group gene family. Genomics 60, 172-178, doi:10.1006/geno.1999.5913 (1999).
10 Lee, Y. M., Shin, H., Choi, W., Ahn, S. & Kim, W. Characterization of human SMARCE1r high-mobility-group protein. Biochim Biophys Acta 1574, 269-276, doi:10.1016/s0167-4781(01)00373-6 (2002).
11 Chi, T. H. et al. Reciprocal regulation of CD4/CD8 expression by SWI/SNF-like BAF complexes. Nature 418, 195-199, doi:10.1038/nature00876 (2002).
12 Sartorelli, V. & Caretti, G. Mechanisms underlying the transcriptional regulation of skeletal myogenesis. Curr Opin Genet Dev 15, 528-535, doi:10.1016/j.gde.2005.04.015 (2005).
13 Battaglioli, E. et al. REST repression of neuronal genes requires components of the hSWI.SNF complex. J Biol Chem 277, 41038-41045, doi:10.1074/jbc.M205691200 (2002).
14 Wang, L. et al. The BRG1- and hBRM-associated factor BAF57 induces apoptosis by stimulating expression of the cylindromatosis tumor suppressor gene. Mol Cell Biol 25, 7953-7965, doi:10.1128/MCB.25.18.7953-7965.2005 (2005).
15 Kiskinis, E., Garcia-Pedrero, J. M., Villaronga, M. A., Parker, M. G. & Belandia, B. Identification of BAF57 mutations in human breast cancer cell lines. Breast Cancer Res Treat 98, 191-198, doi:10.1007/s10549-005-9149-9 (2006).
16 Villaronga, M. A. et al. Identification and characterization of novel potentially oncogenic mutations in the human BAF57 gene in a breast cancer patient. Breast Cancer Res Treat 128, 891-898, doi:10.1007/s10549-011-1492-4 (2011).
17 Balasubramaniam, S. et al. Aberrant BAF57 signaling facilitates prometastatic phenotypes. Clin Cancer Res 19, 2657-2667, doi:10.1158/1078-0432.CCR-12-3049 (2013).
18 Kagami, S. et al. Prognostic significance of BAF57 expression in patients with endometrial carcinoma. Histol Histopathol 27, 593-599, doi:10.14670/HH-27.593 (2012).
19 Yamaguchi, T. et al. Expression of BAF57 in ovarian cancer cells and drug sensitivity. Cancer Sci 106, 359-366, doi:10.1111/cas.12612 (2015).
20 Papadakis, A. I. et al. SMARCE1 suppresses EGFR expression and controls responses to MET and ALK inhibitors in lung cancer. Cell Res 25, 445-458, doi:10.1038/cr.2015.16 (2015).
21 Tauziede-Espariat, A. et al. Loss of SMARCE1 expression is a specific diagnostic marker of clear cell meningioma: a comprehensive immunophenotypical and molecular analysis. Brain Pathol 28, 466-474, doi:10.1111/bpa.12524 (2018).
22 Masliah-Planchon, J., Bieche, I., Guinebretiere, J. M., Bourdeaut, F. & Delattre, O. SWI/SNF chromatin remodeling and human malignancies. Annu Rev Pathol 10, 145-171, doi:10.1146/annurev-pathol-012414-040445 (2015).
23 Mittal, P. & Roberts, C. W. M. The SWI/SNF complex in cancer - biology, biomarkers and therapy. Nat Rev Clin Oncol 17, 435-448, doi:10.1038/s41571-020-0357-3 (2020).
24 Sievers, P. et al. Clear cell meningiomas are defined by a highly distinct DNA methylation profile and mutations in SMARCE1. Acta Neuropathol 141, 281-290, doi:10.1007/s00401-020-02247-2 (2021).
25 Capper, D. et al. DNA methylation-based classification of central nervous system tumours. Nature 555, 469-474, doi:10.1038/nature26000 (2018).
26 Hovestadt, V. et al. Decoding the regulatory landscape of medulloblastoma using DNA methylation sequencing. Nature 510, 537-541, doi:10.1038/nature13268 (2014).
27 Hovestadt, V. et al. Robust molecular subgrouping and copy-number profiling of medulloblastoma from small amounts of archival tumour material using high-density DNA methylation arrays. Acta Neuropathol 125, 913-916, doi:10.1007/s00401-013-1126-5 (2013).
28 Sahm, F. et al. DNA methylation-based classification and grading system for meningioma: a multicentre, retrospective analysis. Lancet Oncol 18, 682-694, doi:10.1016/S1470-2045(17)30155-9 (2017).
29 Sievers, P. et al. YAP1-fusions in pediatric NF2-wildtype meningioma. Acta Neuropathol 139, 215-218, doi:10.1007/s00401-019-02095-9 (2020).
作者简介

任豪磊
复旦大学附属华山医院脑膜瘤团队,导师宫晔教授,研究方向复发和恶变脑膜瘤的分子作用机制。
阔然精准诊疗脑肿瘤产品CaptioX-M是一款以NGS技术为基础的检测产品。CaptioX-M用于脑膜瘤的分子诊断,涵盖了脑膜瘤复发相关的67个基因(NF2、TERTp、CDKN2A/B、ARID1A和BIP1等)、预后相关的染色体(22q、1p、5、10等)拷贝数变异和潜在靶向治疗相关基因的信息,脑膜瘤CaptioX-M可用于脑膜瘤患者分子分型、预后评估和辅助医生制定治疗策略。
“阔然生物医药科技(上海)有限公司(Shanghai KR Pharmtech, Inc. , Ltd.)”简称“阔然基因”,是一家专注于医学研究与转化的企业,专注于脑肿瘤的分子诊断与个体化治疗业务,现已有两家(上海、徐州)国家卫生健康委员会认证的医学检验实验室,在基因检测领域有自主知识产权,拥有完善的全国医疗市场的销售渠道,战略合作的神经外科医生的媒体“神外资讯”,目标成为脑肿瘤分子诊断与个体化治疗领域中国第一品牌。阔然基因重视自有技术开发,目前已建高通量测序平台、单细胞测序平台、多标荧光免疫组化平台,阔然基因在硬件与试剂盒产品端发力,布局术中、术后诊断领域,打造自有技术和行业壁垒,成为并巩固在脑肿瘤领域的领跑者地位。目前阔然基因已布局了术后分子诊断、ddPCR脑脊液检测技术和应用,以及术中实时诊断系统。





