
01
CDKN2A/B
CDKN2A,也被称为细胞周期蛋白依赖性激酶抑制剂2A,是一种位于人类染色体9p21.3带的基因。它在许多组织和细胞类型中广泛表达。该基因编码两种蛋白质,包括INK4家族成员p16(或p16INK4a)和p14arf。这两种蛋白都通过调节细胞周期发挥肿瘤抑制作用。p16抑制细胞周期蛋白依赖性激酶4和6(CDK4和CDK6),从而激活视网膜母细胞瘤(Rb)家族的蛋白质,阻止从G1期到S期的转变。p14ARF(在小鼠中称为p19ARF)则可以激活p53。CDKN2A的体细胞突变在大多数肿瘤中很常见,据估计,CDKN2A是仅次于p53的肿瘤中的第二常见的失活基因。而CDKN2A的种系突变与家族性黑色素瘤、胶质母细胞瘤和胰腺癌等等相关。
CDKN2B基因与CDKN2A相邻,在多种癌症中经常发生突变、缺失或失调。该基因编码一种细胞周期蛋白依赖性激酶抑制剂,也称为p15Ink4b蛋白,其可与CDK4或CDK6形成复合物,并且阻止细胞周期蛋白D激活CDK激酶,抑制细胞周期G1进程。
02
CDKN2A/B与高级别脑膜瘤的相关性
早在1997年,Weber RG等人通过比较基因组杂交技术在脑膜瘤中的研究表明,不典型及间变型脑膜瘤中除了存在广为人知的NF2突变及22q的杂合性缺失外,还存高频率的1p及9p的缺失,而9p的缺失仅在间变型脑膜瘤中发生[7],其随后在2001年的研究中发现,大约20%的间变型脑膜瘤患者存在9p21位置上CDKN2A/B的纯合性缺失[8];2002年Arie Perry等人证实了9p21及CDKN2A/B的间变型脑膜瘤中的高频缺失现象,对其编码的p16蛋白进行生存分析也发现,p16蛋白的缺失在23名间变型脑膜瘤患者中与更短的无进展生存期及总生存期相关[9]。
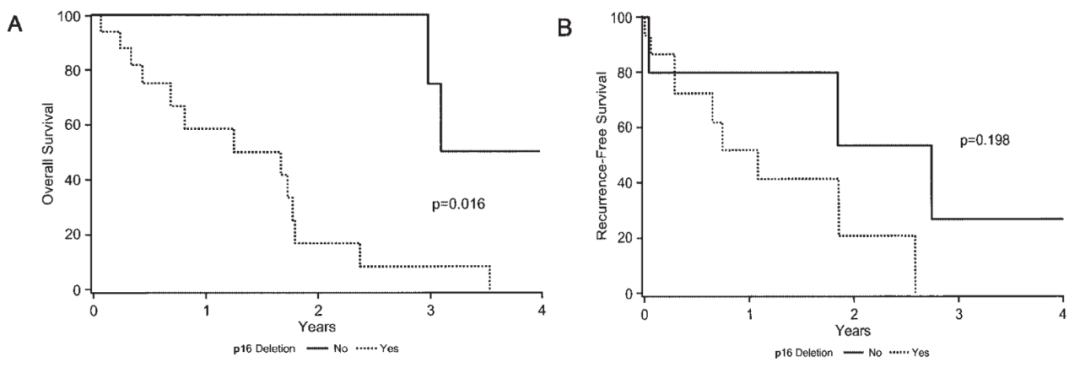
图1(摘自文献9):K-M生存曲线对23例间变型脑膜瘤进行的p16表达的预后分析
除了纯合性缺失,CDKN2A/B在脑膜瘤中还存在体细胞突变及启动子区的甲基化,这两种突变类型也是在间变型脑膜瘤中高发,Anne Guyot等人在2019年对17例复发脑膜瘤及13例原发脑膜瘤标本进行了CDKN2A/B的全外显子及焦磷酸测序,发现了p.Ala148Thr这个突变位点,且这个点突变与甲基化及杂合性缺失一样,均与患者的复发显著相关[10]。
海德堡病理学家Felix Sahm在2020年将研究的病例数历史性的提高到了528人,DNA甲基化测序发现26名(4.9%)患者存在CDKN2A/B的纯合性缺失,这26名患者均为高级别(7例II级,19例III级),生存分析也表明CDKN2A/B与更短的无进展生存期相关[11]。

图2(摘自文献11):WHO II级及III级脑膜瘤中528名脑膜瘤患者根据CDKN2A/B的缺失进行预后分层分析
03
CDKN2A/B在脑膜瘤动物模型中的研究
Kalamaride教授对脑膜瘤细胞起源的持续研究发现,将小鼠蛛网膜细胞的NF2及CDKN2A/B敲除后,小鼠脑膜瘤的形成率较单纯NF2敲除显著要高,对小鼠肿瘤进行消化传代分析发现,其存在类似于人间变型脑膜瘤的特征,这种NF2及CDKN2A/B双缺失的肿瘤恶性度较NF2单缺失型肿瘤要高,这种双缺失模型小鼠 的成瘤时间只有3.5个月,为药物靶点治疗提供的理想的研究模型[12]。
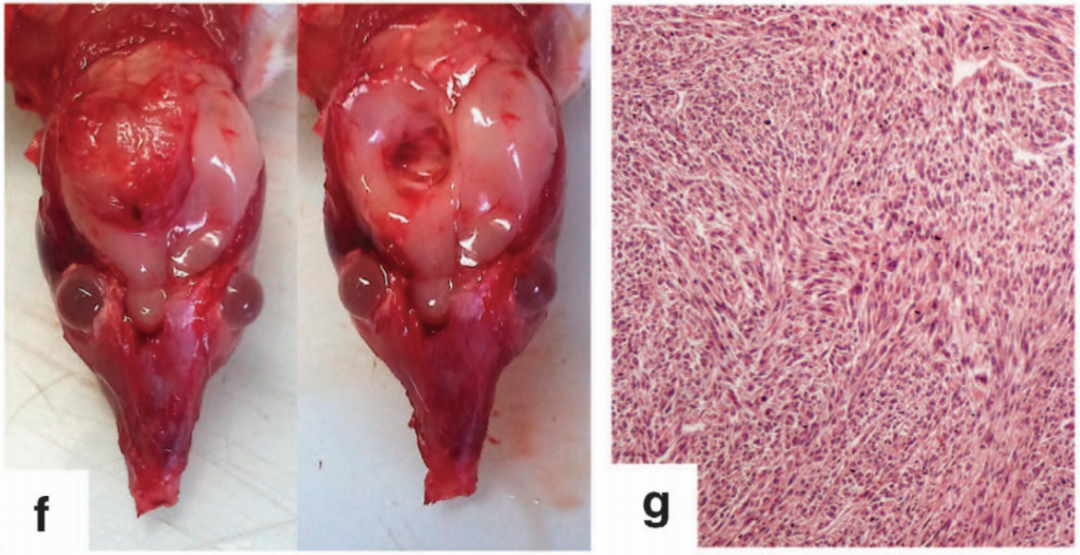
图3(摘自文献12):(左)敲除了NF2及CDKN2A/B后小鼠肿瘤的大体形态;(右)肿瘤的形态符合间变型脑膜瘤的特征
总 结
CDKN2A/B在高级别脑膜瘤中的高发性及与预后的相关性使得对高级别脑膜瘤进一步进行分层预后分析显得至关重要,此外,高级别侵袭性脑膜瘤中CDKN2A/B与NF2其它基因突变之间的相关性等也值得进一步探索。
参考文献
作者简介

华领洋
阔然精准诊疗脑肿瘤产品CaptioX-M是一款以NGS技术为基础的检测产品。CaptioX-M用于脑膜瘤的分子诊断,涵盖了脑膜瘤复发相关的67个基因(NF2、TERTp、CDKN2A/B、ARID1A和BIP1等)、预后相关的染色体(22q、1p、5、10等)拷贝数变异和潜在靶向治疗相关基因的信息,脑膜瘤CaptioX-M可用于脑膜瘤患者分子分型、预后评估和辅助医生制定治疗策略。
“阔然生物医药科技(上海)有限公司(Shanghai KR Pharmtech, Inc. , Ltd.)”简称“阔然基因”,是一家专注于医学研究与转化的企业,专注于脑肿瘤的分子诊断与个体化治疗业务,现已有两家(上海、徐州)国家卫生健康委员会认证的医学检验实验室,在基因检测领域有自主知识产权,拥有完善的全国医疗市场的销售渠道,战略合作的神经外科医生的媒体“神外资讯”,目标成为脑肿瘤分子诊断与个体化治疗领域中国第一品牌。阔然基因重视自有技术开发,目前已建高通量测序平台、单细胞测序平台、多标荧光免疫组化平台,阔然基因在硬件与试剂盒产品端发力,布局术中、术后诊断领域,打造自有技术和行业壁垒,成为并巩固在脑肿瘤领域的领跑者地位。目前阔然基因已布局了术后分子诊断、ddPCR脑脊液检测技术和应用,以及术中实时诊断系统。





