对于颅内动脉瘤发生的遗传因素,本文通过欧洲及东亚人群的全基因组相关分析,发现了11个新的风险基因位点,同时验证了既往研究中发现的6个已知基因位点。发现血压及吸烟对颅内动脉瘤遗传因素的影响。此外还发现了颅内动脉瘤与缺血性卒中及脑内出血之间存在遗传相关性,可能与癫痫之间存在共同的遗传机制。
【REF: Bakker MK, et al. Nat Genet. 2020 Nov 16. doi: 10.1038/s41588-020-00725-7.】一篇双胞胎研究发现,遗传易感性在动脉瘤性蛛网膜下腔出血(aSAH)中扮演着重要角色,遗传率为41%。关于颅内动脉瘤的遗传结构还有许多未知之处,以家族为基础的研究确定了许多具有孟德尔遗传特性的变异,但是全基因组关联研究(GWAS)已经确定了多个常见变异,提示了aSAH的多基因遗传模式。迄今为止公布的最大的GWAS报告涉及了2780例病例和12515名对照者,确定了6个风险基因位点。根据GWAS所得出的结果,基于不同人群,颅内动脉瘤基于单核苷酸多态性(SNP)的遗传率仅为4.1-6.1%。通过对来自欧洲和东亚的10754例病例和306882例对照者进行跨祖先GWAS荟萃分析,我们的目标是进一步描述颅内动脉瘤的遗传结构。我们纳入未破裂颅内动脉瘤(uIA)和aSAHs(破裂颅内动脉瘤)的病例,使我们能够识别出导致颅内动脉瘤破裂的潜在危险因素。我们还寻找了颅内动脉瘤和相关特征之间的遗传相似性,包括其他类型的中风、血管畸形和其他动脉瘤,并分析已知的颅内动脉瘤危险因素是否在遗传因素中起作用。此外,我们还研究了功能基因区域、组织亚型和药物类别中基因关联的丰富程度,以提供对颅内动脉瘤病理生理学的进一步了解。我们对颅内动脉瘤的GWAS荟萃分析分为两个阶段。第一阶段荟萃分析纳入了所有欧洲血统的个体,由23个不同群体的个体水平基因型组成,并根据基因分型平台和国家合并为9个欧洲血统阶层。这些阶层均采用logistic混合模型进行分析,随后进行荟萃分析。同时还包括基于人群的汇总统计的队列研究:Nord-Trøndelag健康研究(HUNT研究)。最终7495例病例、71934例对照和4471083个SNP通过了质量控制。第二阶段是跨祖先荟萃分析,包括来自两个基于人群的队列研究:日本生物库(BBJ)和中国Kadoorie生物库(CKB)的东亚个体的所有阶段和汇总统计数据。在第二阶段共纳入了10754例病例、306882例对照和3527309个SNP。
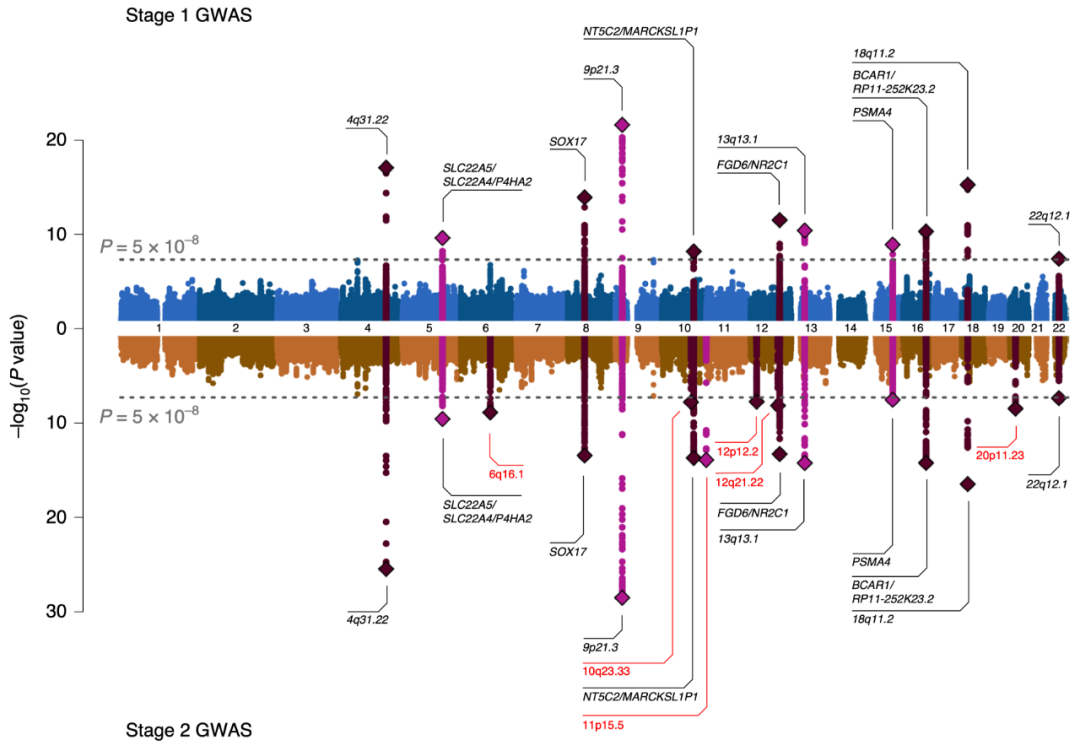
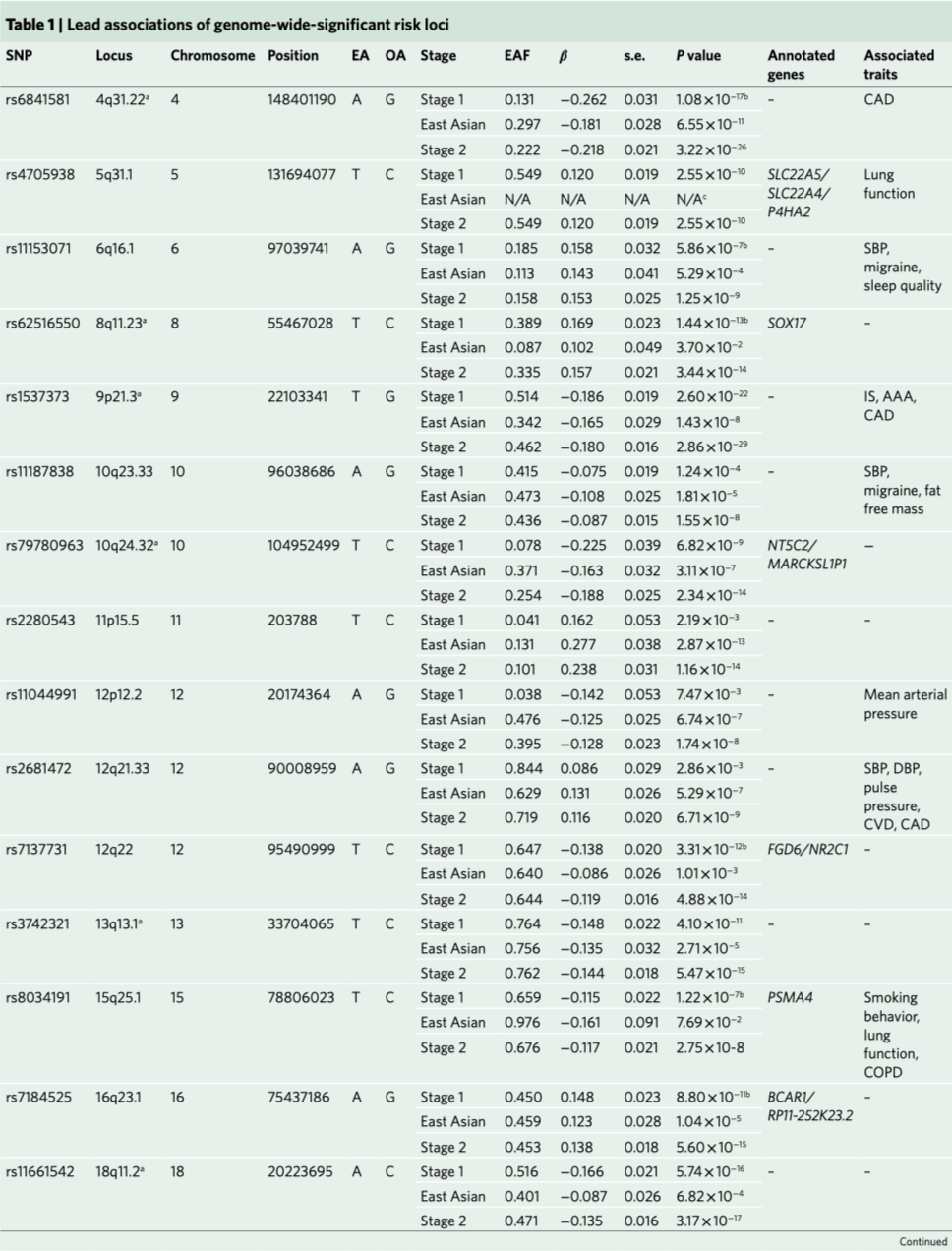
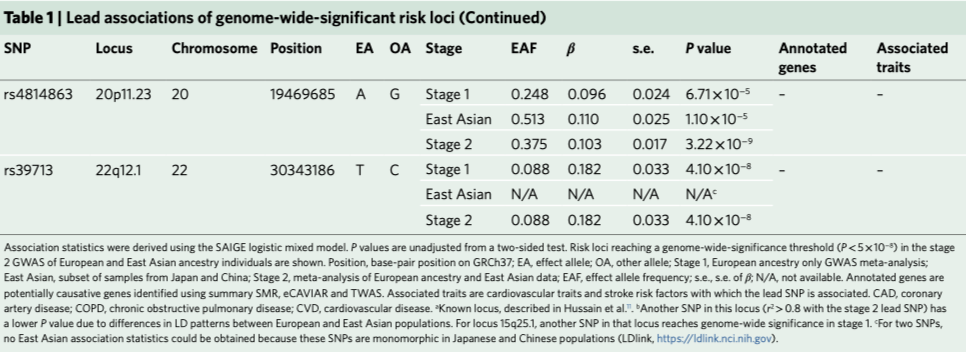
第一阶段研究中产生了11个在基因组上有显著意义的重要基因位点(P≤5 × 10−8,图1)。跨祖先遗传相关分析显示,欧洲祖先的第一阶段荟萃分析与只包括东亚祖先样本的分析之间存在较强的相关性(遗传相关, 遗传影响ρg = 0.938±0.165(s.e.),遗传效应0.908±0.146)。第二阶段增加全基因组显著性基因位点的数量到17个(表1和图1)。在第二阶段加入的东亚血统样本中,除了两个基因位点(8q11.23, rs6997005和15q25.1, rs10519203)之外,其余基因位点均与颅内动脉瘤相关(P < 0.05/11),东亚血统样本中有两个基因座是单型的(表1)。第二阶段基因位点包括11个新的风险基因位点和6个既往报道过的风险位点。我们使用条件和联合(COJO)分析软件(GCTA v.1.91.1beta)对每个基因位点中的首要SNP的一期GWAS总结统计数据进行条件分析。我们没有发现包含多个独立SNP的基因位点,每个基因位点标记了一个单一的因果变异(数据未显示)。在第一阶段的荟萃分析中,基因组膨胀因子(λGC)为1.050,第二阶段为1.065。第一阶段荟萃分析的连锁不平衡评分回归(LDSR)截距为0.957±0.008 (s.e.),东亚亚群的截距为0.982±0.008。这表明,在所有的GWAS分析中,观测到的膨胀归因于多基因结构。图1. GWAS荟萃分析结果。第一阶段(上)和第二阶段(下)GWAS荟萃分析的SAIGE logistic混合模型关联P值。横轴表示染色体的位置。纵轴表示该关联的- log10(P值)。虚线表示P = 5×10−8的全基因组显著性阈值。每个位点的首要SNP用菱形标记,相近的SNP(±500kb)根据染色体指数奇偶性被标为粉红色或紫色。采用SMR、eCAVIAR和TWAS对基因或基因座进行命名,或颅内动脉瘤相关的已经命名的基因。仅在第二阶段GWAS中识别的标签或基因座用红色表示。*使用SAIGE logistic混合模型得出关联统计。P值为未经调整的双侧检验。研究显示,在欧洲和东亚血统个体的第二阶段GWAS中,风险基因座达到全基因组显著性阈值(P < 5×10−8)。表1概述了每个基因位点最强关联的基因位置、等位基因、效应大小和P值。我们使用基于汇总统计的孟德尔随机化(SMR)、eCAVIAR的共定位分析和全转录关联研究(TWAS)来注释这些基因位点的潜在致病基因。由于SMR、eCAVIAR和TWAS都需要连锁不平衡(LD)参考面板,我们将注释限制在欧洲祖先第一阶段GWAS荟萃分析中鉴定的基因位点上。这在5个独立的基因位点上产生了10个潜在的致病基因:SLC22A5/SLC22A4/P4HA2(chr5),NT5C2/MARCKSL1P1(chr10),FGD6/NR2C1(chr12),PSMA4(chr15)和 BCAR1/RP11-252K23.2(chr16)(见表1)。虽然没有发现SOX17参与chr8基因位点的证据,但既往的研究确实发现了SOX17的功能证据。因此,我们将chr8位点标注为SOX17,共在6个基因座中确定了11个基因。
在第二阶段的GWAS中,又发现了6个基因位点:6q16.1、10q23.33、11p15.5、12p12.2、12q21.22和20p11.23。由于欧洲和东亚LD结构的结合,使用上述技术不能可靠地将这些基因位点到基因上。在这6个额外的基因位点中,已有4个与血压(BP)相关,即6q16.1(rs11153071)、10q23.33(rs11187838)、rs11044991(12p12.2)和rs2681492(12q21.22)。潜在的致病基因FGD6的产物在血管生成中发挥作用,缺陷可能导致血管形成受损。FGD6是一种血管内皮细胞(vEC)信号基因,在vECs中参与应激信号传导。在动物模型中,THSD1和SOX17功能缺失突变导致蛛网膜下腔出血。这两个基因的产物在vECs中都具有重要的作用。BCAR1是一个广泛表达的基因,其蛋白产物是机械应激感受器。另外,PSMA4基因位点与许多吸烟和呼吸系统疾病有关。我们使用分层GWAS分析评估破裂和未破裂颅内动脉瘤之间的遗传危险因素是否不同。未破裂颅内动脉瘤的病例较少(n=2070)。因此,除了对破裂动脉瘤和未破裂动脉瘤的患者(aSAH vs uIA)完成分层GWAS分析外,我们还对破裂颅内动脉瘤与对照组以及未破裂颅内动脉瘤与对照组分别进行了分层GWAS分析。总而言之,69%的病例颅内动脉瘤破裂,28%的颅内动脉瘤未破裂,而3.8%的动脉瘤破裂状况不明。仅aSAH和仅未破裂的颅内动脉瘤组(uIA)的GWAS识别了一些全基因组显著基因位点,所有这些基因位点在第一阶段和第二阶段GWAS颅内动脉瘤荟萃分析中都达到全基因组显著性。在aSAH vs uIA的GWAS中,我们没有发现基因组内的显著性基因位点。此外,遗传相关分析显示,破裂和未破裂颅内动脉瘤之间的相关性较高,为0.970±0.133(s.e.)。这些结果表明,破裂和未破裂颅内动脉瘤之间的遗传结构非常相似。
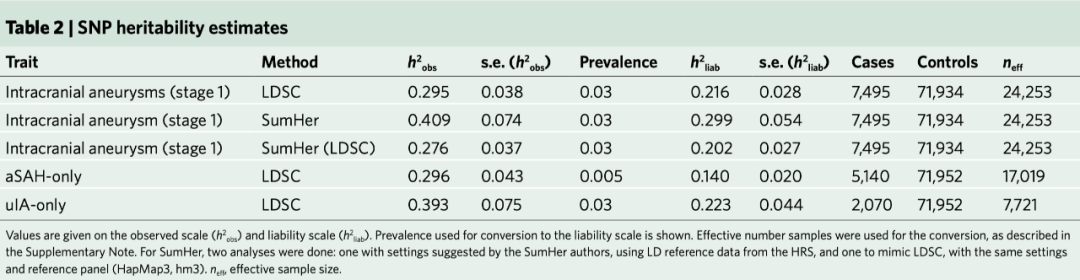
使用LDSR的责任量表(也叫LDSC法),我们估计基于SNP的颅内动脉瘤的遗传力为21.6±2.8%(s.e.),使用SumHer法的遗传力为29.9±5.4%(表2)。根据所使用的方法(LDSC法或SumHer法),这相当于基于双基因遗传力(h2 = 41%)的53-73%。我们使用未破裂颅内动脉瘤的患病率为3%作为责任量表的换算。由于GWAS是破裂和未破裂颅内动脉瘤患者的混合,所以这个患病率可能不能代表整个研究人群。因此,我们使用流行值的范围来计算责任量表的遗传力。这表明,当使用较低的流行率估计(K)时,基于SNP解释的遗传力是可观的(K=0.02: h2=19.3±2.5%(LDSC),26.8±4.8%(SumHer); K=0.01: 16.3±2.1%(LDSC),22.6±4.1%(SumHer))。
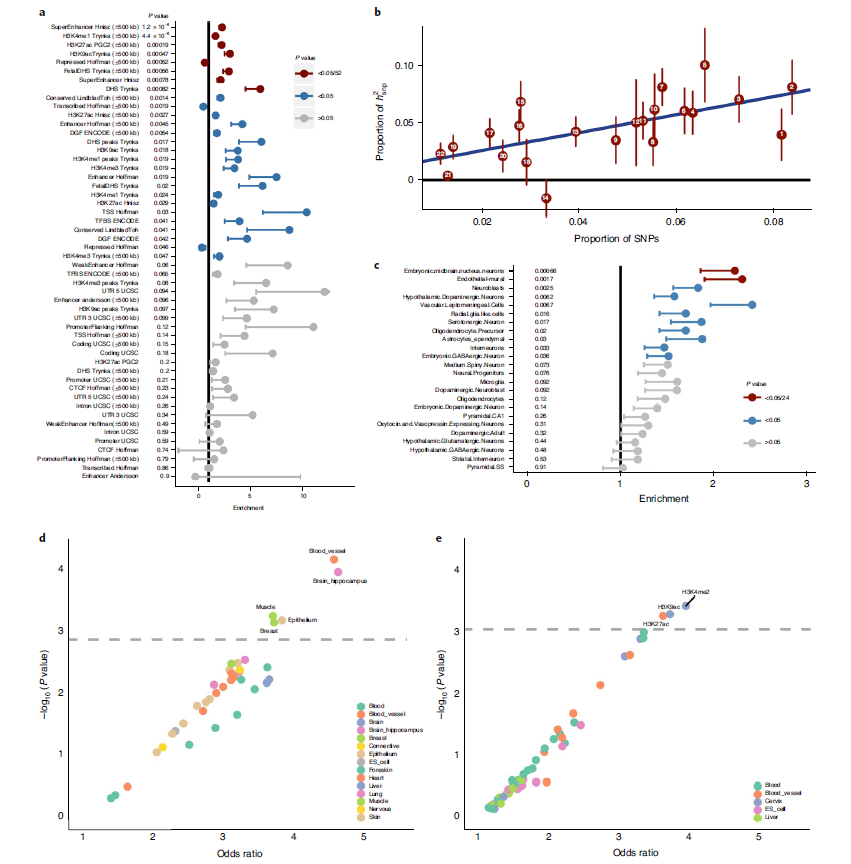
颅内破裂动脉瘤(仅SAH, h2=0.140±0.020)和未破裂颅内动脉瘤(仅uIA, h2=0.223±0.044)也存在大量基于SNP的遗传。为了了解颅内动脉瘤的发病机制,我们利用LDSR法进行了数种遗传力富集分析。功能基因组元件的分区显示,调控元件中包括增强子和启动子组蛋白标记H3K4me1、H3K27Ac和H3K9Ac、超级增强子和DNase I超敏位点的遗传力明显富集(图2a)。这种基因组中调控元件的富集也可以在其他多基因特征中看到,这表明颅内动脉瘤的结构是多基因的。每条染色体的分配遗传力进一步支持其多基因结构,因为遗传力与染色体上SNP的数量相关(图2b)。
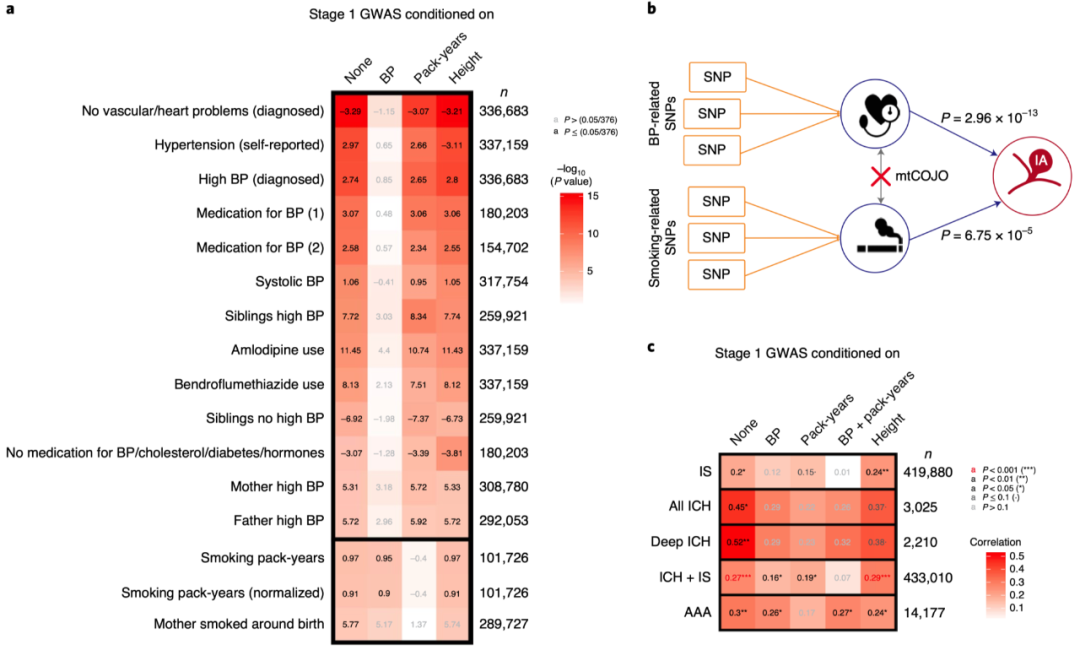
组织特异性LDSR没有显示对任何组织的富集。然后,我们使用来自小鼠大脑的单细胞RNA测序(scRNA-seq)参考数据进行细胞类型富集分析。小鼠脑血管的scRNA-seq数据集中未发现富集。使用更大的数据集定义小鼠脑细胞类型,我们发现“内皮壁细胞”存在富集,包括vECs和壁细胞这是一个矢量的集合(富集值=2.31±0.41(s.e.), P=1.65×10−3,图2c),中脑神经元也存在一个富集(富集值=2.23±0.37,P=6.56×10−4)。使用GARFIELD进行的LD-pruned富集分析显示,与血管特异性相关的基因被富集(图2d),进一步支持了启动子和增强子的作用(图2e)。图2. 遗传力和功能富集分析。a: 分割的LDSR富集的调节元素。标签表明调节元素或组蛋白标记的类型。横轴显示了富集情况,富集=1表示无富集。以P<0.05除以注释数为差异有统计学意义。点是估计值,误差条表示在无影响方向上的一个均数±标准差。统计来自双边加权线性回归。P值未调整。b:每条染色体分段LDSR遗传力分析。横轴显示的是每个染色体上的SNP比例,纵轴显示的是基于SNP的遗传力的比例。线性回归线用蓝色表示。数据以点估计值±标准差表示。统计量与a图的统计量相同。c:小鼠脑细胞scRNA-seq的分区LDSR富集分析。格式和统计数据与a相同。d:GARFIELD组织分析。横轴显示注释的富集程度;纵轴显示相应的-log10(P值)。虚线表示P=0.05除以注释数量的显著性阈值。优势比由logistic回归得到。P值未经调整,来自双边检验。e:GARFIELD法分析组蛋白修饰定义的调控区域。格式和统计数据与d图相同。为了评估哪些表型会直接影响颅内动脉瘤的风险,我们使用英国生物样本库中所有表型的汇总统计数据进行了普遍SMR(GSMR)。我们使用不包括英国生物库数据的第一阶段总结统计作为结果。在本次分析中,我们选择376作为一个严格的多重检测阈值,即通过GSMR质量控制参数的性状数量。经多次检验校正后,16个特征具有统计学意义(图3a)。所有有统计学意义的特征都与吸烟和血压有关,这是颅内未破裂动脉瘤和aSAHs的两个主要临床危险因素。为了确定吸烟和血压的遗传易感性是否为两者的因果遗传风险因素,相互独立,我们使用mtCOJO分析对吸烟和BP的GWAS汇总统计数据进行了1期GWAS汇总统计。我们使用收缩压(SBP)和舒张压(DBP)的综合统计数据来确定血压水平,并使用“年吸烟包数”的综合统计数据来确定吸烟情况(图3a)。接受血压或年吸烟包数条件的设置后,所有的GSMR效应都有所减小,当设置其他危险因素条件时,GSMR效应保留下来。mtCOJO分析方法本身并不影响效应量的估计,因为对站立高度的条件设置并不影响估计。这些发现为血压和吸烟的遗传易感是颅内动脉瘤的独立遗传因素提供了强有力的证据(图3b)。
由于暴露性状的表型值进行了逆秩归一化处理,因此很难解释SBP(暴露x对结局y的影响,βxy=1.058±0.187)和年吸烟包数 (βxy=0.973±0.236)的GSMR效应大小。因此,我们使用更新版本的英国生物库GWAS对血压进行了额外的GSMR分析,包括定量性状的原始表型值。对于血压性状,GSMR分析导致类似的效应值估计为DBP—0.095±0.019,SBP—0.047±0.011。假设血压对动脉瘤的发生呈线性影响,那么意味着每增加1毫米汞柱的舒张压或收缩压,将分别增加8-12%和3.7-6.0%的颅内动脉瘤发生风险。此外,高血压诊断时的年龄具有显著的GSMR效应(P=1.79×10−4, βxy=0.163±0.044),表明高血压暴露每年增加13-23%的颅内动脉瘤风险。我们没有包括吸烟的数量性状,因为这些性状不呈正态分布(数据没有显示),因此可能导致偏倚效应。随后我们测试了在破裂(仅SAH)和未破裂颅内动脉瘤(仅uIA)之间吸烟和血压的影响是否不同。所有表型的GSMR效应大小遵循相同的趋势,但“高血压(自我报告)”对破裂颅内动脉瘤有更强的影响(仅SAH: βxy=6.74±0.61(s.e.),所有颅内动脉瘤: 2.97±0.42和仅uIA: 2.38±0.70),而使用氨氯地平对未破裂颅内动脉瘤具有较弱的影响,但统计学上没有意义(仅uIA: βxy=4.77±3.90, P=0.22,所有颅内动脉瘤: βxy=11.4±2.10,P=5.25×10−8,仅SAH: βxy =13.1±2.60,P=5.25×10−7)。虽然自我报告的高血压对SAH的影响更强,但采用mtCOJO分析对血压进行调节可减轻影响(βxy=1.02±0.45,P=0.024,数据未显示)。由于样本量有限,仅uIA样本检测GSMR效应的能力远低于所有颅内动脉瘤和仅SAH样本,因此需要进一步研究推断破裂的遗传危险因素。既往研究提示影响女性激素的性状可能在aSAH 风险中发挥作用。只有两个雌性激素相关性状具有足够的全基因组显著风险基因位点,可以通过GSMR QC。二者分别为“月经开始(初潮)”和“绝经”的年龄。在GSMR分析中,二者均未显示与颅内动脉瘤的因果关系。为了确定与颅内动脉瘤相关的性状,我们使用LDHub分析了第一阶段的统计数据。LDHub包括了用于GSMR的汇总统计信息的一个子集,以及大量来自公共来源的汇总统计信息。性状显示相关性达到多重测试的Bonferroni阈值(P= 0.05/464)的包括多个血压相关性状,包括舒张压(DBP, ρg=0.223, P=5.40×10−9)和收缩压(SBP, ρg=0.256, P=1.34×10−8)和吸烟性状,如年吸烟包数(ρg=0.330, P=7.87×10−8)。
我们使用LDSR计算颅内动脉瘤与其他卒中亚型(缺血性卒中和颅内出血)、与其他血管畸形类型(颅内动静脉畸形和颈动脉夹层)和腹主动脉瘤的遗传相关性。发现对于缺血性卒中(IS),其与颅内动脉瘤之间存在0.195±0.079(P=0.014)的相关性(图3c)。将颅内动脉瘤GWAS分别设置在均为IS和颅内动脉瘤的临床危险因素的血压或年吸烟包数上,两者之间的相关性不再具有统计学意义,血压相关性降低至0.121±0.081,年吸烟包数相关性降低至0.147±0.084。两种危险因素调节后相关性消失(ρg=0.009±0.083, P=0.916)。当条件设置在一个不相关但可遗传的性状(如站立身高)时,相关关系仍然存在(ρg=0.238±0.081, P=0.003)。在任何IS亚型中都没有发现遗传相关性。图3. 跨性状分析。a:英国生物样本库预测因子对第一阶段颅内动脉瘤GWAS的GSMR分析,以mtCOJO分析的柱型标记所描述的特征为条件。数值为GSMR效应的大小。前13个性状都与血压相关。最下面的三个性状与吸烟有关。有统计学意义定义为P<0.05除以通过QC的性状数量。方形填充颜色表示GSMR效应的−log10(P值)。在非条件分析中,所有通过多重测试显著性的16个性状都被显示出来。n为英国生物库GWAS的样本量。对于颅内动脉瘤,应用每个SNP内的有效n。P值来自双边线性回归,未经调整。b:因果关系图进一步解释了a图的分析:GSMR分析显示吸烟和血压的遗传风险导致颅内动脉瘤。通过mtCOJO分析发现,与血压和吸烟相关的遗传因素通过独立的机制引起颅内动脉瘤。统计量与a相同。血压有n=317754个样本;吸烟有n=101726个样本。c:LDSR的遗传相关分析。遗传相关估计是通过颜色和数值表示的。左侧轴标记表示与颅内动脉瘤相关的特征。顶部的标签表示用mtCOJO分析确定的第一阶段颅内动脉瘤GWAS的性状。呈现的n值为左侧性状的有效样本量,除了IS和ICH+IS,其中每个SNP使用了一个n,并显示了n的平均值。我们发现颅内动脉瘤与颅内出血(ICH)之间存在显著的遗传相关性(ρg=0.447±0.184, P=0.015),主要是深部ICH(ρg=0.516±0.198, P=0.009)所致,而不是脑叶ICH (P=0.534)所致。颅内动脉瘤GWAS在血压和年吸烟包数上均为诱发ICH的重要危险因素,经调整后与深部ICH的相关性降低(血压和年吸烟包数的颅内动脉瘤GWAS分别为ρg=0.288±0.189和0.234±0.192),不再具有统计学意义。调整本身对身高的影响则小得多(ρg=0.380±0.196)。颅内动脉瘤与腹主动脉瘤(AAA)之间存在遗传相关性(ρg=0.302±0.105, P=0.004)。当条件设置在年吸烟包数上时,颅内动脉瘤与AAAs之间的相关性显著降低(ρg=0.173±0.117,P=0.138),而血压没有明显降低(ρg=0.264±0.117, P=0.024)。颅内动脉瘤与颈动脉夹层之间没有遗传相关性(ρg=0.151±0.180, P=0.401),然而对椎动脉夹层、椎和颈动脉夹层联合,可以观察到更大的相关性,但仍无统计学意义(ρg=0.281±0.159, P=0.077和ρg=0.174±0.149, P=0.066)。对于AVMs,基于SNP的遗传力估计为阴性,这可能是由于GWAS的样本量较小(1123例和1935例对照)。因此,我们对AVM GWAS的总结统计中在第一阶段和第二阶段颅内动脉瘤GWAS中发现的所有SNP进行了查找,但无法重复这些SNP关联(P<0.05/17)。为了识别颅内动脉瘤和其他含有已知药物靶点的疾病之间的多效途径,我们评估了药物和药物类别靶向基因的富集情况。使用MAGMA计算了基于基因的P值,结果有29个基因通过了Bonferroni的多重测试阈值。降压药物安贝生坦和马西替坦的富集有统计学意义(P=1.35×10−5),富集由单基因(EDNRA)驱动。药物类别富集分析显示,抗癫痫类药物富集(曲线下面积(AUC)=0.675, P=8×10−5)。在这类药物中统计上最显著的富集药物是Na+和Ca2+通道的阻滞剂,即苯妥英、唑尼沙胺和托吡酯。这些通道在血压调节以及其他一些生物机制中都很重要。另一类富集的药物是“性激素和生殖系统调节剂”(AUC=0.652, P=2.02×10−4)。我们也使用MAGMA来研究基因途径中的富集,但没有发现有统计学意义的结果。
我们对颅内动脉瘤进行了GWAS荟萃分析,确定了11个新的风险基因位点,并再次验证了6个既往研究确定的风险基因位点,并解释了超过一半的颅内动脉瘤的遗传力。我们发现了颅内动脉瘤多基因结构遗传的有力证据。通过基因定位和遗传富集方法,我们发现了内皮细胞在颅内动脉瘤发育中的潜在作用。我们发现未破裂动脉瘤和破裂动脉瘤的遗传结构非常相似。作为众所周知的临床危险因素,吸烟和高血压被鉴定为颅内动脉瘤的主要遗传驱动因素。这些危险因素也解释了大多数类似于其他类型的中风,如缺血性卒中和深部脑内出血,可能也为这些疾病的临床预防打开了一扇窗。我们还发现颅内动脉瘤与抗癫痫药物之间存在多效性作用,这需要进一步研究以了解颅内动脉瘤与癫痫之间的共同机制。本研究的发现是进一步理解颅内动脉瘤发病机制的重要进展,也是未来开发有效的遗传风险预测和预防颅内动脉瘤发展及随后的动脉瘤性蛛网膜下腔出血的重要一步。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。