今天为大家带来的是《Neurosurgery》(中文版)神经损伤与重症分册第二期,由孙新林、陈韬亮教授翻译,柯以铨教授审校的“导航经颅磁刺激技术联合皮质脊髓束弥散张量成像技术在脑运动功能区病变手术中的作用”,欢迎阅读、分享。
原文:
The Impact of Diffusion Tensor Imaging Fiber Tracking of the Corticospinal Tract Based on Navigated Transcranial Magnetic Stimulation on Surgery of Motor-Eloquent Brain Lesions
原文作者:
Salvatore Massimiliano Cardali, MD, PhD*Felice Esposito, MD, PhD*Filippo Flavio Angileri, MD, PhD*Domenico La Torre, MD, PhD*Rosaria Viola Abbritti, MD*作者单位:
* Department of Neurosurgery, University of Messina, Messina, Italy; ‡ Department of Clinical and Experimental Medicine, University of Messina, Messina, Italy.编译:
孙新林、陈韬亮
审校:
柯以铨
1
导航经颅磁刺激技术(navigated transcranial magnetic stimulation,nTMS)可以在术前定位运动皮层(motor cortex,M1)。然而,nTMS联合皮质脊髓束(corticospinal tract,CST)磁共振弥散张量成像技术(diffusion tensor imaging fiber tracking,DTI-FT)对运动功能区病变手术的作用尚未见报道。回顾分析2012年至2015年住院手术的疑似运动功能区病变的患者资料。所有患者均应用nTMS定位M1皮层,并从2014年开始采取nTMS联合CSTDTI-FT技术。研究其对术前风险/获益评估、手术策略、开颅骨窗、切除范围(extent of resection,EOR)和预后的影响。各组纳入35例患者,A组应用nTMS定位M1皮层,B组应用nTMS联合CSTDTI-FT技术,对照组未采取nTMS定位(C组)。与对照组相比,A组和B组患者开颅骨窗(P=0.01;P=0.001)、术后癫痫发作率(P=0.02)、术后运动能力(P=0.04)和Karnofsky功能状态的评分(P=0.009)均优于对照组。与A组相比,B组患者优化了术前风险/获益评估(P=0.006),提高了术前无运动障碍患者的nTMS阴性病变EOR(P=0.01),而术前存在运动障碍患者的术后运动能力和KPS评分也较少恶化(P=00.2,P=0.03)。nTMS定位为运动功能区病变提供个体化的手术入路,特别是联合DTI-FT时,能够优化术前风险/获益评估、提高EOR并改善患者预后。毗邻运动通路的占位性病变的手术策略是在保护运动功能的前提下最大限度的切除肿瘤[1-3]。术中神经电理监测(intraoperative neurophysiological monitoring,IONM)是定位运动通路的金标准[2,4-9]。然而,术前风险/获益评估的个体化差异经常影响手术策略[10-18]。不过,单纯依赖形态学成像进行手术风险的评估是不可靠的。这其中有多方面的原因,包括肿瘤引起的皮层-皮层下功能网络的解剖重筑[19,20]。
导航经颅磁刺激(navigated transcranial magnetic stimulation,nTMS)提供了一种可靠的术前运动皮层(motor cortex,M1)的功能定位方法[21,22]。它与IONM密切相关[23-25]并影响手术策略[25-27]。对位于或毗邻M1皮层的病变,nTMS可提高切除范围(extent of resection,EOR)并改善患者预后[28-30]。但很少有人关注nTMS联合皮质脊髓束(corticospinal tract,CST)弥散张量成像(diffusion tensor imaging fiber tracking,DTI-FT)技术的作用。
术后运动障碍通常是由于手术过程中下行运动通路受损[31-34]。先前已有文献针对nTMS联合CSTDTI-FT技术进行了可行性论证[35-40,79],提示与标准DTI-FT技术相比,nTMS联合CSTDTI-FT技术提高了定位的准确性[39,41]。然而,nTMS联合CSTDTI-FT对术前风险/获益评估、手术策略、病变切除以及预后的影响尚不明确。
本研究旨在分析比较nTMS皮层功能定位技术以及nTMS联合CSTDTI-FT技术对疑似运动区病变患者的手术治疗和预后的影响。
选取2012年12月至2015年1月收治的疑似累及运动通路的病例,所有患者均应用nTMS进行术前规划。
A组为2012年12月至2013年12月期间仅进行nTMS皮层定位的手术患者。B组为2014年1月到2015年1月,采取nTMS联合CSTDTI-FT定位技术的所有手术患者。选择2011年1月至2012年11月期间的病变位置和大小与A、B组类似的患者作为历史对照组(C组),对照组仅接受标准手术治疗而没有应用nTMS定位。通过比较三组患者的骨瓣大小、EOR和预后的差别,分析2种nTMS方法(A组和B组)对手术策略和预后的影响。同时根据术前病变的功能定位和术前运动状态,进一步比较两种基于nTMS定位技术(A组与B组)对术前风险/获益评估及手术策略和EOR的影响[42]。
纳入标准包括患者年龄>18岁,存在可能累及运动通路(M1和/或CST)的病变。所有纳入病例均由高年资术者完成,术者在IONM辅助下手术且应用nTMS或nTMS联合CSTDTI-FT技术。排除标准包括年龄<18岁,存在磁共振成像(magnetic resonance imaging,MRI)或者存在nTMS定位禁忌症的患者(例如心脏起搏器、人工耳蜗、难治性癫痫)。我们还排除了使用辅助技术(例如荧光引导手术、术中超声、唤醒手术)进行手术以及随访记录不完整的患者。按照当地伦理委员会的规定,所有患者均签署了知情同意书。观察指标包括:(1)术前应用nTMS的风险/获益比以及nTMS对手术策略的影响,包括对运动功能区的认识、手术入路计划、EOR和IONM策略(A组和B组);(2)术后需要收集的数据包括病变组织学类型、实际EOR、骨瓣大小和功能预后(所有组)。在术前规划中,通过比较两种nTMS方案(nTMS与nTMS联合DTI-FT)在不参考IONM结果的情况下预测功能区病变的效能,分析基于nTMS定位的风险/获益评估的准确性。如果一个或多个nTMS采样点与M1重叠(A组和B组)和/或病灶距离CST小于11mm(B组),则认为是功能区病变并且定义为nTMS阳性。否则,病变被定义为nTMS阴性[43]。B组肿瘤患者需要评估病变累及CST的程度。所有肿瘤患者在术后48小时内行MRI扫描以评估EOR。在T1增强序列上进行病变分割和EOR计算[场强(field Strength,FS)=3;重复时间(repetition time,TR)=8.1;回波时间(echo time,TE)=3.7;切片厚度为1mm]。对于非增强病变,使用FLAIR序列(fluid-attenuated inversion-recovery,FLAIR)(FS=3;TR=8000;TE=331.5/7;层厚1mm)进行评估,操作软件为OsiriX成像软件(Pixmeo SARL,Bernex,Switzerland)[44]。在所有MRI层面上手动进行肿瘤分割[45,46]。EOR定义为手术前后肿瘤体积(毫升)的差异[47]。根据肿瘤体积分析,EOR分为:全切除(gross-total resection,GTR)=无病理组织残留、次全切除(subtotal resection,STR)=小于10mL病理组织残留、部分切除(partial resection,PR)≥10mL组织残留,活检≥95%的肿瘤残留[28,48]。通过术后首次计算机断层扫描评估开颅骨瓣大小。术中通常以矩形或方形切开颅骨;因此,通过最大高度乘以最大宽度来计算面积。通过评估出院时和术后3个月的运动表现,术后1个月的癫痫发作率和术后3个月的KPS评分(Karnofsky Performance Status,KPS)来确定功能预后。使用MRC量表(Medical Research Council,MRC)评估运动状态。任何痫性发作(甚至1次局灶性)均定义为癫痫发作的发生。所有数据均取自本机构的数据库(临床图表、PACS档案和门诊诊所报告)。所有的nTMS和DTI-FT操作均由在此领域具有特殊专长的同一个研究者完成,以减少相关偏差。术前计划和手术都是由我科最有经验的神经外科医生完成。EOR和开颅骨窗大小由2名对术前计划和患者预后不知情的独立检查员评估完成。A组和B组患者按文献报道的方法进行M1皮层nTMS定位[41]。操作系统为NBS4.3(Nexstim Oy,Elimäenkatu 9B,Helsinki,Finland)。T1加权序列的钆增强病灶或非对比增强的FLAIR病变序列被导入nTMS系统。使用8字形导航线圈,在静息运动阈值的120%处执行单脉冲刺激。每个身体部分(面部、手臂、腿部)选择1块肌肉,通过3个通道的肌电图电极(Neuroline 720;Ambu,Ballerup,Denmark)记录运动诱发电位。根据病变部位和患者的运动能力,通常选择第一背侧骨间肌、拇短展肌、肱二头肌、胫骨前肌、颏肌和口轮匝肌进行评估。为获得DTI成像,B组患者还进行了MRI弥散加权序列扫描(32个方向;FS=3,TR=2383.9,TE=51.9)。使用StealthViz软件(Medtronic Navigation,Medtronic Inc,Dublin,Ireland)按文献报道方法获取躯体特异性nTMS定位的CSTDTI-FT成像结果[38,41]。通过神经导航系统对nTMS数据进行可视化分析,对手术风险/获益进行评估并明确手术策略。根据nTMS结果,制定最安全的手术入路、EOR和IONM策略。nTMS阴性病变选择GTR,而nTMS阳性病变选择较保守的EOR计划。对照组患者(C组)接受标准手术治疗,没有应用nTMS定位。所有组患者均在全身麻醉下通过IONM监测进行手术治疗。按照Berger、Ojemann[50]和Lettich所述方法[51],所有病例均进行直接皮层和皮层下刺激(DCS/DSS)。尽可能通过相位反转技术对中央沟进行识别定位[52]。采用双极皮层电刺激方法,参数为频率50Hz、单相波宽1ms,持续方波时间4s。DSS过程为单极刺激[3-4次刺激训练;脉冲持续时间50-500μs;刺激间隔250-500Hz(4-2ms)],强度逐渐增加直至获得运动反应为止(上限25mA)。当使用5mA强度就能记录到运动反应时,终止皮层下病变切除。在A、B两组患者手术过程中,通过nTMS重建运动通路以指导IONM和病变切除。所有组均根据病变部位(浅表vs深部)和功能划分(A、B组)进行个体化IONM监测(表1)。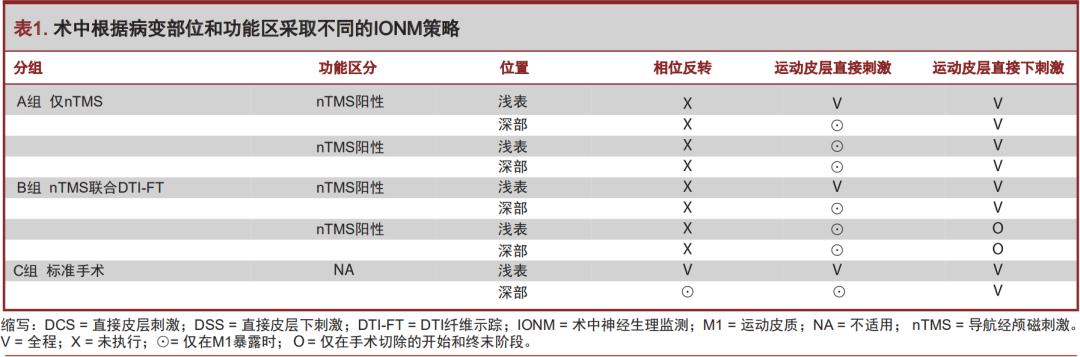
采用GraphPad Prism6.0软件进行统计学分析(GraphPad Software,La Jolla,California,www.graphpad.com)。应用方差分析(Analysis of Variance,ANOVA)和卡方检验分别对连续数据和分类数据进行检验。卡方检验和Fisher检验用于比较功能预后、病变的功能划分和EOR。未应用Bonferroni方法进行校正。采用独立样本t检验和ANOVA比较开颅骨瓣大小。通过定义敏感性(sensiti vity,ST),特异性(specificity,SP),阳性和阴性预测值(positive and negative predictive values,PPV和NPV)来评估风险/获益分析的准确性。以P值<0.05定义为差异具有统计学意义。
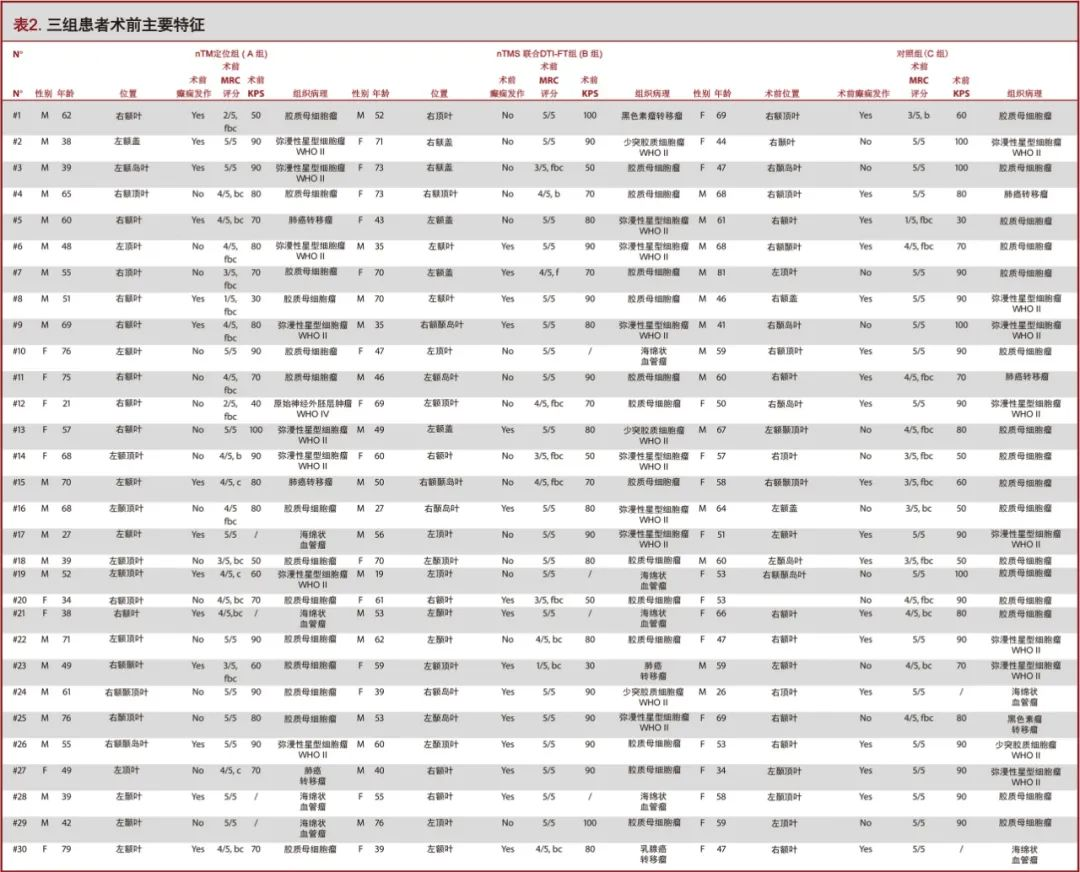
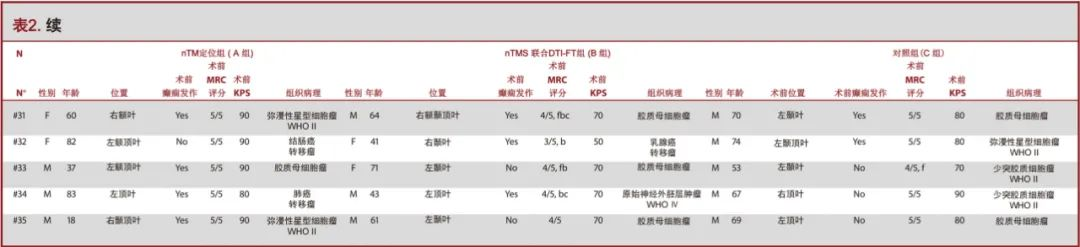
本研究共纳入105名疑似运动功能区病变患者(表2)。A组35名患者仅采取M1皮层nTMS定位(24名男性,11名女性,平均年龄54.6±17.4岁,年龄范围18-83岁);B组35名患者应用nTMS联合CSTDTI-FT技术(19名男性,16名女性,平均年龄54±14.3岁,年龄范围19-76岁)。对照组(C组)35名患者手术未使用nTMS定位(18名男性,17名女性,平均年龄57.3±11.5,范围26-81岁)。统计分析显示组间数据的基线一致(表3)。
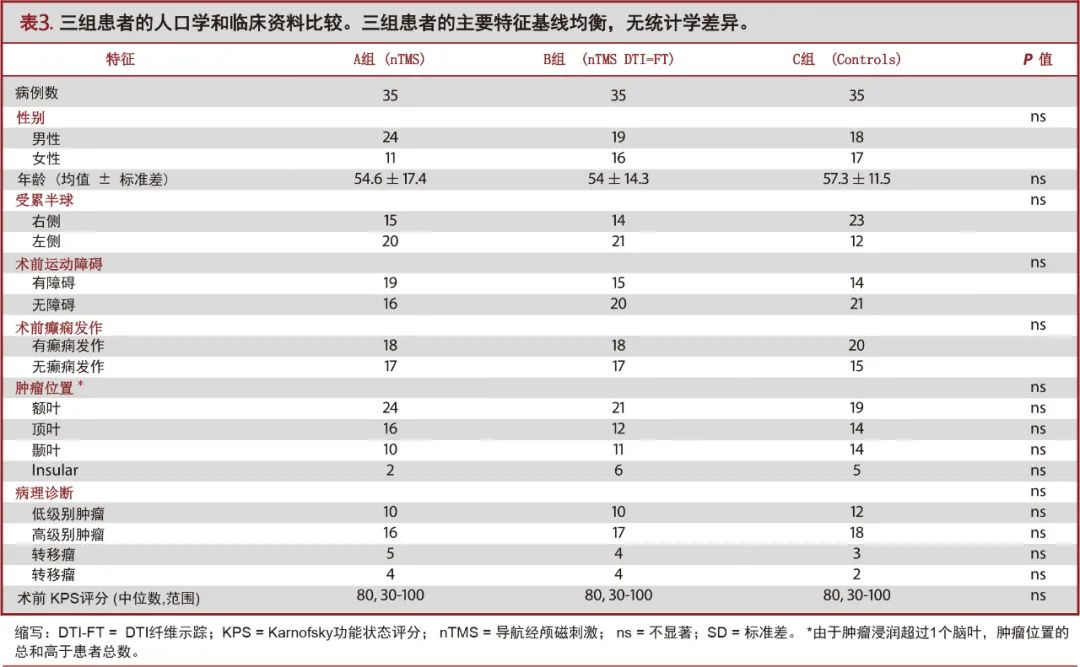
应用nTMS的风险/获益分析的准确性及对手术的影响
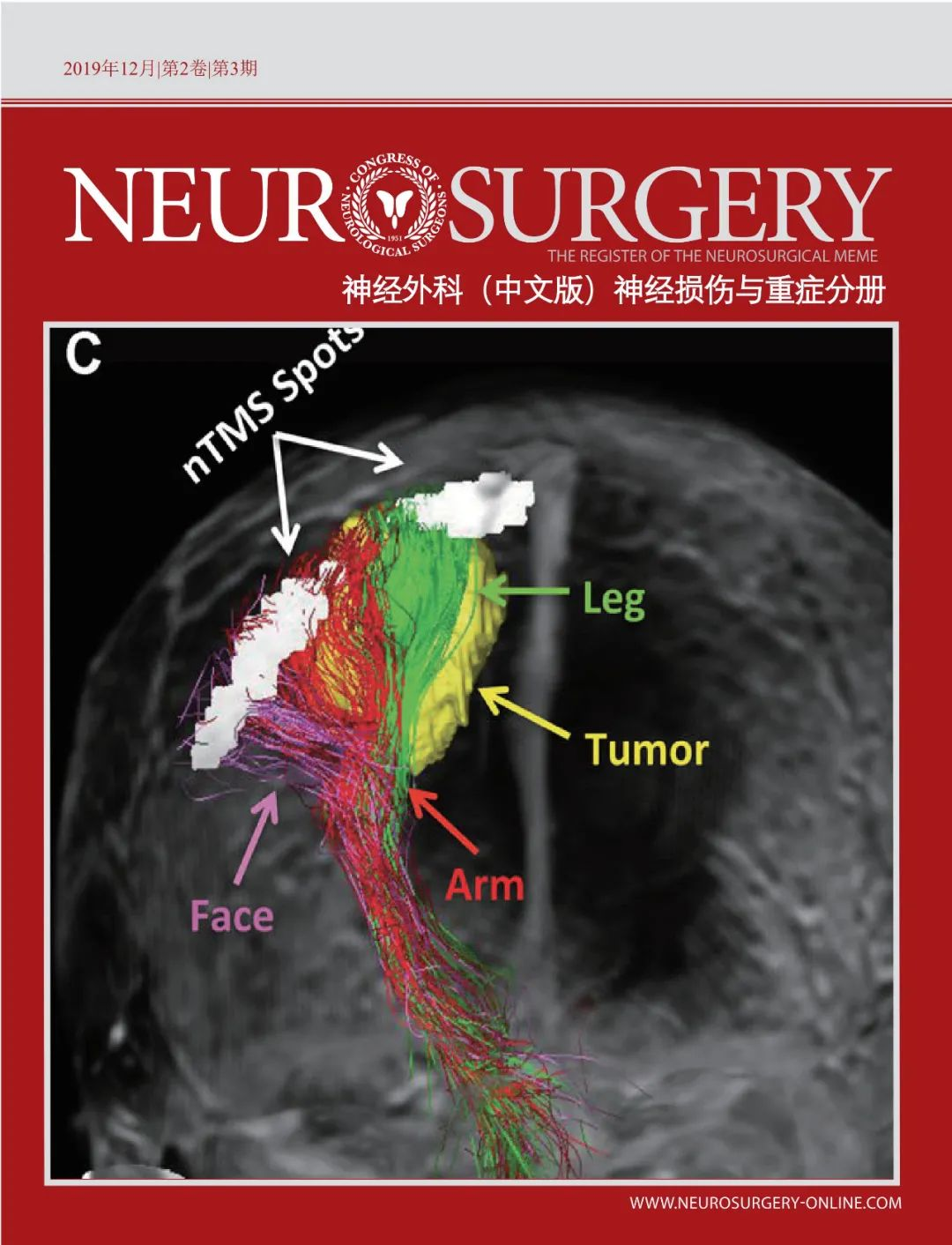
nTMS联合DTI-FT组的nTMS阴性病变数量(占所有病例的20%)低于nTMS组(51.4%;P=0.006;图1A),ST为62.2%,SP72%,PPV为80%,NPV为51.4%。排除CST因素时,两组之间的差异不显著(图1B)。这可能是由于CST纤维束可视化,特别是支配面部的皮质延髓束重建的缘故(图2和图3)。
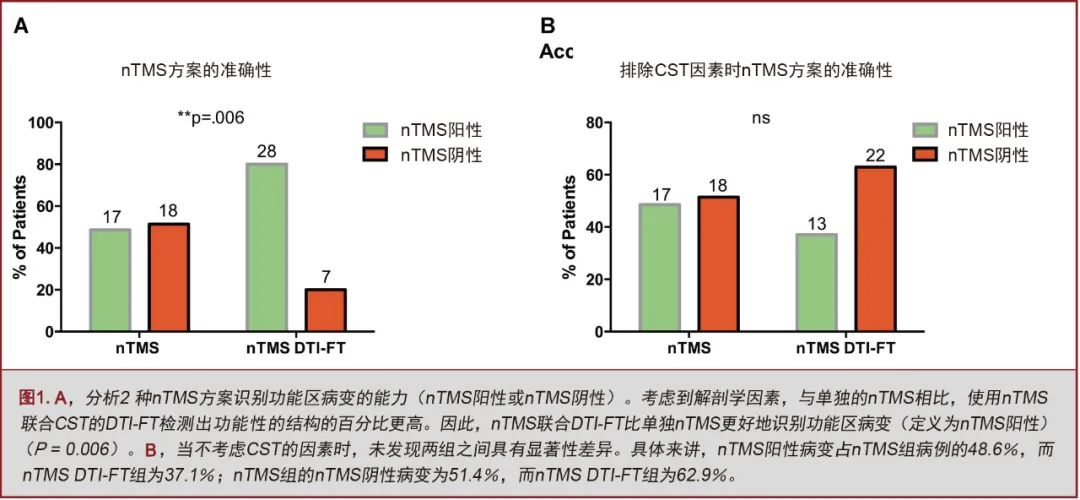
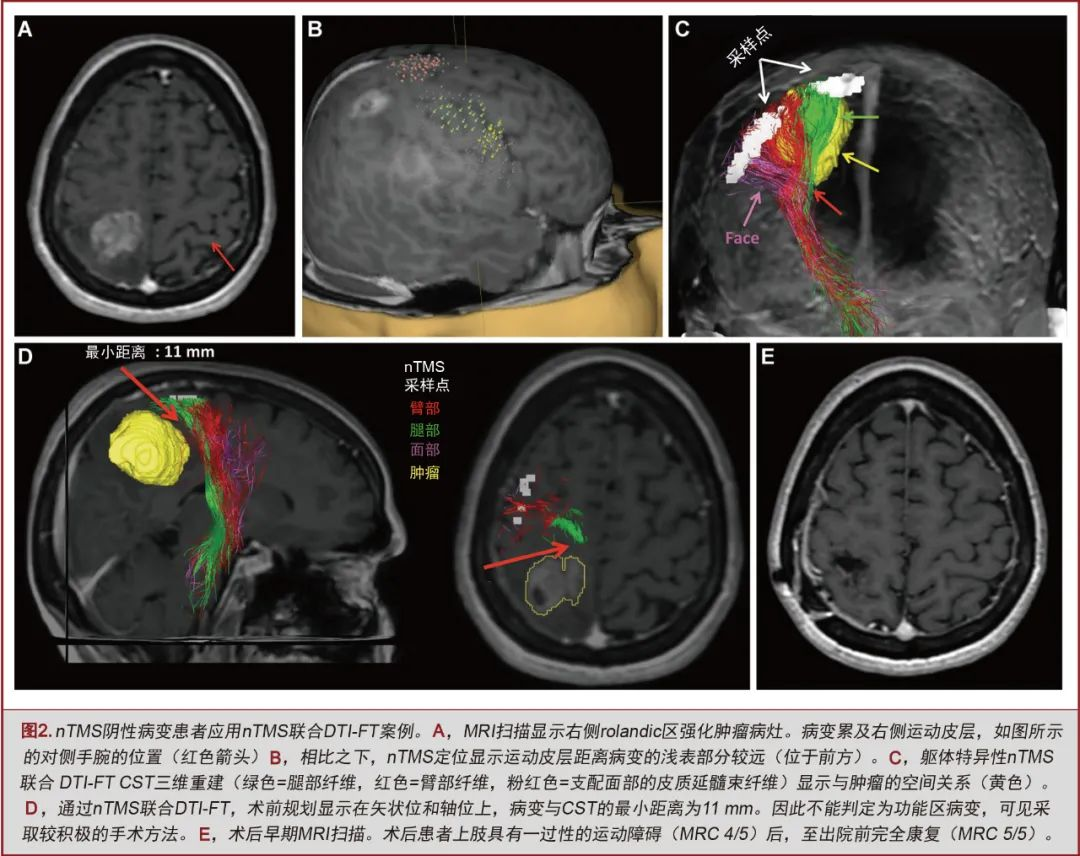
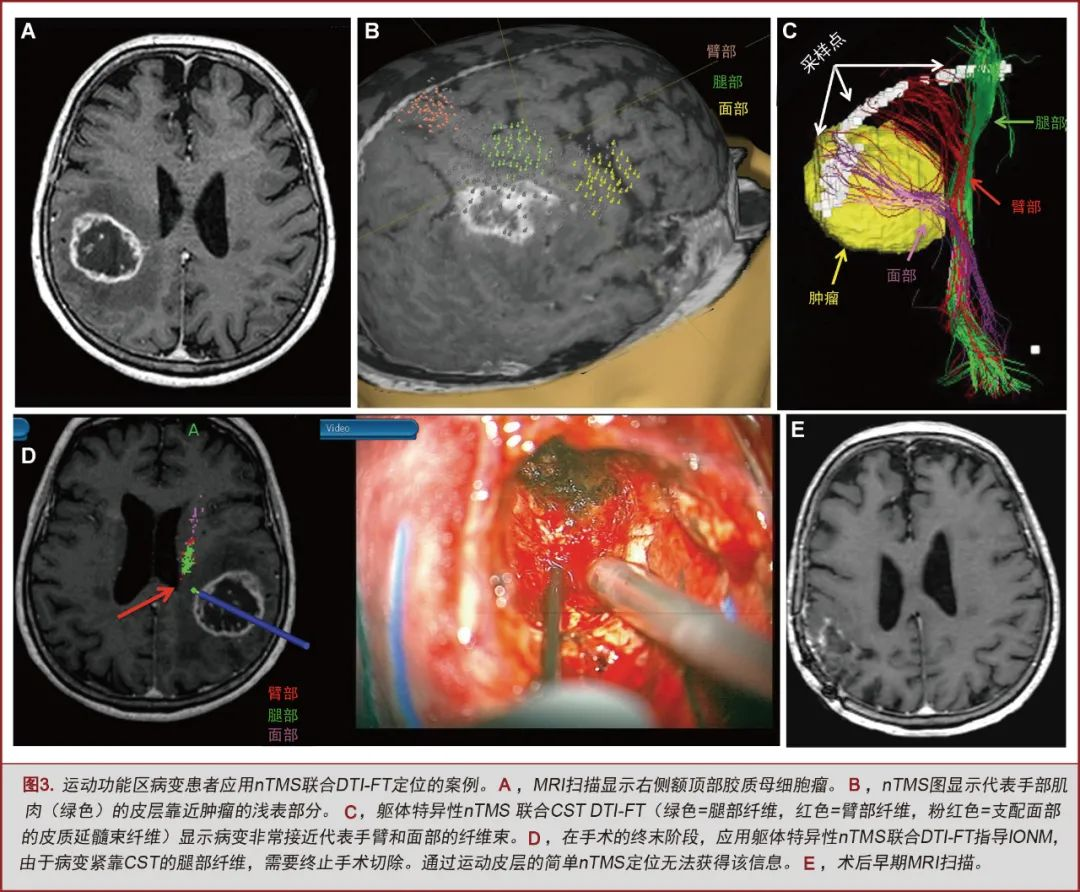
所有nTMS组患者均选择个体化的外科手术入路。具体来说:(1)nTMS获得的数据提高了nTMS联合DTI-FT组28.5%和nTMS组14.2%的高危区域的认识;(2)改变了nTMS联合DTI-FT组17.1%和nTMS组11.4%患者的手术入路。
nTMS联合DTI-FT组和nTMS组分别有20%、14.2%的患者调整了EOR计划。
nTMS联合DTI-FT组中,61.3%的肿瘤患者(11例胶质细胞瘤、3例弥漫性星形细胞瘤、1例少突神经胶质瘤、1例少突原细胞瘤、1例原始神经外胚层肿瘤、2例转移)未发现肿瘤组织浸润CST,而其余38.7%的患者存在肿瘤组织浸润(5个胶质母细胞瘤、4个弥漫性星形细胞瘤、1个少突神经胶质瘤和2个转移)。高级别肿瘤通常不会浸润CST,仅使CST移位甚至保持不变(70.6%)。低级别胶质瘤和转移瘤更常浸润CST(50%),但二者之间无显著性差异。在术前规划中,非浸润性病变通常计划GTR,浸润性病变则计划次全切除/PR/活检手术。
评估EOR和骨瓣大小
nTMS组(51.6%)和nTMS联合DTI-FT组(61.3%)的GTR率高于对照组(42.4%),但无显著性差异(图4A)。
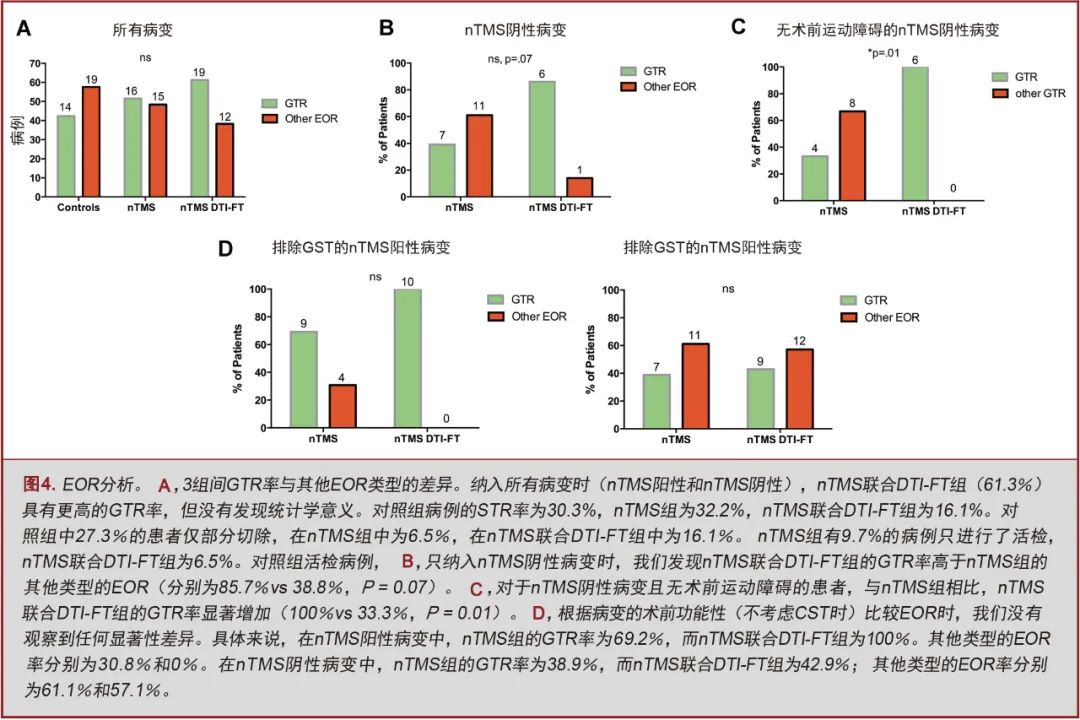
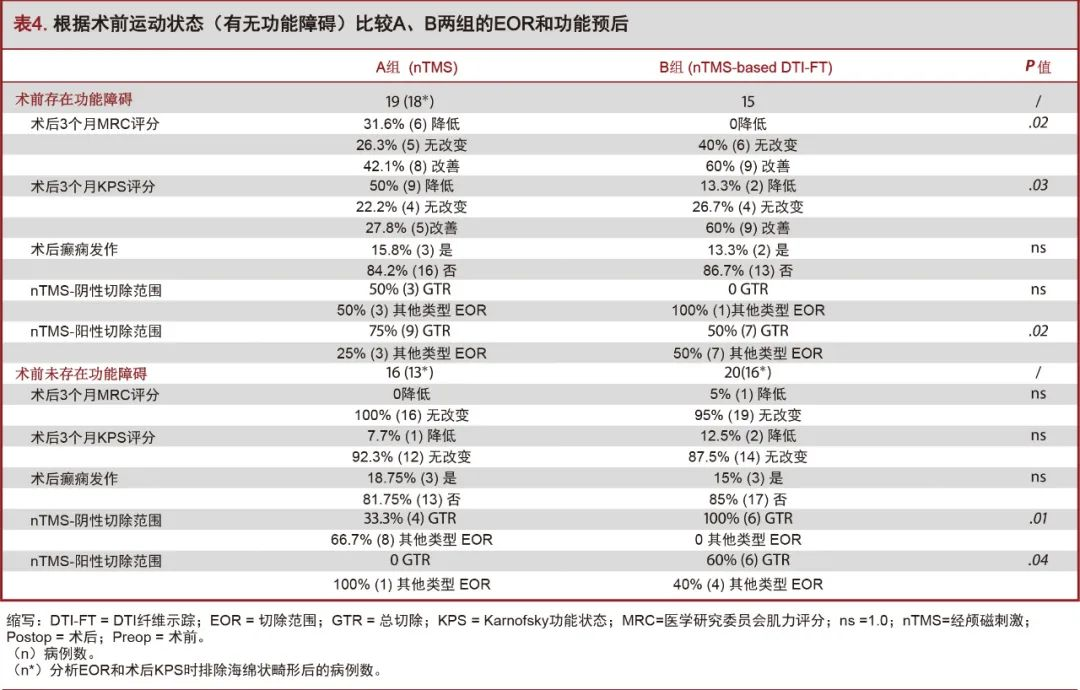
在nTMS阴性病变中,nTMS联合DTI-FT组的GTR率高于nTMS组,差异具有显著性趋势(85.7% vs 38.8%,P=0.07;图4B)。然而,在无术前功能障碍的患者中,nTMS联合DTI-FT组nTMS阴性病变的GTR率显著提高(100% vs 33.3%,P=0.01;图4C;表4)。
当排除CST因素以及仅分析nTMS阳性病变时,两个nTMS组间没有发现任何差异(图4D)。
在CST浸润性病变中,PR占41.6%,STR占41.6%,活检仅占16.6%。所有非浸润性病变均获得GTR。
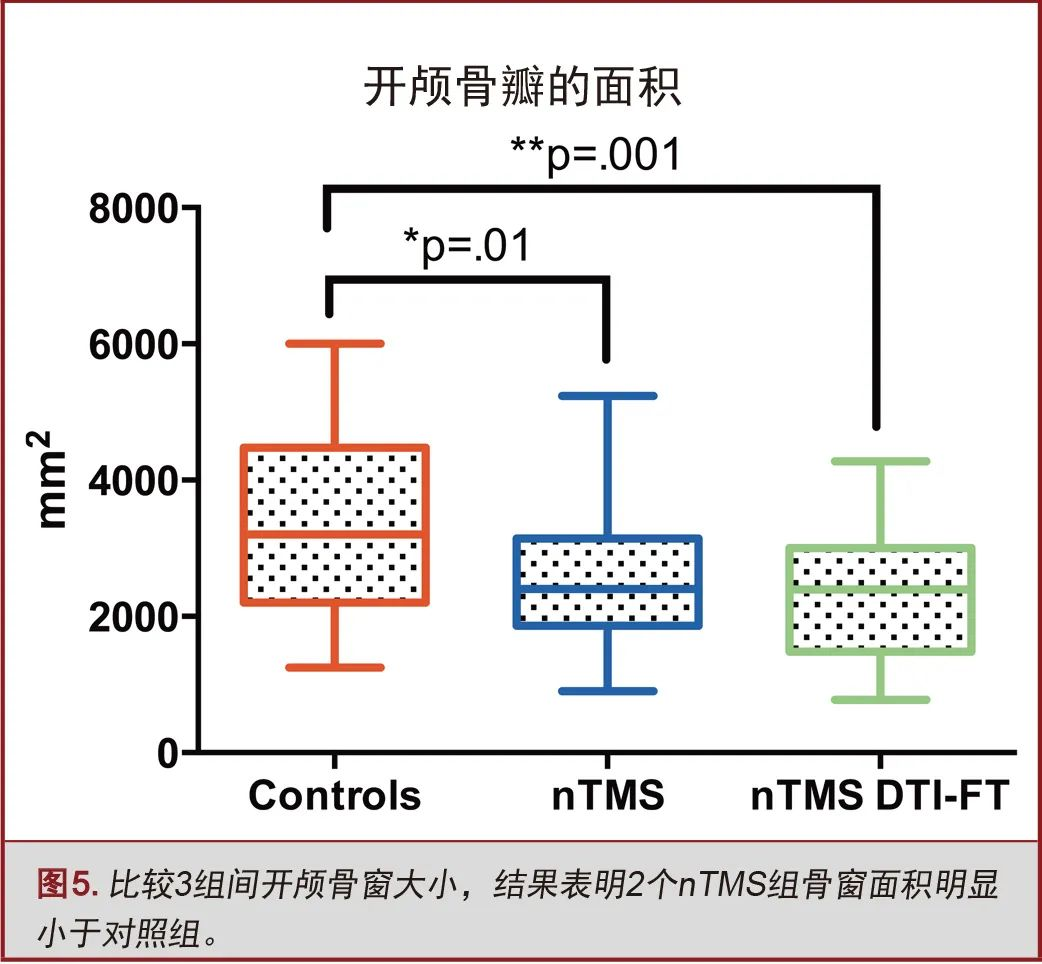
与对照组(32±12cm²)相比,nTMS组(25±10cm²,P=0.01)和nTMS联合DTI-FT组(23±10cm²,P=0.001)开颅骨瓣较小。两个nTMS组间开颅骨瓣大小无显著性差异(图5)。
nTMS联合DTI-FT组出院时有11.4%的患者MRC评分降低,nTMS组和对照组分别为31.4%和57.1%(P=0.001;图6A)。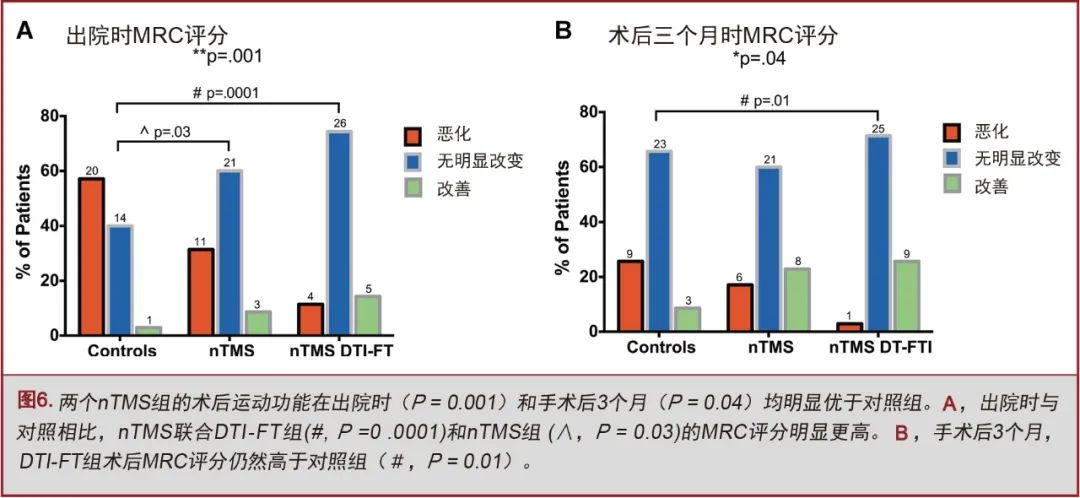
手术后3个月再次评估,nTMS联合DTI-FT组MRC评分仍然优于其它两组(P=0.04;图6B)。nTMS联合DTI-FT组仅有2.9%的患者出现MRC评分降低,nTMS组和对照组分别为17.1%和25.7%。与对照组相比,nTMS组(17.1%)和nTMS联合DTI-FT组(14.3%)的术后癫痫发生率较少(40%;P=0.02;图7A)。两个nTMS组间未发现显著性差异。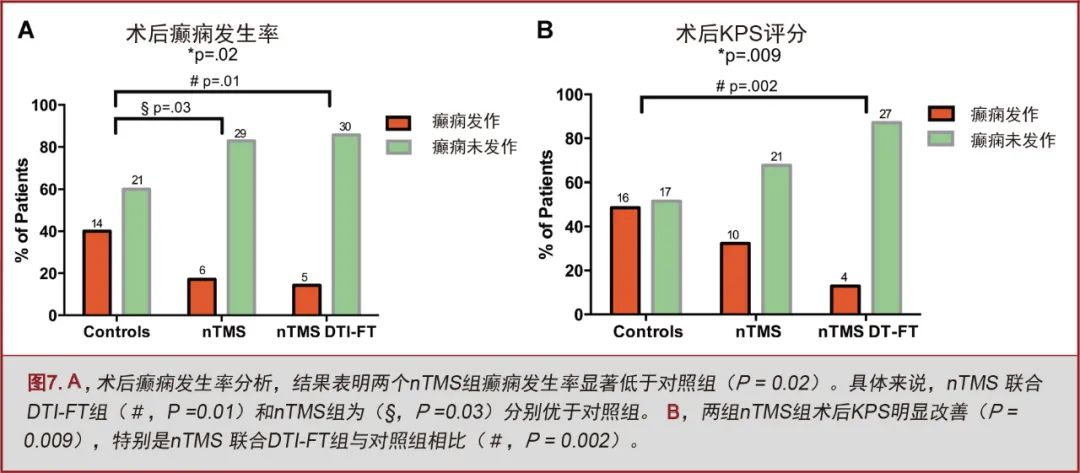
在nTMS组和nTMS联合DTI-FT组中,脑肿瘤患者的术后KPS评分较对照组显著提高(P=0.009;图7B)。在术前存在运动障碍的患者中,nTMS联合DTI-FT组患者术后3个月MRC评分较少下降。(0% vs 31.6%,P=0.02)和KPS评分(13.3% vs 50%,P=0.03;图8)。
本研究发现nTMS定位能够提高疑似累及运动通路病变的手术治疗效果。特别是nTMS联合CSTDTI-FT技术可以在术前预测功能区的病变,制定个体化的手术策略,从而改善患者功能预后。
术前nTMS定位可以使运动功能区病变手术更为安全[28,29]。Krieg等[29]报道,M1皮层nTMS定位可以实现个体化的手术策略,从而缩小开颅骨窗面积,减少肿瘤残留,患者获得较好的运动功能预后。然而,术后运动障碍通常与皮层下CST而不是M1皮层损伤有关[31-34]。Frey等[28]证实,与不使用nTMS定位的对照组相比,基于M1定位的nTMS联合CSTDTI-FT技术能够更好地定义病变的功能界限,进而获得更好的EOR和运动功能预后[28]。
既往研究缺乏对术前皮层定位是否联合CST纤维束成像进行的横向对比。另外,也没有标记代表面部肌肉的皮层定位。最近有证据表明,可以通过nTMS对脑肿瘤患者的面部肌肉映射的皮层进行精确定位[37,53]。使用CSTDTI-FT可辅助运动功能区病变的手术治疗[2,10,11,13,54-59]。然而,标准DTI-FT无法显示侏儒图外侧面的纤维[54,60-62]。nTMS联合DTI-FT可直观显示这部分代表面部肌肉的皮层连接纤维[37,38,40,41](见图,补充材料1,其报告了一个特定躯体位置nTMS联合CSTDTI-FT的病例)。
通过对所有nTMS患者(A组和B组)进行面部肌肉皮层映射定位,重建躯体特异性的CSTDTI-FT(B组;参见文本,补充材料2,关于nTMS联合CSTDTI-FT的技术细节)。术前通过nTMS联合DTI-FT进行手术规划可以改善风险分层。利用nTMS定位方法,本研究发现51.42%病例系假性功能区病变,高于Frey等[28]报道的25.1%。不过,当我们使用nTMS联合CST的DTI-FT时,这一比例为20%。原因可能是nTMS联合CSTDTI-FT能够发现病变与CST的毗邻程度。nTMS联合DTI-FT还能明确CST的移位和浸润,从而影响手术策略。通过nTMS联合DTI-FT定位,优化了风险/获益比评估,对nTMS阴性病变的EOR具有积极影响,特别是当不存在术前障碍时,术者可进行更积极的切除。通过术前直观显示M1/CST的“安全”距离来调整手术策略。根据病变大小决定开颅范围并进行GTR规划。在手术的最后阶段进行DSS,以确认与CST的安全距离。nTMS组采取了更加谨慎的入路,同时所有手术过程均进行IONM(表1)。在nTMS组中,根据术前皮层定位定义的非功能区病变,因为术中DSS显示其紧邻CST,故判定为功能区病变,手术被及时终止。这解释了为什么nTMS联合DTI-FT组中nTMS阴性病变具有较高的GTR率。
CST的术中可视化可指导病变切除;不过,IONM仍然是决定EOR的主要因素,特别是nTMS阳性病变。在某些情况下,nTMS联合DTI-FT可以提高IONM的精确度并确立安全路径以继续切除肿瘤。单极DSS以放射状模式提供电流,可以刺激远离探头的目标(例如,CST)[63-66]。它能反馈推测CST的距离,但不能提供其具体的定位信息。根据我们的经验,nTMS联合DTI-FT的优势在于手术期间CST的可视化反馈,从而增强了对其位置的认识。因此,在某些情况下,即使达到了5mA的阈值,术者仍然可以沿着安全方向继续切除病变,从而在保护CST的同时提高EOR(图9)。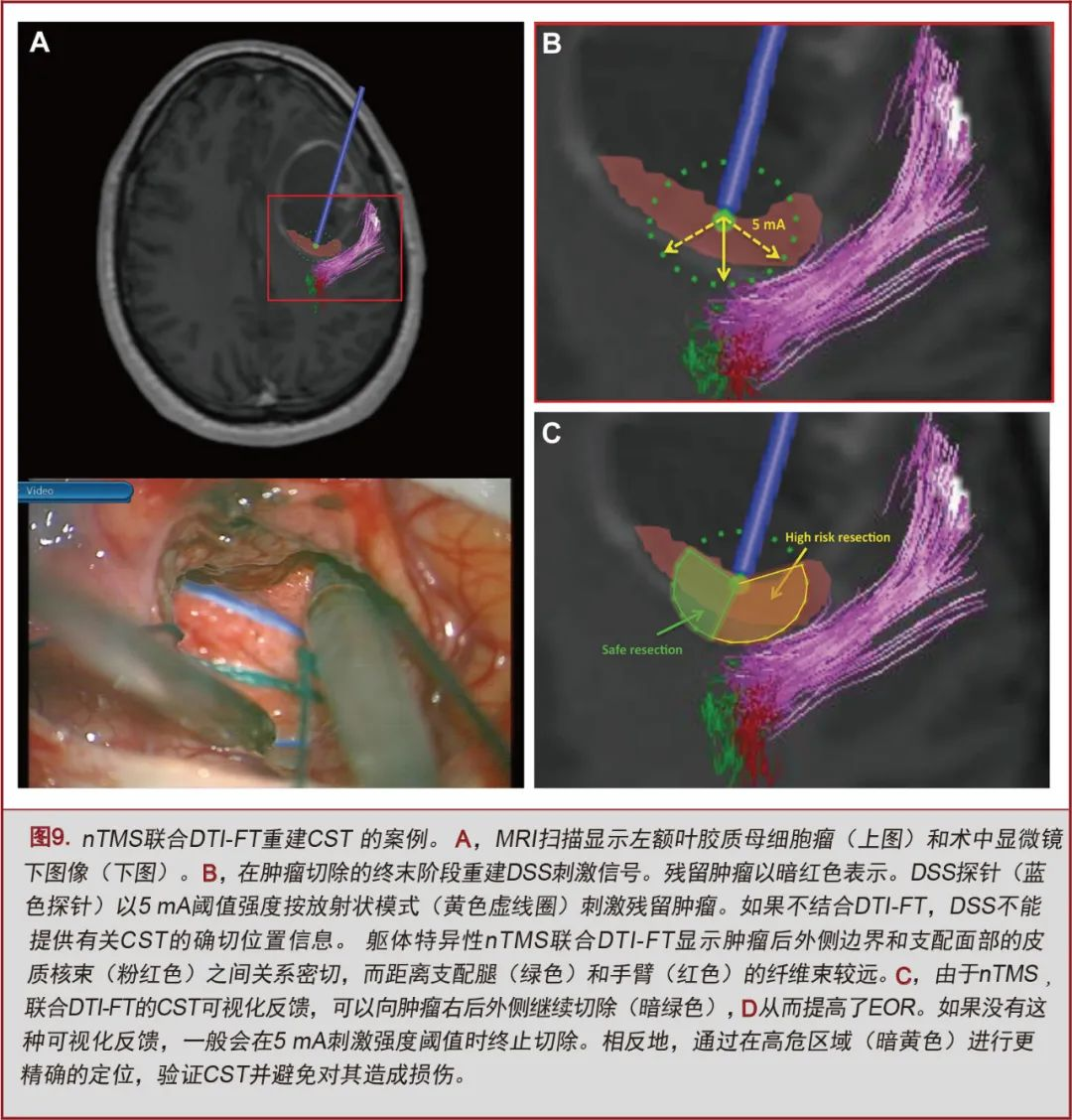
CST的可视化还可以提高DSS空间精度。IONM术后永久性运动障碍通常是由于术野内DSS覆盖范围有限[67,68]。尽管刺激强度位于3-6mA安全阈值内,但因为不能完全覆盖手术部位,DSS定位中断仍有可能引起术后运动障碍[68]。我们认为,CST的可视化反馈可以引导皮层下IONM,从而在高风险区域进行更密集的定位监测(图9)。这解释了为什么nTMS联合DTI-FT组中永久性运动障碍的发生率较低,特别是术前存在运动障碍的情况下。相反地,我们发现术前无运动障碍的nTMS阴性病变患者的GTR率较高,这可以解释为:外科医生非常有把握处理这类远离运动通路,但尚未引起功能障碍的病变。EOR还取决于不同肿瘤的CST浸润模式。nTMS联合DTI-FT在高级别肿瘤中更有价值,因为后者通常推移而不是浸润CST。这种情况下就可以计划并实现最大程度的切除。而在低级别胶质瘤或转移瘤中,大多数CST被浸润,因此能够切除的范围较小[10,54,69,70]。以上结果与文献报道一致,并提示DTI-FT对涉及CST的病变切除程度具有预测作用[12,13,55,59,71]。2个nTMS组比对照组开颅骨窗更小,这与Krieg等[29]报道的结果一致。
与对照组相比,2个nTMS组患者的功能预后都得到改善。此外,在术前存在运动功能障碍的患者中,nTMS联合DTI-FT组的永久性障碍和KPS评分降低的发生率明显低于nTMS组。这可能是病变累及CST引起高度重视的缘故。无论使用DTI-FT与否,nTMS定位组至少在短期内(1个月)有效控制了癫痫发作。这估计与更高的EOR有关,尤其是对于nTMS阴性病变,其减少了导致术后癫痫发作的相关因素,例如病灶周围水肿和皮质刺激[72,73]。最后,本研究通过应用nTMS改善了患者的术后KPS评分,特别是在术前出现运动障碍的情况下。这可能是与整个运动通路的准确定位有关。当然,还应该考虑到KPS可能受到本研究中未控制的几个因素的影响。本研究属于回顾性分析,其潜在的选择和专业知识偏倚降低了该研究结果的说服力。首先是3组患者的招募和手术时间不重叠,这可能会改变术者对手术入路的态度。其次,术前确认功能区病变还取决于外科医生的判断(在TMS和手术前)。这可能会影响不同中心之间的数据的比较。该研究与其他nTMS研究具有相同的局限性,例如不能对严重运动障碍患者进行定位[74]以及在严重病灶性水肿的情况下DTI纤维束成像存在的固有缺陷[75,76]。最后,在没有术中成像的情况下,脑漂移是神经导航手术难以避免的缺陷[57,77,78]。不过,通过采取脑暴露最小的个体化的手术入路,以及持续验证浅表解剖标志可能会减少由于脑漂移造成的误差[54]。
nTMS(尤其是nTMS联合CSTDTI-FT技术)适用于疑似运动功能区病变的手术治疗。通过强化运动通路和病变之间空间关系的认识,优化术前风险/获益评估并制定个体化手术策略,在IONM监测下实现最大限度的安全切除,最终给患者带来更好的功能预后。因此,有必要开展进一步的前瞻性研究。












声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。




































