
脑膜瘤是人类中枢神经系统中最常见的原发性肿瘤之一,它主要来源于脑膜上皮的蛛网膜细胞[1,2]。大约80%的脑膜瘤属于WHO I级,被认为是具有良性组织学行为的低级别脑膜瘤,其余20%的脑膜瘤则表现出侵袭性行为,包括非典型脑膜瘤(WHO II级)和间变型脑膜瘤(WHO III级)[3]。目前在大多数低级别脑膜瘤中驱动肿瘤发生、发展的突变基因及其机制已经初步明确,但是在少数罕见的高级别脑膜瘤中的相关研究仍然进展缓慢,并且这些肿瘤难以通过手术达到完全治愈[4-7]。
横纹肌样型脑膜瘤(Rhabdoid Meningioma)是脑膜瘤中一种特殊而少见的病理亚型,属于WHO III级,具有高侵袭性、高复发率和高死亡率的临床特点[2,8-10]。然而,有临床研究表明具有横纹肌样特征的脑膜瘤存在生物异质性,即一部分肿瘤具有间变性高级别肿瘤的组织学特征,而另一部分肿瘤缺乏明显的恶性特征。这部分缺乏恶性特征的患者,即使其肿瘤内广泛存在横纹肌样特征,但其病程也是良性的[11]。临床上对于横纹肌样型脑膜瘤的诊断因其罕见性和生物异质性而出现较大差异,也就无法为这一类患者做出合适的治疗选择[12]。因此,明确横纹肌样型脑膜瘤的驱动基因及其机制将有利于实现更准确的诊断和治疗并有效改善患者的预后。本期将向各位简单地介绍在横纹肌样型脑膜瘤中BAP1分子的相关研究进展。
01
BAP1分子的生物学功能
BRCA1相关蛋白1(BRCA1-associated protein 1,BAP1)是由BAP1基因编码,由729个氨基酸所组成的去泛素化酶,可以去除底物蛋白质的泛素化修饰,使底物逃离“泛素—蛋白酶体”降解途径,并增强其稳定性,或影响底物的功能活性,从而调控相关信号传导[13]。目前已发现的BAP1的去泛素化底物包括H2A、KLF5、γ-tubulin以及BAP1自身等。BAP1可以特异性去除组蛋白H2A的第119位赖氨酸的单泛素化修饰,调控下游基因的表达[14];也可通过去除KLF5和γ-tubulin的泛素化修饰,调控蛋白质的稳定性[15,16]。
除了依赖于催化活性的功能外,BAP1也通过其他方式参与细胞内功能的调控,包括转录、表观遗传、DNA损伤修复等。多梳家族(Polycomb group)是调控细胞分化的转录抑制蛋白质,其主要家族成员为PRC1和PRC2[17]。PRC2调控组蛋白H3第27位赖氨酸(H3K27)的甲基化修饰,而PRC1则被招募到甲基化的H3K27位点,对组蛋白H2A第119位赖氨酸(H2AK119)进行单泛素化修饰,从而协同沉默基因转录过程[18]。在DNA损伤应答反应中,BAP1可在损伤区域与ASXL1/2形成PR-DUB复合物,拮抗H2AK119的单泛素化修饰,调控染色质结构,或去除BRCA1的自我泛素化修饰,维持其活性平衡,从而调节损伤修复过程[19,20]。(图1)
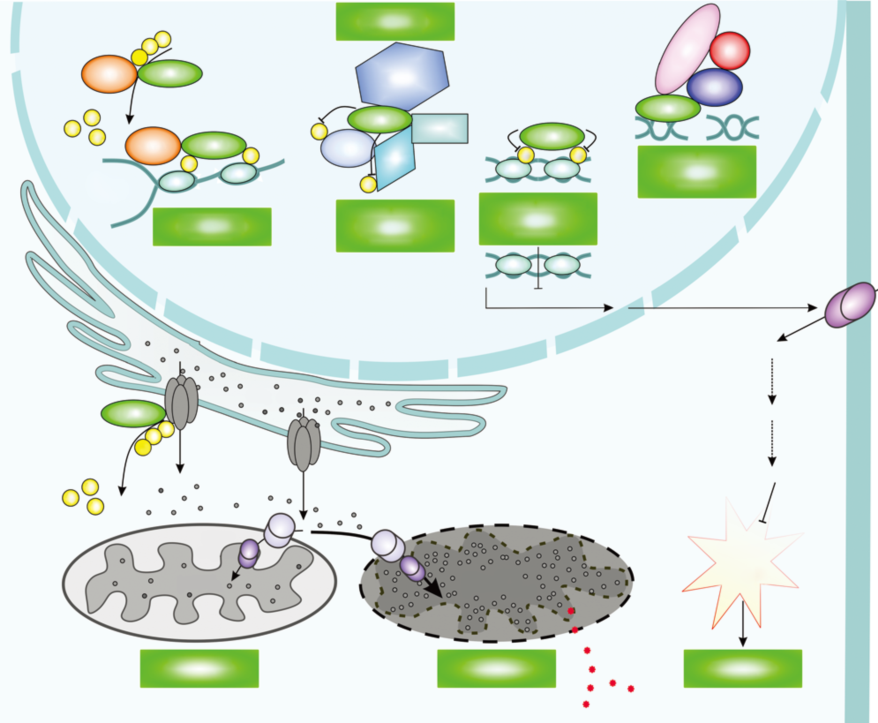
图1. BAP1在细胞核和细胞质中的生理功能。(引自图Carbone Michele,Harbour J William,Brugarolas James et al. BAP1 Biological Mechanisms and Clinical Significance of Mutations in Human Cancer.[J]. Cancer Discov, 2020, 10: 1103-1120.)
02
BAP1分子在肿瘤中的相关研究
目前的研究表明BAP1在多种恶性肿瘤中发挥着调控肿瘤发生、发展的重要作用。研究人员将BAP1过表达后发现其可以显著抑制肺癌细胞NCI-H226在裸鼠中的成瘤能力,并且发现BAP1的抑癌性依赖于自身的催化活性和细胞核定位[19]。BAP1的基因突变可以影响BAP1蛋白的酶活性,导致其核定位序列的缺失,从而破坏其抑癌功能,最终引起肿瘤的发生、发展[21]。另外也有研究表明BAP1可以通过去除转录因子KLF5的泛素化修饰,增强其稳定性,促进乳腺癌的发生发展[16]。
BAP1基因的胚系突变(Germline Mutation)和肿瘤易感综合征密切相关,该综合征表现为人类罹患多种恶性肿瘤的风险显著增加,特别是恶性间皮瘤、皮肤黑色素瘤、葡萄膜黑色素瘤、基底细胞癌以及肾细胞癌等(图2)[22,23]。有研究显示,BAP1基因的胚系突变导致一个家庭中三位成员分别罹患葡萄膜黑色素瘤、肺腺癌和脑膜瘤[24]。另有研究显示,同样的基因突变出现在有着恶性间皮瘤家族史的两位脑膜瘤患者身上[25]。肾细胞癌中的一小部分呈家族性发病,且多由Von Hippel-Lindau(VHL)综合征引起,随着VHL基因大量缺失,同在染色体3p区域的其他抑癌基因,如BAP1也发生缺失突变[26]。
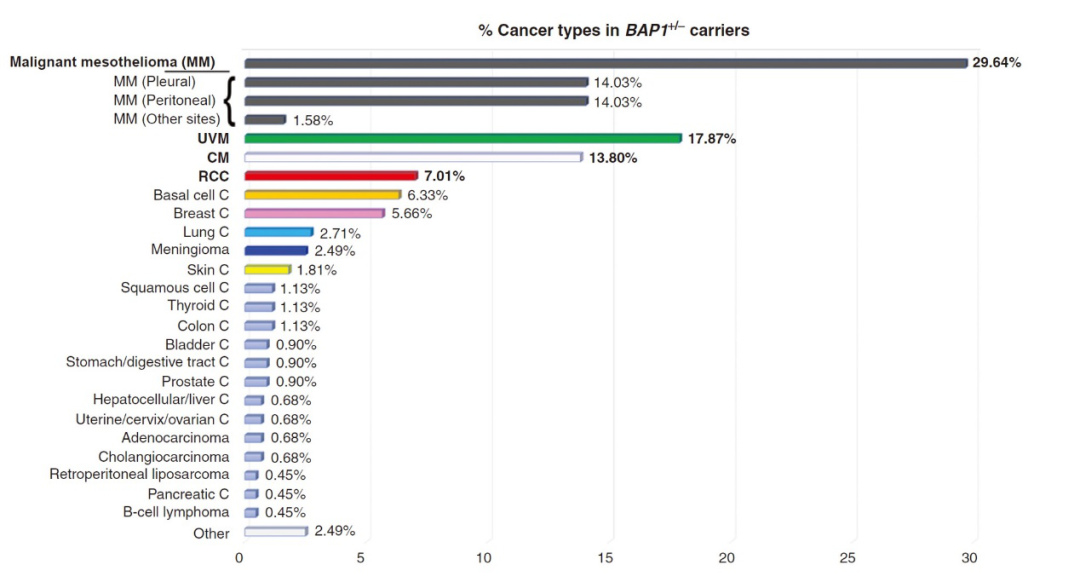
图2. BAP1+/-携带者在不同肿瘤类型中的占比。(引自图Carbone Michele,Harbour J William,Brugarolas James et al. BAP1 Biological Mechanisms and Clinical Significance of Mutations in Human Cancer.[J]. Cancer Discov, 2020, 10: 1103-1120.)
03
BAP1分子在脑膜瘤中的相关研究
BAP1分子是侵袭性脑膜瘤的一种重要的生物标志物[27]。脑膜瘤中的BAP1基因突变通常与具有横纹肌样或乳头样组织学特征的一个脑膜瘤亚群密切相关,而这类肿瘤具有高侵袭性和高复发性的特征,严重影响着患者预后(图3)[10,23]。一项对27例横纹肌样型脑膜瘤的测序研究中发现携带BAP1基因突变的患者的中位复发时间为26个月,而没有BAP1突变的患者则长达116个月[10]。虽然这类肿瘤被认为高级别的侵袭性肿瘤,但在没有明显高级别组织学特征的情况下,一些具有横纹肌样形态的肿瘤表现出的惰性行为,类似于WHO I级脑膜瘤,这表明具有横纹肌样特征的脑膜瘤具有生物异质性[11]。Shankar等报道了在BAP1突变型脑膜瘤中更常见的类型是BAP1胚系突变而非体细胞突变(Somatic Mutation),这提示了BAP1突变型脑膜瘤可能具有更明显的遗传倾向[23,28]。另有研究显示,BAP1分子的生物学功能异常与基因融合、剪切位点改变和甲基化状态改变等多种机制有关[28,29]。在其他类型的肿瘤研究中,人们发现BAP1突变失活可能增加肿瘤对EZH2和PARP抑制剂的敏感性,这提示BAP1也可能是一个潜在的治疗靶点[30]。
目前,临床上应用的免疫组织化学技术可以检测出肿瘤中广泛而显著的BAP1蛋白缺失,这不失为一种简单、快速且廉价的筛选方法。但是,BAP1分子的功能异常是由包括外显子、内含子、启动子序列改变、甲基化改变和拷贝数改变等在内的广泛的基因组异常所导致的[29,31,32]。因此,单一的检测方法可能无法有效地检测出BAP1基因突变,也常常会出现免疫组化结果和基因测序结果不一致的现象。值得注意的是,几乎所有超过55岁的携带BAP1胚系突变的患者都已经罹患一种或多种恶性肿瘤[33,34]。BAP1相关的肿瘤易感综合征的一个重要的标志通常在被诊断为“非典型黑色素瘤”或“黑色素细胞BAP1突变非典型皮内肿瘤”的患者皮肤上出现[35]。这些患者身上的特征性皮肤病变主要表现为褐色到红褐色的圆顶状丘疹,出现在1/2~2/3的BAP1胚系突变携带者中,而且上述特征通常在恶性肿瘤发生之前就已经出现了[36]。因此,在有条件的情况下,对所有经免疫组化检测的BAP1突变阴性横纹肌样型脑膜瘤患者进行BAP1胚系突变筛查是必要的;而对于BAP1突变阳性的患者而言,除了接受常规的临床病理检查之外,寻求专业的遗传咨询和接受全面的基因检测具有重要意义。
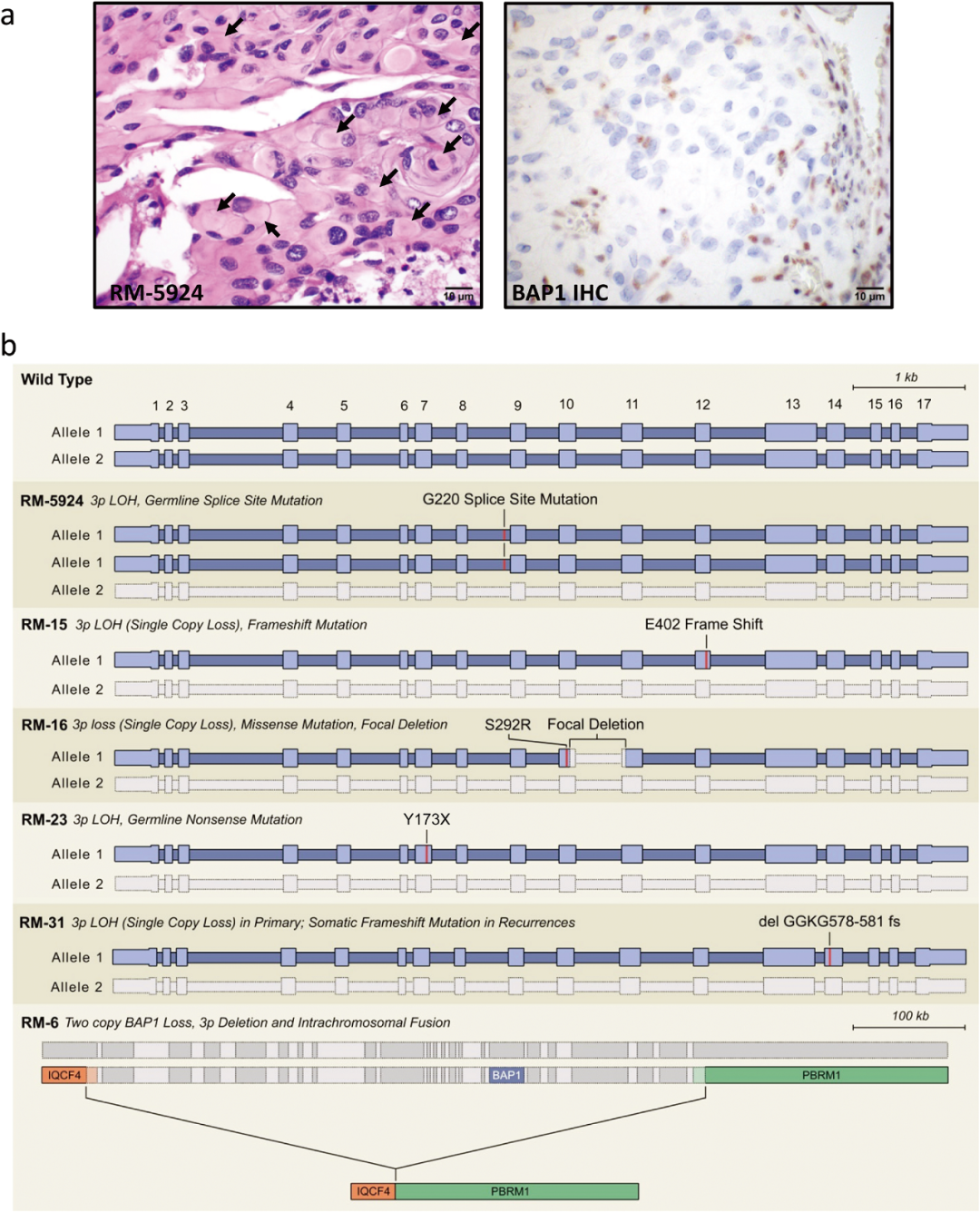
图3. BAP1缺失在横纹肌样型脑膜瘤中的表现。(A)H&E染色和BAP1免疫组化染色;(B)在横纹肌样脑膜瘤中BAP1基因突变导致BAP1失活的示意图。(引自图Shankar Ganesh M,Abedalthagafi Malak,Vaubel Rachael A et al. Germline and somatic BAP1 mutations in high-grade rhabdoid meningiomas.[J] .Neuro Oncol, 2017, 19: 535-545.)
结语
目前对于高级别、高复发和颅底脑膜瘤等难治性脑膜瘤患者的治疗仍然面临着手术完全切除困难、放疗效果有限和缺乏有效化疗药物和靶向治疗方案等困境。随着近些年分子生物学研究的不断发展进步和临床医生将基因测序技术逐步应用于脑膜瘤的分子诊断中,人们对脑膜瘤的发病驱动因素、发生发展机制和潜在治疗靶点有了更全面而深入的理解。这其中一些驱动肿瘤的突变基因(如BAP1等)具有良好的预后价值,并可能用于完善未来的分类标准,更有可能成为未来的治疗靶点。随着对靶向治疗和免疫治疗的不断探索,在不久的将来,我们有望找到对脑膜瘤患者疗效明显的综合治疗方案,使患者最大程度地获益。
参考文献
专家简介

阔然精准诊疗脑肿瘤产品CaptioX-M是一款以NGS技术为基础的检测产品。CaptioX-M用于脑膜瘤的分子诊断,涵盖了脑膜瘤复发相关的67个基因(NF2、TERTp、CDKN2A/B、ARID1A和BIP1等)、预后相关的染色体(22q、1p、5、10等)拷贝数变异和潜在靶向治疗相关基因的信息,脑膜瘤CaptioX-M可用于脑膜瘤患者分子分型、预后评估和辅助医生制定治疗策略。
“阔然生物医药科技(上海)有限公司(Shanghai KR Pharmtech, Inc. , Ltd.)”简称“阔然基因”,是一家专注于医学研究与转化的企业,专注于脑肿瘤的分子诊断与个体化治疗业务,现已有两家(上海、徐州)国家卫生健康委员会认证的医学检验实验室,在基因检测领域有自主知识产权,拥有完善的全国医疗市场的销售渠道,战略合作的神经外科医生的媒体“神外资讯”,目标成为脑肿瘤分子诊断与个体化治疗领域中国第一品牌。阔然基因重视自有技术开发,目前已建高通量测序平台、单细胞测序平台、多标荧光免疫组化平台,阔然基因在硬件与试剂盒产品端发力,布局术中、术后诊断领域,打造自有技术和行业壁垒,成为并巩固在脑肿瘤领域的领跑者地位。目前阔然基因已布局了术后分子诊断、ddPCR脑脊液检测技术和应用,以及术中实时诊断系统。





