“opheléeinêmêblaptein”(首先有用,还需无害)
—希波克拉底
![]()
幕上“II级胶质瘤”(根据目前的WHO分类定义)是一种成人罕见而复杂的疾病。在过去的几十年间,一直存在争论,其原因有很多。
首先,长时间内缺乏对这类疾病的自然病史的研究,因此不了解其自然病史。的确,在传统的文献中,绝大部分作者认为WHO II级胶质瘤是一种“稳定的”“良性”的脑肿瘤。因此,多年来一直提倡“观察随访的态度”,尤其是患有这类肿瘤的年轻人“生活正常”。换句话说,传统的观点认为这些病人是“正常”的,是因为即使80%-90%的病人因初发癫痫而口服抗癫痫药物治疗,但标准的神经系统查体并未发现异常。
此外,从事神经肿瘤的内科和外科专家均认为切除此类肿瘤,特别是位于所谓的功能区的此类肿瘤,不可能没有神经功能缺失而切除肿瘤。最重要的是,以往主要根据神经外科医生主观估计切除程度,因此,曾认为外科切除对这种疾病的自然病程没有影响,最佳治疗方法是活检获取组织进行神经病理检查,以确定后续治疗是单纯观察还是放疗。这意味着治疗选择几乎完全根据WHO形态学标准分类(星形细胞瘤或少突胶质细胞瘤或混合性胶质瘤;II级或III级)。
最后,临床结局大部分仅依靠少数参数来评价,如无进展生存时间(PFS),总生存期(OS),及KPS评分。
幸运的是,当今遗传学、认知神经科学、影像学和治疗技术和概念的发展,彻底改变了我们对这种疾病的认识,形成了个体化治疗的基本原则。此外,对大脑处理过程的进一步了解,使得我们现在能够兼顾考虑疾病(胶质瘤)和宿主(大脑)之间的相互作用,因此可动态调整治疗策略,最终既提高中位生存期,又改善生活质量。也就是说,解决了总生存期和大脑功能保护之间的经典矛盾。在这种背景下,这本书的目的是复习“WHO II级胶质瘤”病人的生物学,行为学及治疗方法,为了解这种肿瘤的起源、自然病史、基于肿瘤学和认知科学的现在和将来个体化治疗策略开辟新途径。
事实上,在过去的十年间,基于大量原创数据的发表,是应该摒弃上述教条主义的观点,采用一个全新的方法去了解和治疗这种疾病。首先,由于这种肿瘤的不稳定性及不断增长,最终在10年内会发生恶性转变,进而引起神经功能损害和死亡。此外,神经肿瘤专家(特别是神经外科医生)必须理解这类胶质瘤不是一种“肿瘤团块”挤压周围的脑组织,这种弥漫性病变实质是一种浸润性的大脑慢性病变,在神经影像学上的浸润远远超过可见的异常区域。以往的确曾认为在神经影像上的异常区域(起初是CT成像,后是MRI上的FLAIR高信号)为整个病灶区域(包括水肿区),因此曾提出异常信号周围的“正常脑组织”,这都是完全错误的描述,这个观点对治疗(尤其是外科治疗)非常管理关键。这也就是为什么本书中使用“弥漫性低级别胶质瘤”这一名词,因为这种肿瘤从本质上不包括边界清楚的WHO I级胶质瘤(也是“低级别”)。我们也没有采用目前WHO的分类,事实上曾有很多报道:病理专家之间甚至病理专家本人对某一亚型肿瘤和分级存在很大争议(比如由于对同一形态学标准的不同解释,法国和美国的星形细胞瘤和少突胶质细胞瘤病人的比例就相反):WHO的分类中没有正式提出在所谓的II级和III级之间中存在连续性,而实际上很多胶质瘤存在“中间”分级(如在II级胶质瘤中心部存在一些“更恶性”的微病灶)。因此,本书使用“弥漫性低级别胶质瘤”这一名字,明白这类肿瘤,甚至“星形细胞瘤”或“少突胶质细胞瘤”每个亚型内部也存在异质性,以便重新进行多模态分类,使之更适合于临床实践。
从功能角度来讲,这类病人在疾病诊断时已有神经认知障碍,因此需要在治疗前后系统的进行认知功能评估(经典的神经系统查体,不能灵敏的客观评估弥漫性低级别胶质瘤病人的功能障碍)。个体化治疗以优化病人的生存期与健康相关的生活质量也非常重要,例如,通过避免早期放疗来防止放疗对高级功能带来的远期损伤。为此,需要提出新的治疗终点,所有的弥漫性低级别胶质瘤本质上来讲都持续生长,任何治疗前或在不完全切除术后的无进展生存期是毫无意义的(而在“全切“后无进展生存期这个终点是很有意义的,在辅助治疗如化疗/放疗后,这个终点也或多或少有一些意义)。因此,最初由Macdonald等建立,现由RANO团队修订的经典影像学标准,不合适用来监测弥漫性低级别胶质瘤的动态发展。应该在每次治疗前后按照磁共振的FLAIR序列进行一次客观的,准确的3D体积评估,来计算病人个体的肿瘤增长速度。新的代谢学指标也有助于提高影像学监测的敏感性。
此外,对DLGG的自然病史有了更好的理解后,就有了我们首创的DLGG的个体化治疗策略。在过去十年里,大量证据表明,最大范围的切除DLGG可推迟其恶性转变,进而延长总生存期,最终对其疾病进程有十分重要的影响。此外,无创性神经影像学和术中电生理定位(直接电刺激皮质和皮质下白质通路)能更好的了解每个病人的功能解剖动态变化,可以最大程度的切除“功能区”病变,同时保留甚至改善术后生活质量(癫痫控制及特殊的功能康复后认知功能的改善)。同样,这种基于功能定位的手术切除新理念(不再单纯基于解剖或肿瘤影像来切除)也可提高切除程度,进而延长总生存期。换句话说,认知神经科学和神经肿瘤学的更紧密结合解决了(至少部分解决了)DLGG的传统困境:总生存期和生活质量之间的矛盾。通过把脑重塑和脑连接(即把脑理解为平行分布,相互作用的皮层-皮层下子网络)等理念引入新的手术概念中,优化肿瘤学和功能两方面的结局。特别是,数年前由于考虑功能因素二部分切除肿瘤后,脑功能会发生重塑,可进行再次更大范围的切除手术。
此外,由于新的化疗药物(如口服替莫唑胺)耐受性明显改善,以及它在肿瘤学角度(肿瘤可能稳定,甚至缩小)和功能学角度(如可控制难治性癫痫)的疗效,其在DLGG中使用越来越多。这是我们最近倡导的新的治疗策略的原因之一,例如对有些不能手术切除的DLGG(如双侧侵袭)进行新辅助化疗,病变缩小后,为下一步手术创造了机会。同样的思路,放疗的实际受益风险比也会被重新定义,目前的趋势是延迟放疗。
另外,最近的分子研究可更好地理解DLGG的生物学行为,可以解释尽管一些有相同的临床、影像学,甚至病理学表现的肿瘤,它们的行为学和预后也存在异质性,因此当前的WHO分类需要进行调整。这本书还特别展示了基因组学和蛋白质组学的新进展,讨论其可能的预后或预测价值。同样,对DLGG的起源更好的理解可能开发出如针对祖细胞的新的抗肿瘤药物。为此,DLGG的改良动物模型使得探索这种肿瘤的发生机制向前迈进一大步,以便确定新的治疗靶标以及检测一些新的分子。此外,使用生物数学模型也可更好的推测出胶质瘤的“出生日期”,这提示可对一些人进行MRI筛查,早期发现DLGG,可对早期诊断的无症状的病人进行早期更有效的治疗。
总之,对DLGG病人目前的处理哲学就是在个体化层面,从疾病诊断到恶性转化期间,建立一个多模态和长期的病人管理措施,通过定期的功能反馈和影像学监测实时调整治疗策略。事实上,由于对DLGG不良预后的进一步认识,“观察随访”的治疗态度已经再适合(即使病人正常生活)。尽管临床医生必须记住经典的“不可伤害”原则,但也必须意识到他们什么都不做,也就是看到肿瘤进展而不作为事实上也是一种伤害。我们是通过处理这种疾病来达到最佳效果。在这种理念下,DLGG的最终目标是这种肿瘤即使没有完全治愈,但也可以保持理想的生活质量的同时,尽可能地延迟其恶性转变,也就是迈向“功能神经肿瘤学”这一目标。
值得注意的是,随机试验并不适合这类疾病,这是由于其生存期长(在实际操作中存在困难以及诊断和治疗技术进步导致最后的结果存在争议)及可能涉及的伦理问题。需要提醒的是,临床服务必须以病人为中心和建议病人被招募到随机临床试验(形成证据使学科向前发展)存在一定的矛盾。神经肿瘤学家能否确定在目前对病人有益和将来原则上有益之间没有潜在的矛盾?这个问题至少在某种程度上可能解释为什么DLGG缺乏手术(临床)试验。因此,需要更加系统的前瞻性收集资料,建立国家和国际数据库。
最后,最重要的一点,需要在内科和/或外科肿瘤专家与病人之间建立诚实的,牢固的和独特的联系,在治疗起初及随访数年间,需要给病人提供清晰的完整的信息。换句话说,在“循证医学”时代,也不能忘记“个体化医疗”也很关键。
![]()
病例1
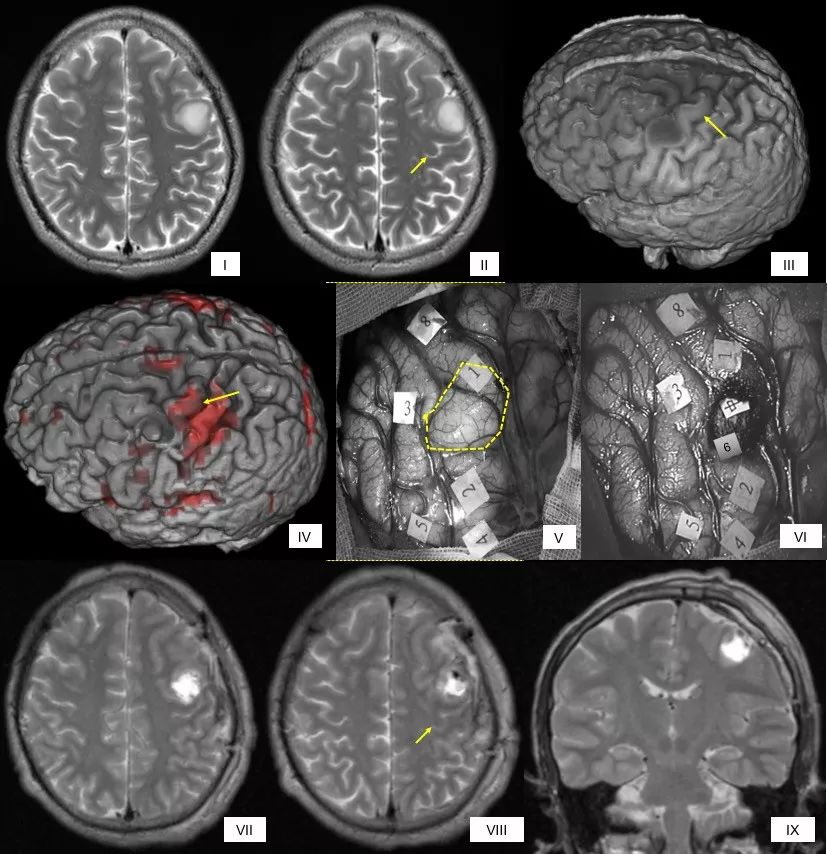
唤醒手术扩大切除胶质瘤:全麻术中唤醒状态下最大安全切除右侧辅助运动区胶质瘤,中央前回、中央前回的横回和锥体束作为切除后界,术后MR:肿瘤全切,术后3月恢复正常生活。图I-III术前常规磁共振,分别是轴位T2、轴位T2-FLAIR、冠状位T2,黄色箭头指示手结位置(下同);IV为功能磁共振表面图:红色为手动任务激活区;图V为术中皮质DES(3.5mA)照片。标志点1:手指运动;2:手指感觉;A:前界,B:外界;C:后界;D:内界;图VI为术中皮质下DES照片:标志点3:手运动的横回;4:手运动(锥体束);图VII-IX为术后次日MR,显示肿瘤全切,分别是轴位T2、轴位T2-FLAIR、冠状位T1。病人术后短暂左侧肢体偏瘫,肌力0级,考虑存在SMA区综合症。术后3月恢复正常生活工作,无明显神经功能障碍,四肢肌力V级。
病例2
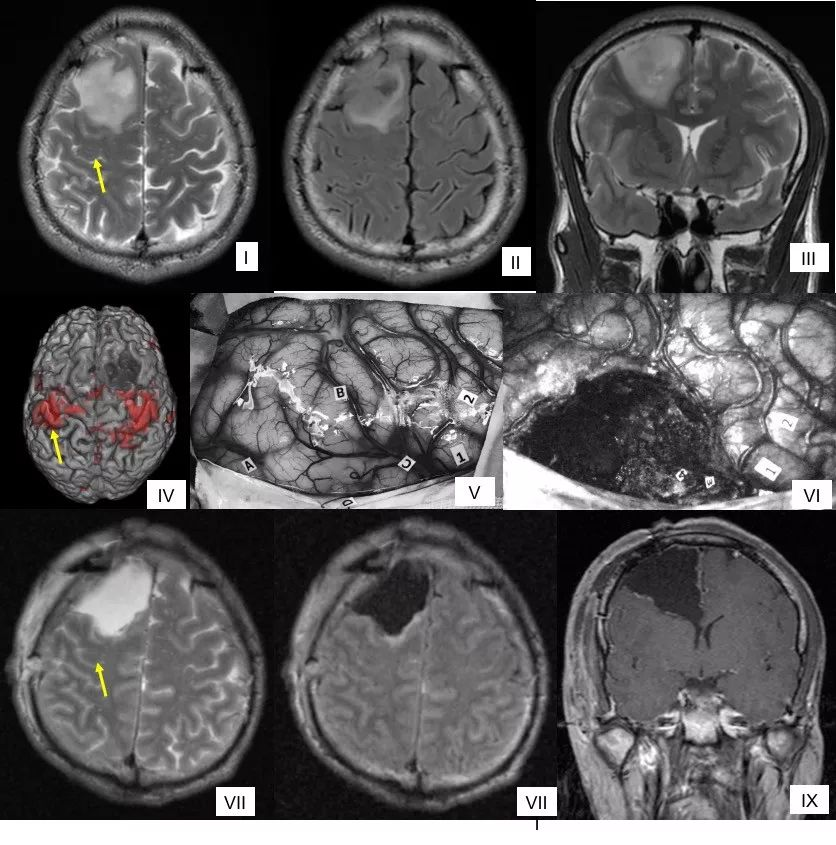
如果严格按照边界切除,必然造成病人瘫痪。全麻术中唤醒状态下最大安全切除左侧中央叶胶质瘤,中央前回、锥体束为切除前界,大拇指的感觉区为切除外侧界,术后MR显示肿瘤次全切除,术后3月病人轻度神经功能障碍。图I-III术前常规轴位T2磁共振,黄色箭头指示手结位置(下同);IV为功能磁共振表面图:红色为手动任务激活区;图V为术中皮质DES(4mA)照片:标志点1:拇指运动;2:口角运动;3:拇指感觉;4:小指感觉;A:前界;C:外界;D:内界,肿瘤已侵袭运动区皮质;图VI为术中皮质下DES照片:标志5:脚动(锥体束),可见上引流静脉保留;图VII-IX为术后次日轴位T2磁共振显示肿瘤次全切除,手结部位部分残留,术中直接电刺激证实影像学异常区域的手结存在运动功能。病人术后短暂右侧肢体偏瘫,肌力0级,术后3个月轻度神经功能障碍,右侧肢体肌力IV级,左侧肢体肌力V级。
病例3
切除单纯靠解剖定位认为不可以切除的肿瘤。
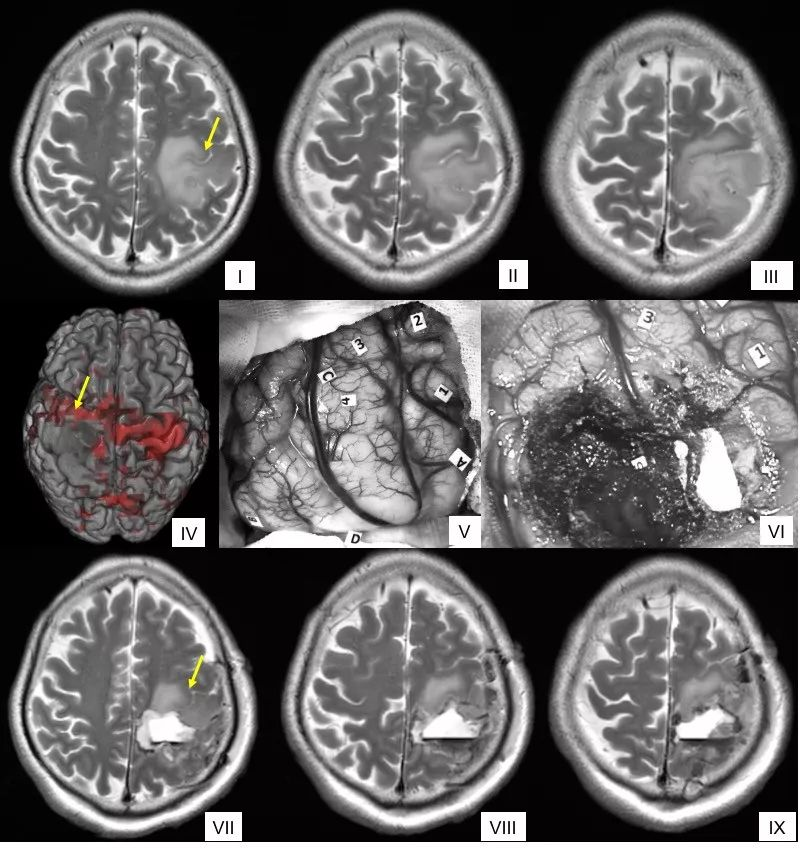
全麻术中唤醒状态下最大安全切除左侧中央前回胶质瘤,病变正好位于中央前回,切除的上界是运动区;下界为数数中断和命名不能区,后界是感觉区,深部为运动和语言皮质下纤维,术后MR显示肿瘤全切,术后3月病人无神经障碍。图I-II术前常规轴位T2磁共振,III为术前MR表面成像,见肿瘤位于中央前回,黄色箭头指示手结位置(下同);IV为功能磁共振表面图:红色为手动任务激活区;图V为术中术中皮质DES(2mA)照片:标志点2和4为手指运动;3:口角感觉;5:手指感觉;1:数数中断;8:命名不能;黄色虚线为术中超声病变位置;图VI为术中皮质下DES照片:标志点“中”为数数中断(弓状束);6:拇指运动(锥体束);图VII-IX为术后次日轴位和冠状位T2磁共振显示肿瘤全切。病人术后短暂右手偏瘫,肌力III级,运动性失语;术后3个月恢复正常,语言流利,四肢肌力V级。