提示
“浙二神外周刊”不定期接收外院投稿,审核后发表。欢迎各专业同道联系我们,分享精彩病例、研究热点或前沿资讯。投稿请联系:shishi74@163.com
前言
浙医二院神经外科神经内镜工作由上世纪九十年代科室创始人之一的陶祥洛教授及刘伟国教授首先开展,是国内较早开展神经内镜工作的单位之一。目前亚专科由吴群主任医师牵头,以及洪远主任医师和闫伟副主任医师为骨干的团队,主要从事以颅底内镜为主的神经内镜工作。团队骨干都有包括匹茨堡大学及UCLA等国外进修学习的经历,经过十余年的发展,积累了较丰富的经验,取得了丰硕成果。自257期开始系列报道科室神经内镜亚专业组的相关病例,与同道共享。
病史简介
患者,女性,51岁,因“手足增大11年,垂体瘤术后3年”入院。
患者11年前无明显诱因下出现手足增大,未重视,未就诊,3年自觉手足增大较前明显,并出现鼻增大,嘴唇增厚,前额突出等,至当地医院就诊,考虑“垂体瘤”,遂行经蝶垂体瘤切除术(具体不详)。术后复查内分泌指标未完全缓解,近期复查生长激素常规提示:GH 10.7ng/ml,IGF-1 318.6ng/ml,并于当地完善垂体MRI,提示肿瘤残留可能(具体报告未见)。余无头晕头痛、恶心呕吐、视物模糊、无疲劳乏力等不适,现患者为求进一步诊治,至浙医二院就诊。门诊拟“肢端肥大症、垂体生长激素瘤术后”收住入院。病程中,患者神清,精神可,胃纳可,大小便无殊,睡眠无殊,近来体重无明显变化。既往体健,无高血压、糖尿病、心脏病等基础疾病。
入院查体:神志清,精神可。面部稍长,鼻子肥厚,手掌肥厚,脚掌肥大,全身皮肤粘膜无黄染,浅表淋巴结未触及肿大,颈软无抵抗,双侧甲状腺未见肿大。双肺呼吸音粗,未闻及干湿性啰音。心律齐,心前各瓣膜听诊区未及病理性杂音。腹平软,无压痛及反跳痛,肝脾肋下未及,双肾区无叩痛。双下肢无浮肿,四肢肌力V级,四肢浅感觉对称,双足背动脉可及,病理征阴性。
辅助检查:浙医二院垂体增强磁共振(图1)提示:蝶鞍扩大,蝶鞍底部及蝶窦部分骨质缺损,蝶窦内见长T1长T2信号影,垂体柄显示欠佳,增强后垂体窝内未见明显异常强化信号影;鞍底、上斜坡区域可见短T1长T2为主混杂信号影,无明显强化;鞍上池及所见脑实质未见异常改变。影像诊断考虑:垂体瘤术后残留或复发,完全性空泡蝶鞍。术前主要垂体激素:GH 12.78ng/ml、IGF-1 500ng/ml、胰岛素样生长因子结合蛋白-3 8.46μg/ml。皮质醇(8AM、4PM)、ACTH(8AM、4PM)、TSH、游离T4、泌乳素等结果均正常范围内。视力视野无殊。
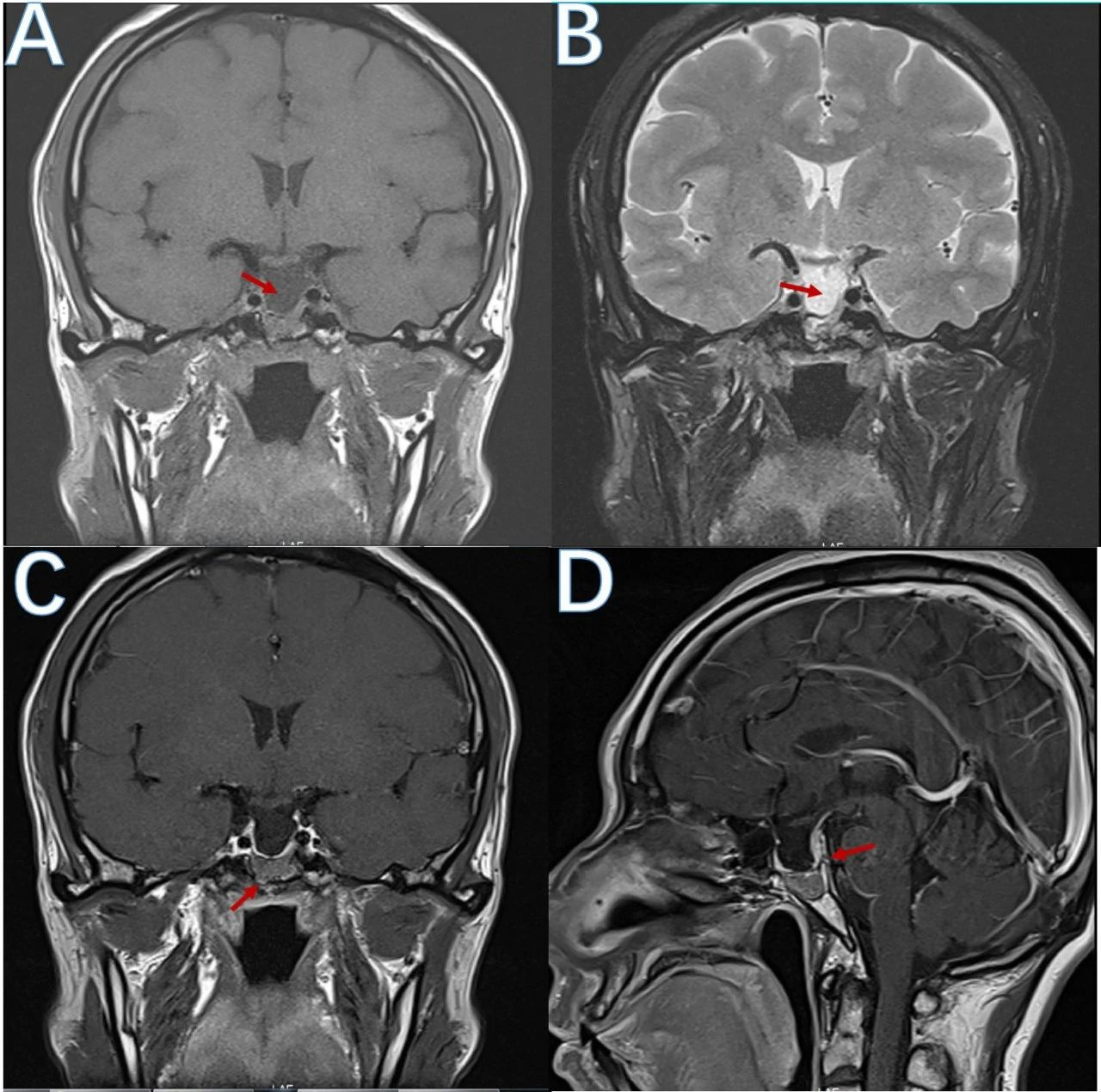
图1.术前垂体增强磁共振。T1冠状位(A)及T2冠状位(B)扫描提示鞍底明显塌陷,几近蝶窦底壁,形成完全性空泡蝶鞍;增强磁共振冠状位(C)扫描提示蝶窦底壁位置异常信号,考虑肿瘤残留,且突破鞍底硬膜(箭头处),另可见海绵窦内侧壁与下陷鞍隔间残存薄层肿瘤;增强磁共振矢状位(D)扫描可更清晰显示鞍隔下陷程度,并可见肿瘤向后突破鞍背硬膜(箭头处)。
诊治经过
患者入院后完善相关检查及各项术前准备,科室讨论认为:根据患者临床症状及影像学表现,患者复发垂体生长激素腺瘤合并空泡蝶鞍诊断明确,术前检查未见明显手术禁忌,患者及家属手术意愿强烈,手术指征存在。决定行内镜下经鼻蝶鞍区肿瘤切除术。手术关键点在于:肿瘤全切达到术后内分泌缓解,同时避免脑脊液鼻漏(术式选择及注意事项见讨论部分)。
手术经过
采取内镜下经鼻蝶入路,根据术前影像定位,充分磨低蝶窦底壁,显露肿瘤前壁。鞍底骨窗上缘与下陷鞍隔齐平,下缘充分显露向右下突破鞍底硬膜肿瘤,两侧显露至海绵窦。沿水平方向充分切开鞍底硬膜,并小心向上外侧剪开硬膜,避免损伤鞍隔。肿瘤充分显露后,内镜直视下刮除。下陷鞍隔以小棉片向上推移,术中见肿瘤质地软,血供较丰富,颜色呈暗红色,镜下逐步切除肿瘤。术中证实肿瘤向右下突破鞍底硬膜,向后方突破斜坡硬膜,予环形刮匙反复刮除后,并用双极电凝电灼受侵袭硬膜及骨质。肉眼下肿瘤全切,见鞍膈塌陷,无明确脑脊液漏。术腔速即纱、明胶海绵彻底止血。
术后第一、二天复查垂体激素(图2),提示随机生长激素已达到内分泌缓解标准(<2.5ng/ml),IGF-1快速持续下降。术后第三天复查垂体增强磁共振(图3)提示肿瘤全切。继续观察两天后患者无明显脑脊液鼻漏,体温、激素均正常,于术后第四天出院。
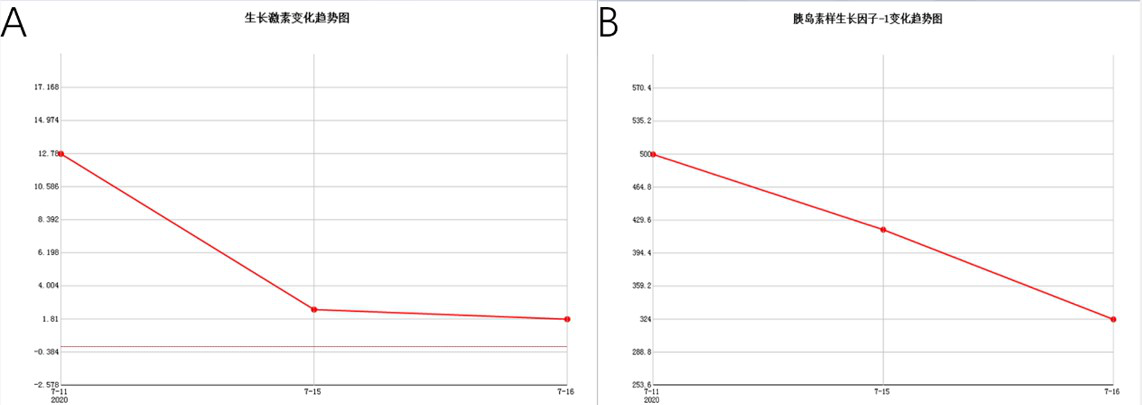
图2.术后第一、二天复查垂体激素,提示生长激素(A)已达到内分泌缓解标准,IGF-1(B)亦快速持续下降。
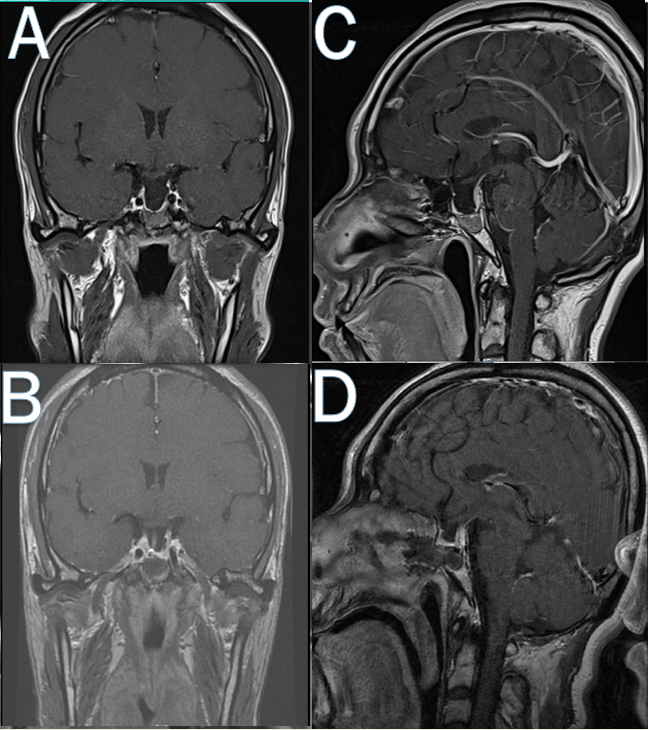
图3.术后垂体增强MRI提示肿瘤全切,鞍隔较术前略上抬。A、C为术前垂体增强MRI影像,B、D为术后第三天垂体增强MRI影像。
病理结果:术后病理回报证实为垂体腺瘤,为泌乳素生长激素细胞腺瘤(图4)。
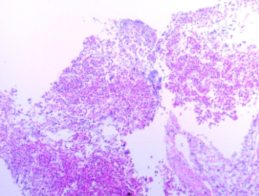
图4.术后病理:垂体腺瘤。结合免疫组化及特殊染色结果,符合泌乳素生长激素细胞腺瘤。免疫组化结果:ACTH -,Prolactin +,GH +,TSH -,LH -,FSH -,ER +,T-PIT -,PIT-1 +,SF-1 +/-,SSTR2 +,CAM5.2 核旁球状+,P53 -,Ki-67 <2%+,Syn +。特殊染色结果:PAS -,网状纤维染色网状纤维网破坏。
讨论
肢端肥大症是一种由生长激素过度分泌引起的临床综合征[1]。超过95%的肢端肥大症患者有散发性的生长激素腺瘤或生长激素泌乳素混合型腺瘤。因家族性肿瘤或异位生长激素/促生长激素分泌引起的肢端肥大症极罕见。诊断为肢端肥大症的平均年龄为40-50岁。因起病隐匿,从起病到诊断常有一定间隔。由于对该病认识的进步,如今平均间隔已≦5年[2]。其临床表现可分为内分泌和占位效应两个方面。前者主要表现为手、足增大,鼻、唇、舌增大肥厚和眉弓、下颌的突出和延长等以及涉及多系统的并发症。后者主要表现为头晕头痛、下丘脑-垂体功能紊乱、双颞侧偏盲、神经症状、脑瘤卒中等[3]。
空泡蝶鞍(empty sella,ES)是由蛛网膜下腔突出疝入蝶鞍导致的,通常伴随着一定程度的垂体变平和垂体柄伸长。ES在人群中的发生率约5%,主要是女性。ES分为两种类型:一种是继发性ES(secondary empty sella,SES)。通常因垂体腺瘤在突然的(缺/出血性)坏死后缩小或在垂体腺瘤治疗(手术等)后形成。一种是原发性ES(primary empty sella,PES)。SES相对更常见[3]。CT和MRI的广泛应用使得意外发现的PES变得更频繁。根据尸检和影像学检查获得的数据,ES的发生率在5.5%-35%之间,男女比为1:4[4]。
生长激素腺瘤合并ES并不罕见。Sasagawa的回顾性研究中,78例肢端肥大症患者有12例合并了ES,发生率为15.4%[3];而在Bier的回顾性研究中,159例生长激素腺瘤患者有35例合并了ES,发生率为22%[6]。其他类型的垂体腺瘤相比,生长激素腺瘤合并ES的情况更多见[5,6]。Liu等发现69例生长激素微腺瘤患者中,术前MRI显示14例有ES(20.2%);而在103例其他类型微腺瘤中,仅有4例有ES(3.9%)[6]。对此,一种解释是生长激素腺瘤患者合并ES的主要原因是垂体卒中。然而多项研究中,ES患者均未发现曾有肿瘤内出血的证据。另一种解释是因为生长激素腺瘤的延伸主要发生在鞍下方向。Sasagawa的研究中,78例肢端肥大症患者有近半数的生长激素腺瘤向鞍下区域延伸。Zada、Potorac等人的研究中也有类似发现[7,8]。Bier的研究还证明了生长激素腺瘤合并ES时,肿瘤在鞍区下方会有更大程度的延伸,这可能与生长激素腺瘤的生长模式和伴随的骨重塑过程有关。
手术是治疗生长激素腺瘤合并ES的主要方法。但本例患者治疗过程中存在以下难点:1.生长激素腺瘤切除目标不仅仅是影像学全切,更需达到内分泌缓解,而中国罕见病联盟的肢大患者调研报告提示,国内肢大患者手术后内分泌缓解率仅30%左右;本例患者术前影像学提示肿瘤对鞍底、鞍背硬膜有侵犯,因此手术达到内分泌缓解的难度进一步增加;2.本例为复发病例,存在解剖结构改变、肿瘤与周围结构黏连等问题,且残余肿瘤位置极低,增加了手术的难度;3.患者合并完全性空泡蝶鞍,且下陷鞍隔与海绵窦、鞍背间亦存在少量肿瘤残留,因此术中发生脑脊液漏进而造成颅内感染的风险很大。手术目标是实现肿瘤全切的同时,确保不发生脑脊液漏。为实现这一目标,我们重点考虑以下几方面问题:术式选择,手术预后,术中/术后脑脊液漏的预防。
术式选择
在神经内镜充分发展以前,生长激素腺瘤的手术以显微镜下经蝶窦切除为主。而随着内镜技术的发展和成熟,纯内镜下经鼻蝶手术开始逐渐取代前者。该术式具有以下优势:提供了更宽阔、更全景的视野;可以更好的观察和控制肿瘤和术野的侧面,包括鞍上部分和海绵窦侧方;对大腺瘤,术后生化缓解率更高[9]。总的来说,在术者熟悉内镜解剖和熟练的内镜操作技巧的前提下,当前的研究表明:内镜操作相比显微镜下操作,在大腺瘤的治疗上更有优势;脑脊液漏、垂体功能减退以及暂时性尿崩症等并发症的控制上也略优[9]。本例患者因肿瘤位置极低,由于蝶窦骨质阻挡,显微镜下无法直视肿瘤;且向硬膜侵犯以及鞍隔周围间隙的肿瘤,都无法在显微镜下直视;而利用带角度的神经内镜可以很好的解决这一问题:因此,我们选择内镜下手术。
手术预后
对于未合并ES的生长激素腺瘤,国外大样本研究提示术后内分泌缓解率约为40%--60%,大型神经外科中心可达70%--80%;国内相关全国范围调查数据缺失,仅有中国罕见病联盟的报告提示约为30%,而国内知名神经外科中心报道切除率与国外相当。值得强调的是,由于该疾病相对罕见,部分单位治疗经验有限,因此术后残留的患者仍可能有二次手术的机会。
芝加哥大学医学中心报道,经仔细筛选的患者,二次手术后达到生化缓解的患者可高达50%[10]。而对于合并ES的生长激素腺瘤的手术预后,相关的文献较少。为了评价手术的预后,在影像学中ES被分为两类。完全ES:垂体腺高度≦2mm;部分ES:垂体腺高度>2mm,但少于蝶鞍深度的3/4(图5、6)。然而,Xing B等人研究发现,传统的ES分类在评价手术预后时并无显著的统计学意义。因此,他们提出了影像学上生长激素腺瘤合并ES的新分类:A:全肿瘤低于水平线;B:肿瘤一边超过鞍隔最低位水平线;C:肿瘤两边都超过水平线(图7)[4]。
在Xing B等人的研究中,生长激素腺瘤合并ES的整体治愈率64.71%(33/51),接近Hazer报告的62.6%(214例);其中新分类A组治愈率88.24%(15/17),与未合并ES的垂体微腺瘤相当;新分级C类治愈率50.00%(7/14),与未合并ES的垂体大腺瘤相当[4]。在并发症方面,生长激素腺瘤合并ES的患者并发症的发生率更高,尤其是术中/术后脑脊液漏的发生率更高。Sasagawa报导的术中脑脊液漏达58.3%(7/12),显著高于未合并ES者的25.8%(17/66)[3]。新分类中C组的脑脊液漏风险明显更高,Xing bing等报导的C组脑脊液漏率为35.71%,同时A、B组分别只有5.88%和10.00%,而传统ES分类未见统计学意义。
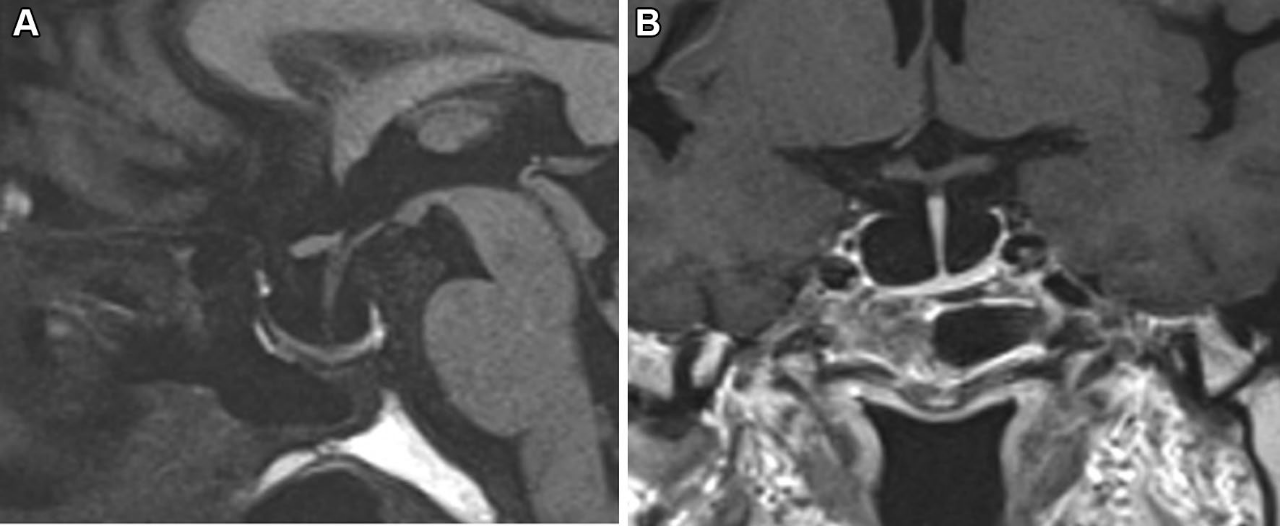
图5.完全ES:垂体腺高度≦2mm。A:垂体磁共振T1矢状位,示生长激素腺瘤合并完全ES;B:垂体增强磁共振T1冠状位,示扁平的正常垂体。
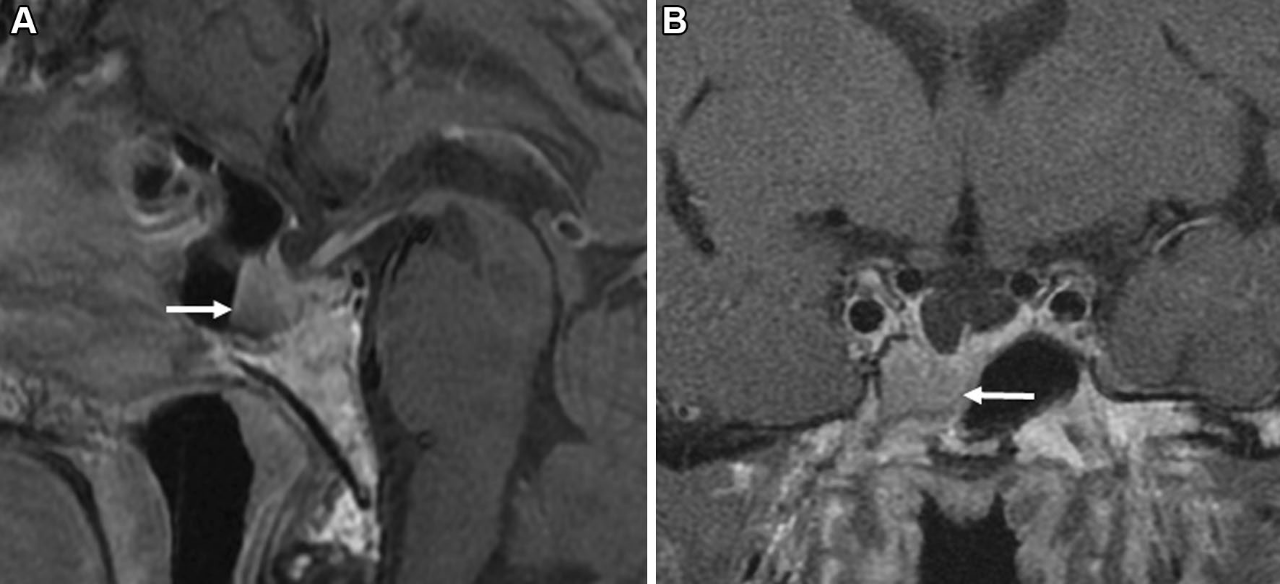
图6.部分ES:垂体腺高度>2mm,但少于蝶鞍深度的3/4。A:垂体增强磁共振T1矢状位,示部分ES;B:垂体增强磁共振T1冠状位,示鞍内延伸肿瘤合并部分ES。
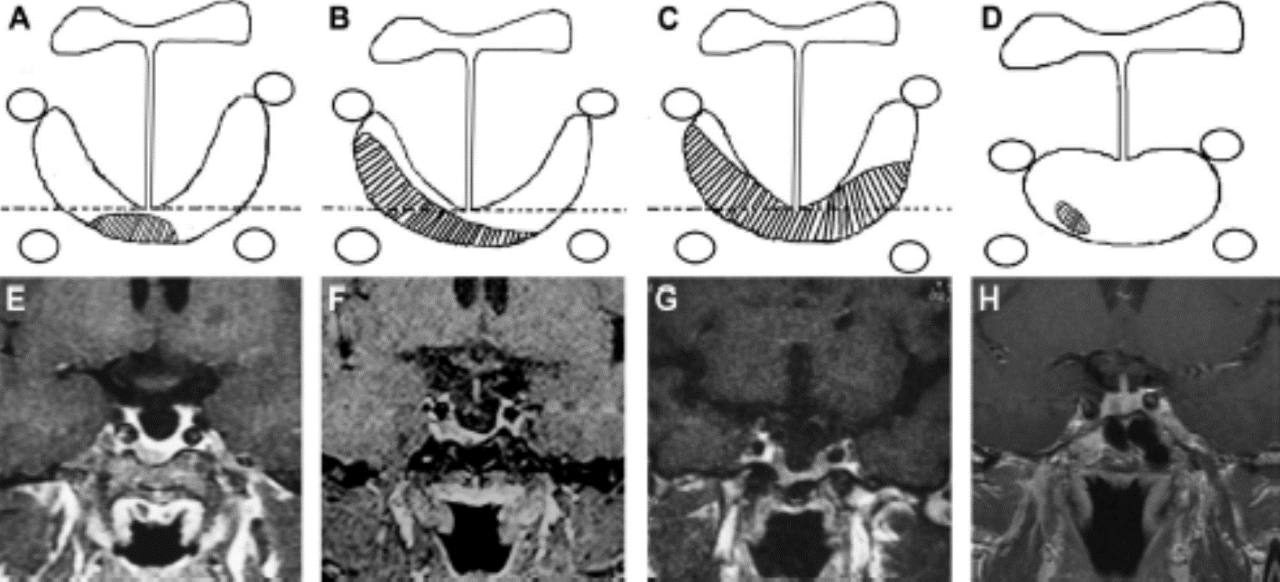
图7.生长激素腺瘤合并ES的新分类如A—D的示意图和E—F的垂体增强磁共振T1冠状位所示。水平线是沿空泡蝶鞍最低点所划。A、E:全部肿瘤低于水平线;B、F:肿瘤一边超出水平线;C、F:肿瘤两边均超过水平线;D、H:未合并ES的生长激素腺瘤。
脑脊液漏的预防
根据上述新分类,本病例属于C组,可预见术中/术后并发症的发生率较高,尤其要注意预防脑脊液漏的发生。为预防脑脊液漏的发生,术中需注意以下要点:1)准确识别解剖结构。因肢端肥大症患者病程较长,鞍区解剖变异率高,在复发病例,且合并ES的情况下更甚,神经导航、术中超声及内镜的辅助有较大帮助。2)硬膜切开部位。Liu W等研究发现,合并ES的生长激素瘤常在蝶鞍后部,靠近斜坡。因此,为避免脑脊液漏,应切开靠近斜坡的蝶鞍硬膜,确保蝶鞍的硬膜切口在鞍膈下方;有必要时需磨开斜坡以暴露蝶鞍硬膜。3)硬膜切开方式。术中应沿肿瘤长轴切开硬膜,在肿瘤完全切除前防止蛛网膜下降,通过内镜角度调整有助于最大限度在蛛网膜和蝶鞍之间的操作。4)其他。术中脑脊液引流的使用也可能减少脑脊液漏的发生;术中一旦鞍膈下降,应使用湿棉片小心保护;术中麻醉深度和呼吸应严格控制,防止颅内压升高。
综上所述,复发生长激素腺瘤合并空泡蝶鞍患者手术全切难度大,并发症发生率较高;如何提高术后生化缓解率以及减少术中/术后脑脊液漏的发生是其关键问题。随着内镜技术的不断成熟,通过术前垂体MRI、术中神经导航以及超声的辅助,制定个性化的手术方案,在内镜技术熟练的神经外科医生操作下,能够显著提高手术效果并减少脑脊液漏的发生。
参考文献
[1]Melmed S. Acromegaly[J].New England Journal of Medicine,2006,355(24):2558-2573.
[2]Colao A, Grasso L F S, Giustina A, et al. Acromegaly[J].Nature Reviews Disease Primers,2019,5(1):1-17.
[3]Sasagawa Y, Hayashi Y, Tachibana O, et al. Clinical characteristics of acromegalic patients with empty sella and their outcomes following transsphenoidal surgery[J].Pituitary,2017,20(4):403-408.
[4]Wang Q, Guo X, Gao L, et al. Surgical outcome of growth hormone–secreting pituitary adenoma with empty sella using a new classification[J].World Neurosurgery,2017,105:651-658.
[5]Liu W, Zhou H, Neidert M C, et al. Growth hormone secreting pituitary microadenomas and empty sella–An under-recognized association?[J].Clinical neurology and neurosurgery,2014,126:18-23.
[6]Bier G, Hempel J M, Grimm F, et al. Quantification of specific growth patterns and frequency of the empty sella phenomenon in growth hormone-secreting pituitary adenomas[J].European journal of radiology,2018,104:79-86.
[7]Zada G, Lin N, Laws E R. Patterns of extrasellar extension in growth hormone–secreting and nonfunctional pituitary macroadenomas[J].Neurosurgical focus,2010,29(4):E4.
[8]Potorac I, Petrossians P, Daly A F, et al. Pituitary MRI characteristics in 297 acromegaly patients based on T2-weighted sequences[J].Endocr Relat Cancer,2015,22(2):169-177.
[9]Chen C J, Ironside N, Pomeraniec I J, et al. Microsurgical versus endoscopic transsphenoidal resection for acromegaly: a systematic review of outcomes and complications[J].Acta neurochirurgica,2017,159(11):2193-2207.
[10]Molitch M E. Diagnosis and treatment of pituitary adenomas: a review[J].Jama,2017,317(5):516-524.
(本文由浙二神外周刊原创,浙江大学医学院附属第二医院神经外科陈杨研究生整理,闫伟副主任医师审校,张建民主任终审。)




