提示
“浙二神外周刊”不定期接收外院投稿,审核后发表。欢迎各专业同道联系我们,分享精彩病例、研究热点或前沿资讯。投稿请联系:shishi74@163.com
前言
浙医二院神经外科神经内镜工作由上世纪九十年代科室创始人之一的陶祥洛教授及刘伟国教授首先开展,是国内较早开展神经内镜工作的单位之一。目前亚专科由吴群主任医师牵头,以及洪远主任医师和闫伟副主任医师为骨干的团队,主要从事以颅底内镜为主的神经内镜工作。团队骨干都有包括匹茨堡大学及UCLA等国外进修学习的经历,经过十余年的发展,积累了较丰富的经验,取得了丰硕成果。自257期开始系列报道科室神经内镜亚专业组的相关病例,与同道共享。
病史简介
患者,女,25岁,因“月经不调伴左眼视力下降6年余”于2019年8月13日入院。
患者6年余前无明显诱因下出现月经不调,伴左眼视力下降,肢端肥大,在外院诊断“垂体巨腺瘤,肢端肥大症”,行垂体肿瘤切除术,术后症状较前改善,复查提示肿瘤残留,予短暂生长抑素药物治疗(经济原因放弃),并行15次放疗,定期随访。2019年7月前患者磁共振报告提示:肿瘤残留或复发,对照前片增大。为求进一步诊治来浙医二院,门诊拟“垂体瘤复发”收住入院。
入院查体:生命体征平稳,神清,精神可,面部皮肤粗糙,唇肥厚,下颌增大前突,手脚粗大肥厚,声音低沉,双侧瞳孔等大等圆,直径约3mm,对光反射灵敏,动眼自主,左侧视物模糊,右侧视力正常,颈软,心肺听诊无殊,腹平软,肝脾肋下未及,四肢感觉对称,活动自主,肌力5级,肌张力可,双侧病理征阴性。
入院后完善相关检查检验。垂体MRI增强(图1)提示:垂体瘤术后复发。
生长激素:10.57ng/mL,IGF-1:678ng/mL,IGF结合蛋白-3:8.67mg/mL。血皮质醇(8am):215.4nmol/L。性激素正常。甲状腺激素常规:游离T3、T4正常。
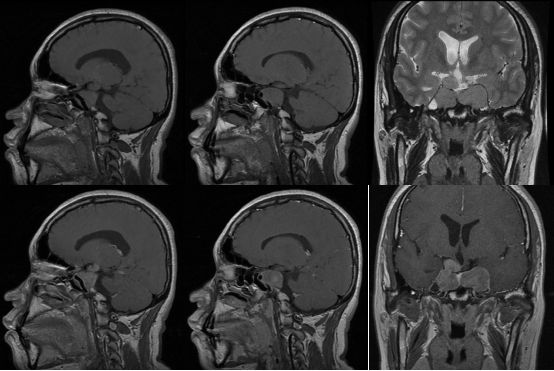
图1. 垂体MRI增强:蝶鞍扩张,内见团块状等T1等T2信号块影,形态不规则,约26×36×51mm,增强扫描轻度不均匀强化,垂体位于肿块左下方,垂体柄居中。肿块累及两侧海绵窦,包绕两侧颈内动脉。肿块右侧可见不规则结节向上突出压迫三脑室底部。
诊治经过
完善各项术前准备,科室术前讨论:根据患者病史、体检、辅助检查,诊断考虑垂体瘤术后复发。鉴于是二次手术,又经过生长抑素和多次放疗,肿瘤侵袭双侧海绵窦,包绕颈内动脉,无论是开颅还是经蝶,难以一期全切,遂制定分期手术方案。和患者及家属充分沟通后,决定行神经内镜下经鼻蝶垂体肿瘤切除+颅底重建术(手术录像见链接1)。术中见肿瘤呈黄白色,质地韧,血供一般,与周围组织粘连明显,局部机化,难以辨认正常解剖结构,内镜下大部切除肿瘤。
(神经内镜下经鼻蝶垂体肿瘤切除+颅底重建术第一次手术)
术后复查垂体MRI增强(见图2)提示:复发垂体瘤切除术后改变,肿瘤残留。复查生长激素:16.07ng/mL,IGF-1:800ng/mL,IGF结合蛋白-3:7.79mg/mL。血皮质醇(08am):291nmol/L。性激素常规:正常。甲状腺激素常规:游离T3、T4正常。生长激素葡萄糖抑制试验:口服葡萄糖溶液后生长激素>1ng/mL,未被抑制。
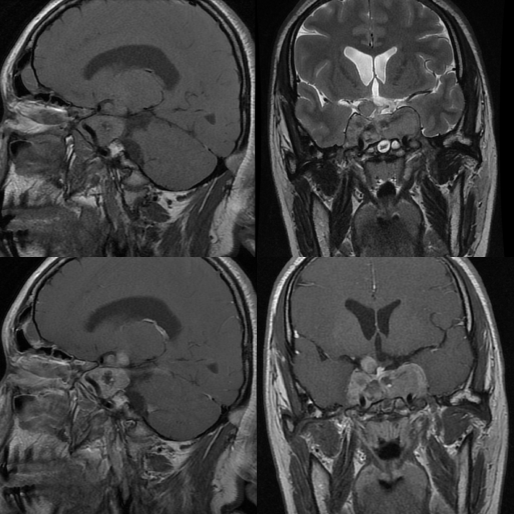
图2. 垂体MRI增强:蝶鞍扩大、部分骨质缺损,术区及蝶窦内肿瘤组织混杂信号影,前下部小片短T1信号,向鞍上池及两侧海绵窦延伸,推移下丘脑及视交叉,包绕两侧颈内动脉,增强后见不均匀强化;垂体柄向右侧移位。
予抗感染、护胃、止吐、补液等对症支持治疗,患者病情稳定后于术后第四天出院。定期随访。为清除残余肿瘤于3月后(2019年11月17日)再次入院。
再入院检查:术前生长激素:13.08ng/mL,IGF-1:763ng/mL,IGF结合蛋白-3:8.5mg/mL。血皮质醇(8am):332.5nmol/L。性激素常规:正常。甲状腺激素常规:游离T3、T4正常。
排除禁忌后第二次神经内镜下经鼻蝶垂体肿瘤切除+颅底重建术(手术录像见链接2)。结合患者病情以及第一次手术的情况,为了避免过多瘤内分离疤痕与黏连,第二次手术予经鞍结节扩大入路,打开蛛网膜下腔,沿肿瘤外包膜分离并切除肿瘤,术中见肿瘤质地韧,呈黄白色,血供一般,镜下切除位于鞍内鞍上肿瘤,经左侧海绵窦内侧壁切除左侧颈内动脉肿瘤,右侧颈内动脉旁肿瘤纤维疤痕机化严重,难以切除。鞍底多层重建,敷以带蒂鼻中隔粘膜瓣。术后予行腰大池置管引流。
(神经内镜下经鼻蝶垂体肿瘤切除+颅底重建术第二次手术)
术后第二天生长激素:2.35ng/mL,IGF-1:837ng/mL,IGF结合蛋白-3:12.3mg/mL。血皮质醇(8am):251nmol/L。性激素常规正常。甲状腺激素常规:游离T3、T4正常。生长激素葡萄糖抑制试验:口服葡萄糖溶液后生长激素>1ng/mL,未被抑制。
患者术后恢复良好,左眼视力较前进一步改善,未见明显脑脊液漏,于术后第七天拔除腰大池引流管,第八天出院。患者尿崩症状予口服去氨加压素片控制。
术后半年复查垂体MRI增强提示:垂体瘤术后改变,两侧鞍旁及海绵窦肿瘤残留,右侧明显(图3)。生长激素:4.12ng/mL。患者右侧鞍旁及海绵窦异常组织影主要考虑纤维化组织,但仍可能为肿瘤残留,生长激素虽正常,但仍未达到内分泌缓解水平,因此告知患者出院后门诊定期复诊,因经济原因未继续生长抑素治疗。经垂体瘤诊治多学科团队讨论,建议口服卡麦角林治疗。
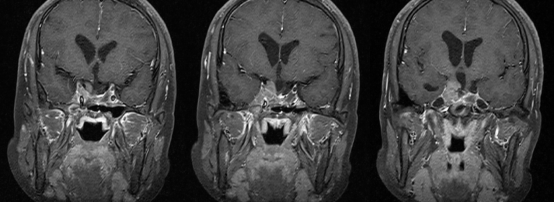
图3. 垂体MRI增强:蝶鞍扩大,骨质缺损,两侧鞍旁见异常软组织影,增强扫描见中等强化,两侧海绵窦受侵,颈动脉被包绕。
浙医二院病理报告示:垂体腺瘤,结合免疫组化结果,符合泌乳素生长激素细胞腺瘤。免疫组化结果: ACTH-,Prolactin+,GH+,FSH-,LH-,TSH-,ER-, PIT-1+,SF-1-,T-PIT-,SSTR2+,CAM5.2核旁点状+,P53-,Ki-67 2-5%+,Syn+。
特殊染色结果:PAS-,网状纤维染色网状纤维网破坏(图4)。
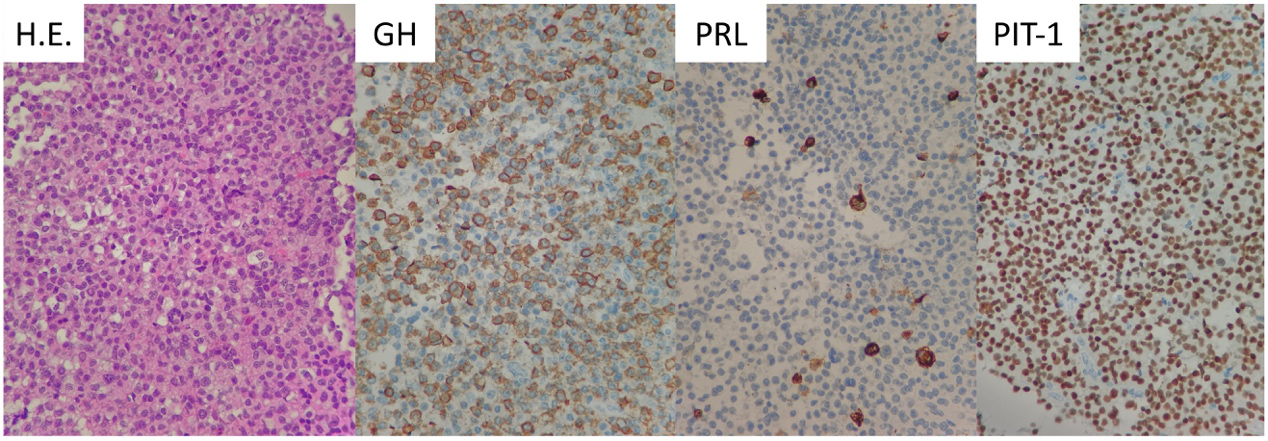
图4. 病理组织切片结合免疫组化及特殊染色结果,提示泌乳素生长激素细胞腺瘤。
讨论
垂体腺瘤的病理学分类近几年有较大的变化,在最新的《世界卫生组织内分泌器官肿瘤分类》(2017年第4版)中,利用垂体激素和垂体特异性转录因子进行基于细胞谱系的免疫组织化学分类方法被提出。根据三种重要的垂体转录因子Pit-1、SF-1、T-Pit的表达,新的分类方法将垂体腺瘤分为六个大类:促生长激素细胞、泌乳素细胞、促甲状腺激素细胞、促肾上腺皮质激素细胞、促性腺激素细胞和多激素肿瘤(表1)(感谢微信公众号“伽玛刀张南大夫”译)[1]。为了强调转录因子在细胞分化和调控特定垂体前激素中的作用,新的分类方法将“分泌激素(hormone-producing)”改为了“细胞的(-troph)”。例如,分泌生长激素的腺瘤(growth hormone-producing adenomas)现在被称为生长激素细胞腺瘤(somatotroph adenomas)[2-4]。

泌乳素生长激素细胞腺瘤是以同一细胞同时表达生长激素(GH)和泌乳素(PRL)为特征的一种生长激素细胞腺瘤亚型。这一类型的垂体腺瘤同时还表达垂体转录因子(Pituitary transcription factor,PIT1)和雌激素受体α(ERα)[5]。在最近的流行病学研究中,泌乳素生长激素细胞占垂体腺瘤的2.2%[6]。本病例免疫组化结果为GH和PRL阳性,同时表达PIT-1,符合该病理亚型的诊断,但其临床特点为生长激素水平升高的肢端肥大症表现,泌乳素水平正常,则是本病例的特点之一。
本病例的另一个特点是其符合难治性垂体腺瘤的定义:侵袭性生长,生长较一般垂体瘤更快,对常规手术、药物、放疗存在抵抗性,术后早期复发或再生长率高[4, 7]。该定义基于肿瘤生物学行为及临床疗效等方面被提出,尚缺乏一个统一的诊断标准,国内2019年关于难治性垂体腺瘤诊治的专家共识建议诊断难治性垂体腺瘤应包含以下4个特点:①肿瘤影像学上呈侵袭性生长,生长快速,Ki-67≥3%;②术后肿瘤短期(6个月)内复发;③手术、药物、放射等常规治疗后肿瘤继续生长;④全身检查未见转移灶[8]。
关于难治性垂体腺瘤的治疗,首先应借助多学科团队协作(MDT),对疑似患者进行影像学、内分泌方面的全面评估,做出诊断,设计个体化的治疗方案,并进行治疗后的终身随访;第二,应根据患者全身状态、风险、获益、术后并发症的可能性来决定是否行手术治疗,多项研究提示,外科医生的经验越丰富,手术并发症和死亡率越低。而经蝶内镜手术能更广泛地暴露术野,利于侵袭海绵窦及其他部位的肿瘤的切除,但同时也存在重要动脉、颅神经损伤和术后脑脊液漏的风险。导航技术、术中多普勒超声定位、神经电生理监测、颅底重建脑脊液漏修补等技术的运用能提高肿瘤切除率,降低并发症风险;第三,放射治疗能有效控制肿瘤生长,因此,对于术后有肿瘤残留的患者,MDT团队应评估其全身状态及放疗耐受性,予行放射治疗。第四,在规范使用溴隐亭、卡麦角林、生长抑素等常规药物后疗效仍不显著的情况下,应考虑予尽早行替莫唑胺治疗。综上所述,对于难治性垂体瘤的治疗,提倡多学科协作、手术结合放疗、药物、制定个体化的方案及随访[8]。
复发垂体瘤因病变区域解剖结构破坏、瘢痕形成、局部组织黏连等,导致肿瘤界限难以分辨,手术难度大大提高,因此应多学科MDT团队联合会诊,综合评估患者的全身状态、手术指征、可行性、风险及疗效,最终制定个体化的手术方案。因手术难度大,最好是由经验丰富的垂体外科医生进行手术。术前应详细了解既往手术过程中的情况,如肿瘤质地、血供、与周围组织的界限、粘连、与重要血管、神经的关系等,结合影像学表现及术者经验,决定手术入路。
随着神经内镜技术的发展及手术技术的进步,内镜下经蝶窦入路在肿瘤的暴露和切除率方面优势明显,因此常作为复发性垂体腺瘤的首选入路。而经颅入路则适用于切除广泛侵袭前颅底、鞍旁、三脑室等的巨大垂体腺瘤。必要时可采取联合入路或分期手术的方式切除肿瘤。术中可借助神经导航、多普勒超声等技术,辅助判断解剖结构及重要的神经血管,降低手术的风险。对于复发性垂体腺瘤,应重视术后随访,建立终身随访的机制,制定个体化的治疗随访方案,这对于提高患者的生存质量意义重大[9]。
本例病例中患者系垂体瘤术后复发,又行15次放疗及生长抑素药物治疗,因此手术难度极大,最终制定了分期手术的治疗方案。第一次手术探查发现鞍底严重黏连,分离难度大,打开肿瘤腔后发现肿瘤内存在分隔,纤维机化、黏连严重,正常结构难以辨认,遂决定予行肿瘤部分切除。术后患者恢复良好,未见明显脑脊液漏等并发症,遂于3月后行第二次手术。术前我们详细研究患者病史、体检、影像学检查、内分泌检查、第一次手术的术中所见等情况,为了避开患者肿瘤内的黏连和分隔,第二次手术方案选择经鞍结节扩大入路,打开蛛网膜下腔从肿瘤包膜外去分离切除肿瘤,避免在瘤内盲目分离损伤重要神经血管,最终实现肿瘤次全切除,术后复查MRI提示右侧可疑一部分肿瘤残留,结合术中情况,我们考虑这一部分组织主要还是黏连的纤维组织,当然仍有可能为残余肿瘤。
本病例是一例难治性的复杂的生长激素腺瘤,难治性的生长激素腺瘤一直是肢端肥大症患者的一个重要难点和挑战。手术治疗通常是主要治疗方法,但手术的效果常常较差,存在切除率低、生化缓解率低、手术相关并发症高等情况。而以生长抑素类似物和生长激素受体拮抗剂为代表的辅助性和术前药物治疗逐渐成为难治性生长激素腺瘤的重要治疗手段。立体定向放射外科治疗被越来越多地报道可以作为手术和药物治疗效果不佳情况下的一个重要二线治疗手段,但其必须围绕手术和药物治疗方案而被应用。另一方面,多学科MDT团队的协同诊治在整个诊疗过程中的作用至关重要,这样的团队除了手术技术熟练的神经外科医生和药物治疗全面精通的神经内分泌学专家外,还应该包括神经放射学专家,神经分子病理学家,放射肿瘤学专家,以及拥有在垂体病变治疗和患者宣教方面有经验的高年资护士[10, 11]。
参考文献
1.Manojlovic-Gacic, E., J. Bollerslev, and O. Casar-Borota, Invited Review: Pathology of pituitary neuroendocrine tumours: present status, modern diagnostic approach, controversies and future perspectives from a neuropathological and clinical standpoint. Neuropathol Appl Neurobiol, 2020. 46(2): p. 89-110.
2.Mete, O. and M.B. Lopes, Overview of the 2017 WHO Classification of Pituitary Tumors. Endocr Pathol, 2017. 28(3): p. 228-243.
3.Sathyakumar, R. and G. Chacko, Newer Concepts in the Classification of Pituitary Adenomas. Neurol India, 2020. 68(Supplement): p. S7-s12.
4.Lloyd RV, O.R., Kloppel G, Rosai J, editors., WHO Classification of Tumors of Endocrine. 4th ed.
5.Trouillas, J., et al., How to Classify the Pituitary Neuroendocrine Tumors (PitNET)s in 2020. Cancers (Basel), 2020. 12(2).
6.Mete, O., et al., Epidemiology and biomarker profile of pituitary adenohypophysial tumors. Mod Pathol, 2018. 31(6): p. 900-909.
7.Dai, C., et al., Refractory pituitary adenoma: a novel classification for pituitary tumors. Oncotarget, 2016. 7(50): p. 83657-83668.
8.中国垂体腺瘤协作组 and 中华医学会神经外科学分会, 中国难治性垂体腺瘤诊治专家共识(2019). National Medical Journal of China, 2019. 99(19): p. 1454-1459.
9.中国垂体腺瘤协作组 and 中华医学会神经外科学分会, 中国复发性垂体腺瘤诊治专家共识(2019). National Medical Journal of China, 2019. 99(19): p. 1449-1453.
10.Melmed, S., et al., A Consensus Statement on acromegaly therapeutic outcomes. Nat Rev Endocrinol, 2018. 14(9): p. 552-561.
11.Donoho, D.A., et al., Management of aggressive growth hormone secreting pituitary adenomas. Pituitary, 2017. 20(1): p. 169-178.
(本文由浙二神外周刊原创,浙江大学医学院附属第二医院神经外科邵方杰医师整理,吴群主任医师审校,张建民主任终审)
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。




