提示
“浙二神外周刊”不定期接收外院投稿,审核后发表。欢迎各专业同道联系我们,分享精彩病例、研究热点或前沿资讯。投稿请联系:shishi74@163.com
前言
浙医二院神经外科神经内镜工作由上世纪九十年代科室创始人之一的陶祥洛教授及刘伟国教授首先开展,是国内较早开展神经内镜工作的单位之一。目前亚专科由吴群主任医师牵头,以及洪远主任医师和闫伟副主任医师为骨干的团队,主要从事以颅底内镜为主的神经内镜工作。团队骨干都有包括匹茨堡大学及UCLA等国外进修学习的经历,经过十余年的发展,积累了较丰富的经验,取得了丰硕成果。自257期开始系列报道科室神经内镜亚专业组的相关病例,与同道共享。
病史简介
患者,男性,32岁,因“头痛伴视物模糊两月,发现鞍区占位一月”入院。
患者两个月前无明显诱因下出现头痛、视物模糊等症状,无头晕、无恶心呕吐、无疲劳乏力等不适,当时未就诊。后感头痛、视物模糊等症状逐渐加重,于一个月前至外院行头颅MRI检查提示鞍区占位、脑积水。现患者为求进一步诊治,来浙医二院就诊,门诊拟以“鞍区占位、脑积水”收住入院。病程中,患者神清,精神可,无手足增粗、无记忆力减退、无大小便失禁,性功能无明显减退,近来体重无明显变化。既往体健,无高血压、糖尿病、心脏病等基础疾病。
入院查体:神志清,精神可。双侧瞳孔等大等圆,直径约3.0mm,对光反射灵敏,双眼颞侧视野缺损。全身浅表淋巴结未及肿大。面貌无殊。双肺呼吸音清,未闻及干湿性啰音。心律齐,心前各瓣膜听诊区未及病理性杂音。腹部可见陈旧性手术疤痕,腹平软,无压痛及反跳痛,肝脾肋下未及,双肾区无叩痛。双下肢无浮肿,四肢肌力V级,四肢浅感觉对称,双足背动脉可及,病理征阴性。
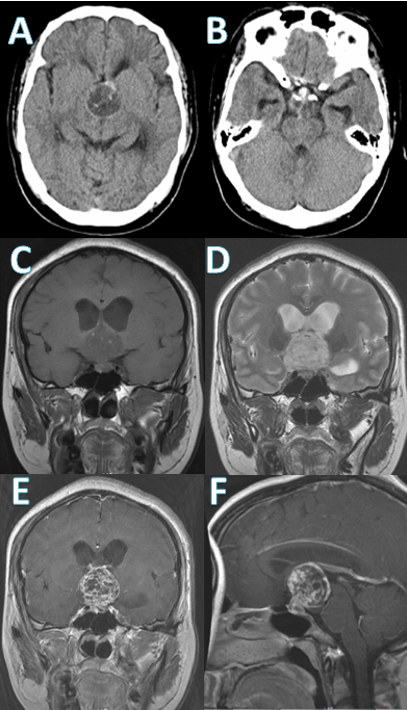
辅助检查:浙医二院头颅CT(图1 A、B)提示:鞍区占位伴鞍内、鞍上环形钙化,提示颅咽管瘤。浙医二院垂体增强MRI(图1 C-F)提示:鞍区占位,考虑颅咽管瘤,伴幕上脑积水。术前主要垂体激素:皮质醇(8AM、4PM)、ACTH(8AM、4PM)、TSH、游离T4、泌乳素等结果均正常范围内。
诊治经过
患者入院后完善相关检查及各项术前准备,科室讨论认为:根据患者临床症状及影像学表现,患者颅咽管瘤伴脑积水诊断明确,手术指征存在,术前检查未见明显手术禁忌,患者及家属手术意愿强烈。经充分讨论手术入路及注意事项后(相关内容见讨论部分),决定行内镜下经鼻蝶颅咽管瘤切除术。
手术经过:全麻成功后,先行腰大池置管引流;再行内镜下经鼻蝶扩大入路颅咽管瘤切除。手术采取双鼻孔入路,与助手两人三手模式配合。术中见肿瘤主体位于鞍上,部分累及鞍内,正常垂体被推至后下。仔细探查,未见明确垂体柄,考虑肿瘤为垂体柄中央型。鞍内肿瘤切除后,通过垂体与视交叉间的间隙切除鞍上肿瘤主体。肿瘤为实性,血供较丰富,部分钙化,质地坚韧,无法用吸引器吸除。使用剪刀、刮匙配合,耐心、充分瘤内减压,再分离肿瘤包膜。锐性分离肿瘤包膜与视神经及三脑室下侧壁黏连,见三脑室底被肿瘤完全破坏。肿瘤全切,瘤腔止血后,采取多层重建方式修补颅底。
术后第一天患者诉视力较前好转,复查垂体激素提示垂体前叶功能低下,伴尿崩,予药物对症处理。术后第五天拔除鼻腔膨胀海绵,第七天拔除腰大池引流管。继续观察三天后患者无明显脑脊液鼻漏,体温、激素均正常,于术后第十天出院。术后第二天复查垂体增强磁共振(图2)提示肿瘤全切,脑积水缓解。
病理结果:术后病理回报证实为颅咽管瘤,造釉细胞型,WHO I级(图3)。
术后三个月复查双眼视野缺损基本恢复(图4,术前当地视野检查结果遗失)。
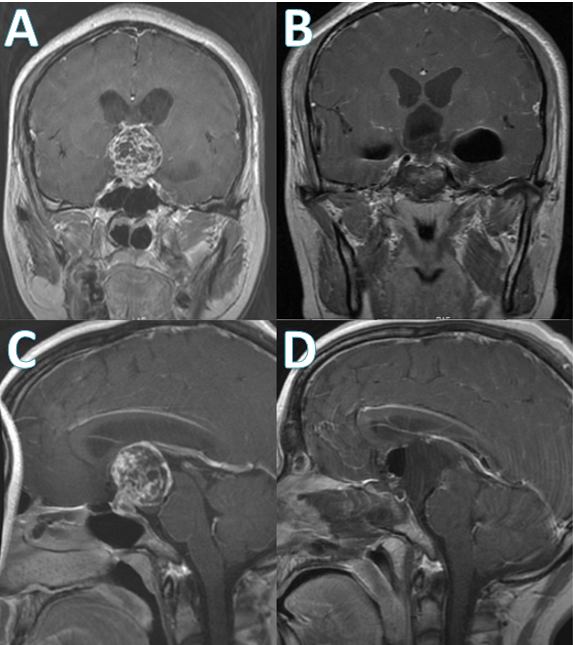
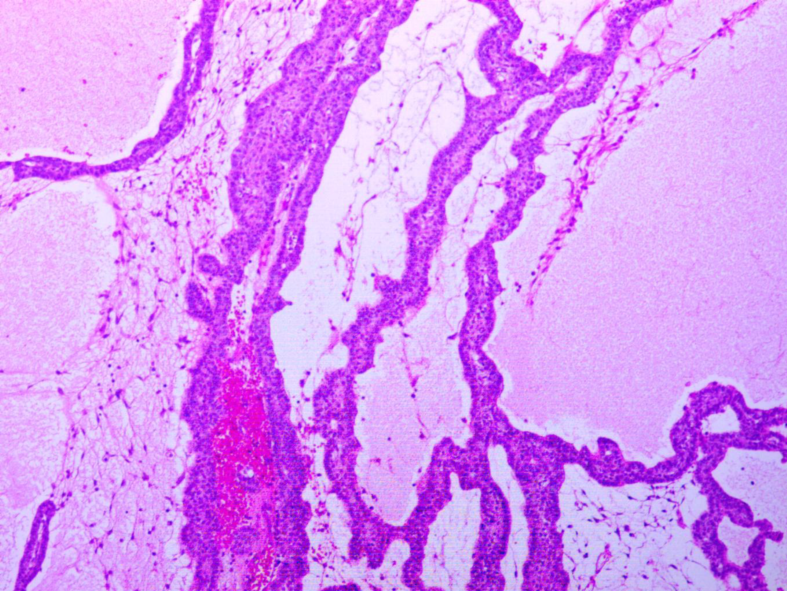
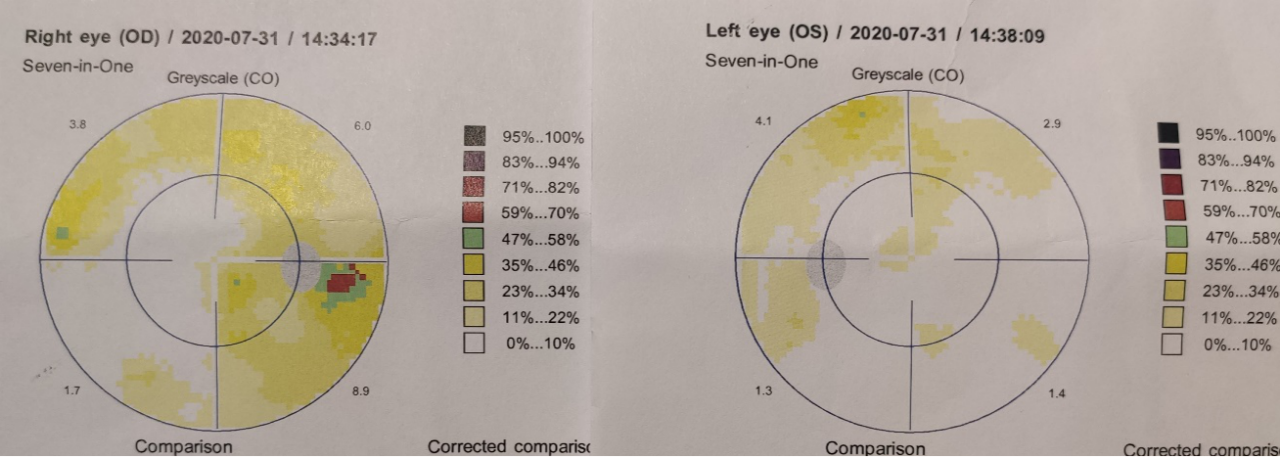
图4. 术后三个月双眼视野检查,视野基本恢复。
讨论
颅咽管瘤是由外胚叶形成的颅咽管残余的上皮细胞发展起来的一种常见的胚胎残余组织肿瘤,发病年龄呈双峰分布,儿童发病高峰为5-14岁,成人发病高峰为50-74岁。其临床表现主要有下丘脑-垂体功能紊乱、颅内压增高、视力及视野障碍等[1]。
手术是颅咽管瘤治疗的主要方法。但由于肿瘤位置深在,毗邻重要血管神经结构,手术难度大,并发症发生率高。传统手术方式为显微镜下开颅手术,近年来随着神经内镜技术的进步,内镜下经鼻蝶颅咽管瘤切除日益受到重视。本例患者肿瘤体积大,主体位于鞍上,且质地坚韧,经采取内镜下经鼻蝶扩大入路,取得良好预后。浙大二院神经内镜组自2013年开展内镜下扩大入路依赖,累计完成此类手术逾百例,积累了丰富经验。现结合本病例,探讨颅咽管瘤手术中的几个焦点问题:手术入路的选择,术中关键结构(垂体柄、下丘脑及视觉通路)的保护,经鼻蝶手术后的颅底重建。
手术入路的选择。颅咽管瘤手术的目标是,在充分保护垂体、下丘脑及视觉功能的前提下,积极追求肿瘤全切。在神经内镜充分发展以前,颅咽管瘤的手术以显微镜下开颅切除为主,并根据肿瘤的位置、形态、质地等因素,发展出众多入路,因已有文献对此充分讨论,本文不再赘述。而1997年Jho等[2]首先报道了神经内镜下扩大经鼻蝶窦入路切除鞍上颅咽管瘤后,内镜下经鼻手术成为治疗颅咽管瘤的重要方式。该术式具有以下优势:手术通道不经过大脑、不跨过视神经和血管间隙手术;可以抵近观察,多数肿瘤都能在直视下完成切除;对大脑、视神经和颈内动脉等重要结构干扰少,因而相关重要血管及神经术中损伤的机会小,相关并发症减少。但内镜下经鼻颅咽管瘤手术的局限也不容忽视,如操作空间受双侧颈内动脉及垂体限制,深部重要操作存在不安全因素,术后脑脊液漏,以及内镜下操作学习曲线长,手眼协调及术者配合需专门训练等。整体而言,在熟悉内镜解剖和熟练的内镜操作技巧的前提下,国内外多项研究都提示:内镜经鼻入路相比显微经颅入路具有更高的肿瘤全切率,临床症状缓解率更高,同时在下丘脑-垂体功能以及视神经功能上保护更好,安全性上更高;但脑脊液漏及颅内感染的概率较显微经颅入路更大[3,4]。为了便于手术入路的选择,国内外学者按照肿瘤解剖位置、与视交叉关系、对下丘脑推挤程度等对颅咽管瘤提出了众多分型。如Yasargil等[5]、Wang等[6]及Steno等[7]使用鞍内或鞍上型,脑室内或脑室外型区别肿瘤;Hoffman等[8]使用视交叉前或后区分肿瘤;Kassam[9]提出内镜下颅咽管瘤分型包括漏斗部前、横跨漏斗部和漏斗部后型;我国学者洪涛等[10]进一步优化,提出垂体柄中央型和垂体柄外周型;漆松涛等[11]根据起源位置与周边膜性结构关系提出QST分型。根据上述不同分型对应不同手术入路,具体可参照相关文献。
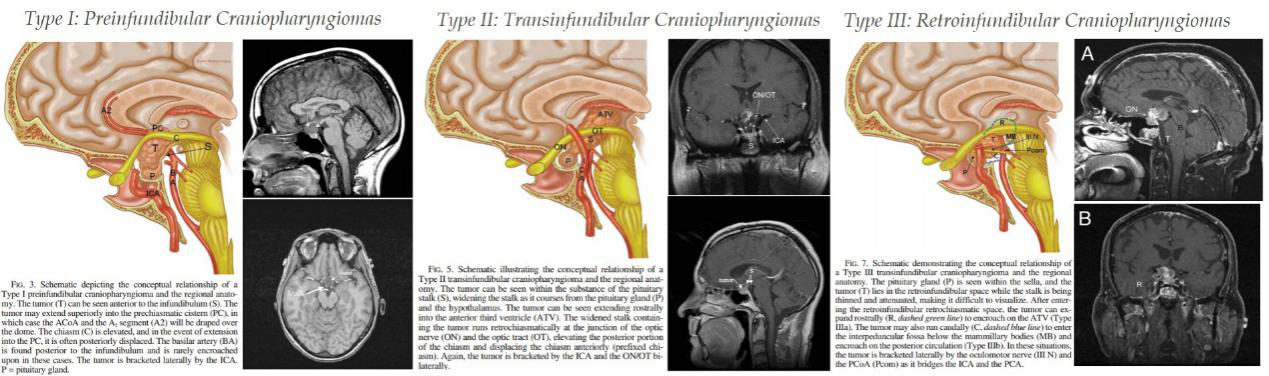
图5. Kassam内镜下颅咽管瘤分型,分为漏斗前型(Type I)、横跨漏斗型(Type II)和漏斗后型(Type III)。另Type IV为孤立三脑室型,与漏斗无直接关系。

图6. 洪涛内镜下颅咽管瘤分型,进一步优化垂体柄中央型(A、B)和垂体柄周围型(C、D)。
根据我们的经验,可否选择内镜下经鼻蝶扩大入路切除颅咽管瘤主要参考以下因素:
(1)肿瘤的累及范围,若肿瘤居于中线,外侧在颈内动脉分叉部以内,则适合经蝶手术;若肿瘤明显向侧方生长,则建议开颅手术;少数肿瘤累及分叉部外侧,范围较小且该部分为囊性的病灶,经蝶手术也有全切机会。
(2)手术通道:经蝶手术主要利用垂体与视交叉间的间隙,若术前矢状位磁共振提示该通道空间充分,则可经蝶手术;针对三脑室型颅咽管瘤,该通道狭小,部分学者采取视交叉上间隙亦可切除肿瘤,但手术难度较高。
(3)肿瘤毗邻关系,若肿瘤完全包饶血管、神经等重要结构,或开颅术后复发者与周围结构黏连复杂,则经蝶手术难度更大,选择开颅手术可控性更高。
(4)肿瘤质地、血供等因素,对实质性、质地韧、血供丰富的肿瘤,经蝶手术需要更高的手术技巧,应根据术者自身经验进行选择。本病例瘤体居于中线部位,肿瘤累及鞍内提供了手术通道,且瘤体对周围血管神经推移为主,故选择经蝶手术。而肿瘤体积大、质地韧、血供丰富,因此手术时间较长。
术中关键结构的保护。颅咽管瘤周围关系最密切的结构主要包括视交叉、垂体柄和下丘脑,由于上述结构都具有极其重要的生理作用,因此术中保护是手术成功的关键。其要点可概述为:直视下锐性分离。首先,需要仔细辨认相关结构。其中容易混淆的是肿瘤与垂体柄、下丘脑的界面。垂体柄可能被肿瘤推移至前、侧及后方,且形态改变,术前仔细阅片,术中全面探查,有助于尽早识别垂体柄加以保护;而部分垂体柄中央型垂体瘤,术中无法辨别该结构。下丘脑损伤危害更为严重,若术前影像提示三脑室底未完全突破,术中务必识别肿瘤与三脑室底界面,予以锐性分离。视神经损伤是另一常见并发症,因肿瘤压迫致神经功能极其脆弱,少量牵拉即可造成完全失明,因此充分显露并锐性分离,是保护视神经的核心原则。有时肿瘤与上述结构确难以分离,次全切除是较明智的选择。此外,术后激素及水电解质的监测和补充,也是确保围手术期安全的重要措施。
颅底重建相关问题。扩大经蝶入路术中必然出现脑脊液漏,因此良好的颅底重建技术是手术开展的前提。多层重建的方法以有大量文献详细描述,在此仅分享一些我们的经验。(1)高流量脑脊液漏患者,可术前即行腰大池置管引流,如此可避免术后即刻行腰大池引流时的困难,及等待次日再行腰大池引流的感染风险;(2)若脑室系统被打开,瘤腔内不可直接填塞脂肪,以防造成脑积水;可先用阔筋膜覆盖于硬膜下,仅用少量脂肪封堵与骨质缺损处;(3)近年来我单位采取硬膜缝合的方式,可进一步固定脂肪并增强颅底重建的强度,效果明显;(4)带蒂粘膜瓣须与蝶窦骨质贴合严密,如此可增加粘膜瓣存活率及修补成功率。
综上,颅咽管瘤仍是神经外科较有挑战性的疾病,全切肿瘤与功能保护是治疗的终极目标。对于部分颅咽管瘤患者,术后激素、电解质的紊乱仍难以避免,需要长期的激素替代治疗。因而,对于此类型肿瘤的手术策略需要综合考虑以及联合内分泌科等多学科治疗。
参考文献
1.Müller H.L, Craniopharyngioma. Endocr Rev, 2014. 35(3): p. 513-43.
2.Jho H.D. and R.L. Carrau, Endoscopic endonasal transsphenoidal surgery: experience with 50 patients. J Neurosurg, 1997. 87(1): p. 44-51.
3.邬迎喜, et al. 神经内镜扩大经鼻蝶切除术与开颅术治疗颅咽管瘤的疗效. 中华神经外科杂志, 2017. 33(10): p. 990-995.
4.Komotar R.J, et al. Endoscopic endonasal compared with microscopic transsphenoidal and open transcranial resection of craniopharyngiomas. World Neurosurg, 2012. 77(2): p. 329-41.
5.Yaşargil M.G, et al. Total removal of craniopharyngiomas. Approaches and long-term results in 144 patients. J Neurosurg, 1990. 73(1): p. 3-11.
6.Wang K.C, et al. Origin of craniopharyngiomas: implication on the growth pattern. Childs Nerv Syst, 2005. 21(8-9): p. 628-34.
7.Steno J, M Malácek, and I Bízik, Tumor-third ventricular relationships in supradiaphragmatic craniopharyngiomas: correlation of morphological, magnetic resonance imaging, and operative findings. Neurosurgery, 2004. 54(5): p. 1051-58; discussion 1058-60.
8.Hoffman H.J, Surgical management of craniopharyngioma. Pediatr Neurosurg, 1994. 21 Suppl 1: p. 44-9.
9.Kassam A.B, et al. Expanded endonasal approach, a fully endoscopic transnasal approach for the resection of midline suprasellar craniopharyngiomas: a new classification based on the infundibulum. J Neurosurg, 2008. 108(4): p. 715-28.
10.Tang B, et al. A novel endoscopic classification for craniopharyngioma based on its origin. Sci Rep, 2018. 8(1): p. 10215.
11.Qi S, et al. Anatomic relations of the arachnoidea around the pituitary stalk: relevance for surgical removal of craniopharyngiomas. Acta Neurochir (Wien), 2011. 153(4): p. 785-96.
(本文由浙二神外周刊原创,浙江大学医学院附属第二医院神经外科胡旺露研究生整理,闫伟副主任医师审校,张建民主任终审)
![]()
版权声明





