近期,中国人民解放军总医院神经外科医学部余新光教授团队的研究论文《TRIM24 Promotes Stemness and Invasiveness of Glioblastoma Cells via Activating SOX2 Expression》(TRIM24通过激活SOX2表达从而促进胶质母细胞瘤细胞的干性和侵袭),在线发表于神经肿瘤权威期刊《Neuro-Oncology》,第一作者章露华博士后。
2015年,章露华、章翔教授等发表于《Oncogene》期刊的一篇论著首次揭示TRIM24分子在胶质瘤中高表达,其表达水平与患者预后密切相关。采用胶质瘤细胞系进行体外和体内实验发现,TRIM24能够促进肿瘤细胞的生长和耐药[4]。那么,高表达的TRIM24是否集中在肿瘤细胞亚群-GSC,又是否具有生物学功能呢?
解放军总医院神经外科医学部团队在多年胶质瘤研究的基础上,与军事医学研究院徐东刚研究员课题组合作,分析大量胶质瘤病例,在国际上率先提出TRIM24在GSC中优势表达,并深入探索了病理机制。
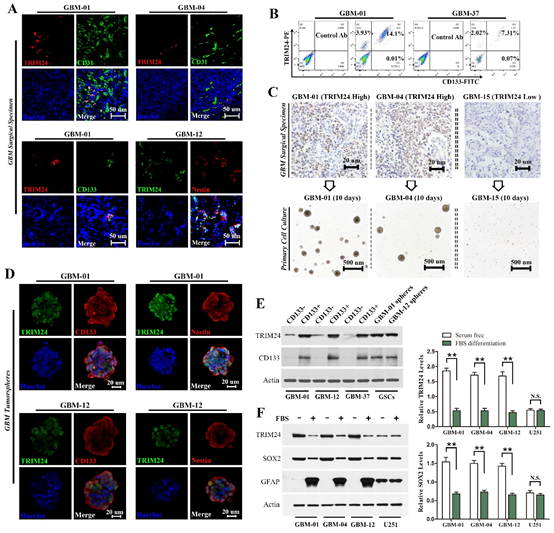
图1. TRIM24富集于GSC。
(A)TRIM24集中在血管周边区域的细胞并与干细胞标志物(CD133和Nestin)共表达;(B)流式细胞术证实TRIM24与CD133共表达;(C)只有TRIM24高表达病例的肿瘤细胞能在干细胞培养基中存活并持续自我更新;(D)TRIM24集中在流式分选后的CD133阳性细胞中;(E)随着GSC的分化,TRIM24水平急剧降低。
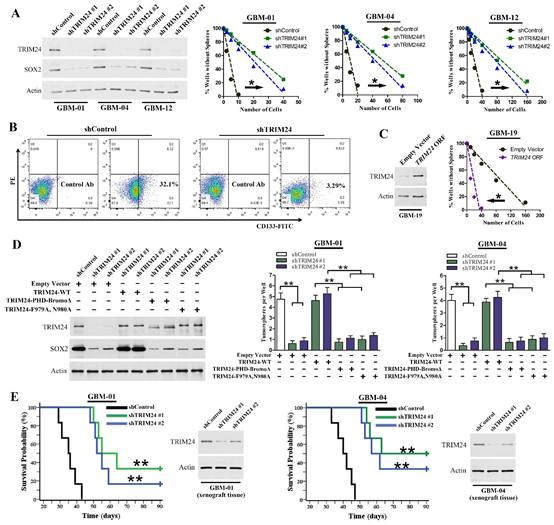
图2. TRIM24在GSC中发挥关键作用。
(A)干涉TRIM24表达后,GSC的肿瘤球形成能力明显减弱;(B)干涉TRIM24表达后,CD133阳性细胞百分比减少;(C)过表达TRIM24可以增强GSC的肿瘤球形成能力;(D)野生型TRIM24可以逆转由于TRIM24下调引起的肿瘤球形成能力变化,而突变型TRIM24无此功能;(E)干涉TRIM24表达后,原位荷瘤裸鼠的生存时间显著延长。
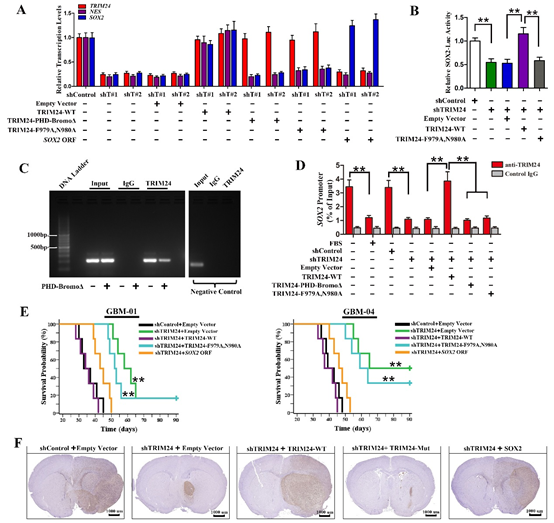
图3. TRIM24通过激活SOX2表达调控GSC的干性。
(A)TRIM24表达量决定SOX2转录水平;(B)TRIM24状态影响SOX2基因启动子的转录活性;(C)TRIM24的PHD-Bromo结构域结合SOX2基因启动子区域;(D)诱导GSC分化或者干涉TRIM24表达,TRIM24与SOX2基因启动子区域结合减少;(E)过表达SOX2可以逆转由于TRIM24下调引起的裸鼠存活时间延长;(F)TRIM24表达下调的GSC形成的瘤体减小,而且肿瘤边界变得清晰。
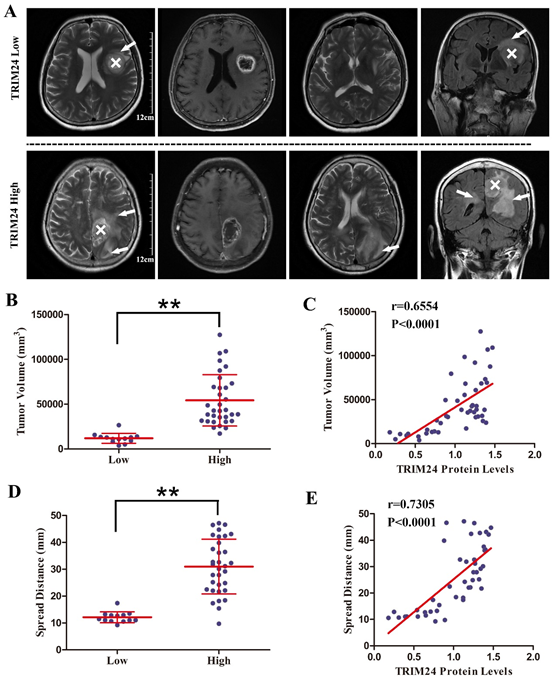
图4. 肿瘤TRIM24表达水平与患者MRI异常信号延伸范围相关。
(A)TRIM24高表达病例的T2加权异常信号扩散更广;(B)TRIM24高表达组的异常信号体积明显大于TRIM24低表达组;(C)TRIM24表达水平与异常信号体积正相关;(D)TRIM24高表达组的异常信号延伸距离明显长于TRIM24低表达组;(E)TRIM24表达水平与异常信号延伸距离正相关。
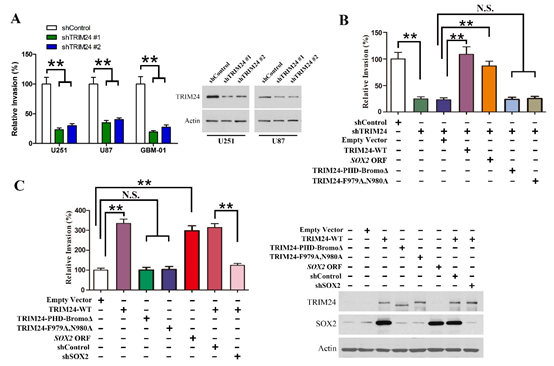
图5. TRIM24促进肿瘤细胞体外侵袭。
(A)干涉TRIM24表达后,肿瘤细胞侵袭能力减弱;(B)野生型TRIM24可以逆转由于TRIM24下调引起的侵袭能力变化,而突变型TRIM24无此功能;(C)过表达TRIM24可以增强肿瘤细胞侵袭能力,而SOX2发挥介导作用。
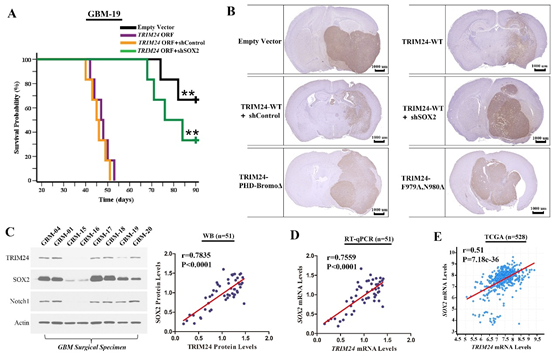
图6. TRIM24促进肿瘤细胞体内侵袭以及TRIM24-SOX2调控机制的临床验证。
(A)过表达TRIM24可以使原位荷瘤裸鼠的生存时间显著缩短,而同时干涉SOX2表达可以有效逆转此变化;(B)TRIM24低表达组的细胞成瘤边界相对较清,而过表达野生型TRIM24或者SOX2可以使肿瘤边界变得模糊,并沿着神经纤维束浸润;(C)本组病例中TRIM24与SOX2蛋白质水平正相关;(D)本组病例中TRIM24与SOX2的mRNA水平正相关;(E)检索TCGA数据库进一步证实TRIM24与SOX2的正相关关系。
以上临床及实验数据表明,TRIM24通过激活SOX2表达从而促进胶质母细胞瘤干细胞的干性和侵袭。解放军总医院团队的此项研究,首次阐述了TRIM24-SOX2信号通路在肿瘤干细胞中的关键作用,也为胶质瘤复发的科学精准防治提供了新思路。
参考文献
[1] Ostrom QT, Cioffi G, Gittleman H, et al. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2012-2016. Neuro Oncol. 2019; 21(Supplement_5):v1-v100.
[2] Aldape K, Brindle KM, Chesler L, et al.Challenges to curing primary brain tumours. Nat Rev Clin Oncol. 2019; 16(8):509-520.
[3] Jung E, Alfonso J, Osswald M, Monyer H, Wick W, Winkler F. Emerging intersections between neuroscience and glioma biology. Nat Neurosci. 2019; 22(12):1951-1960.
[4] Zhang LH, Yin AA, Cheng JX, et al. TRIM24 promotes glioma progression and enhances chemoresistance through activation of the PI3K/Akt signaling pathway. Oncogene. 2015; 34(5):600-610.
术者简介


![]()
版权声明
神外资讯APP所发表的作品包括但不限于文字、图片、视频的版权均为主办方/原作者及神外资讯所有,未经神外资讯明确授权,任何人不得以改编、裁切、复制、转载、摘编、录制等直接或间接的方式盗取任何内容。经神外资讯授权使用的作品,应在授权范围内使用,并请注明来源:神外资讯。如有违反,神外资讯将保留进一步追究侵权者法律责任的权利。神外资讯欢迎个人转发、分享本号发表的作品。




